名校
1 . 根据下列实验现象或要求写离子方程式(描述现象的,需要写出所有涉及的离子方程式。非特殊说明,书写离子方程式)
| 实验现象 | 离子方程式 |
| 1.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | |
| 2.制备氢氧化铁胶体的化学方程式 | |
| 3.二氧化硫使酸性高锰酸钾溶液褪色 | |
| 4.Fe3O4溶于稀硝酸 | |
| 5.氯化亚铁溶液通入少量氯气,变为黄色溶液,加入过量碘化钾溶液,溶液颜色加深,继续加入NaOH溶液,出现白色沉淀,且颜色不断加深至红褐色。 | |
| 6.澄清石灰水中通入CO2出现白色沉淀,继续通入二氧化碳,沉淀溶解,加热后又出现白色沉淀。 | |
| 7.三氯化铝溶液中加逐滴加入NaOH溶液,先出现白色沉淀,然后溶解,再通入CO2至刚开始出现沉淀。 | |
| 8.NH4Al(SO4)2溶液与Ba(OH)2溶液物质的量1∶2混合 | |
| 9.FeI2与Cl2物质的量1∶2反应 | |
| 10.Ba(OH)2中加入硫酸铝溶液,至沉淀质量不再改变。再加入过量NaHCO3溶液,又出白色沉淀。 | |
| 11.生产硫化钠大多采用无水芒硝(Na2SO4)—碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式 | |
| 12.温度高于200 ℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),写出该反应的化学方程式 | |
| 13.湿法制备高铁酸钾(K2FeO4)的过程为,在氢氧化铁固体中加入KClO和KOH的混合液。写出该过程的离子方程式并配平。 |
您最近一年使用:0次
2019-09-07更新
|
250次组卷
|
3卷引用:宁夏石嘴山市第三中学2020届高三上学期第一次适应性(开学)考试化学试题
宁夏石嘴山市第三中学2020届高三上学期第一次适应性(开学)考试化学试题(已下线)第二节 离子反应(二)-2020-2021学年高一化学必修第一册课时同步练(新人教)9.2.1反应的合理选择(课后)-2019苏教版必修2课前课中课后
13-14高三上·福建福州·期中
2 . 用下图所示装置进行实验(夹持装置已略去)。请回答下列问题:
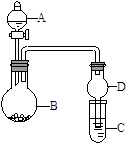
(1)若A中为浓硝酸,B中为铜单质,C中为氢氧化钠溶液。现将浓硝酸滴入B中,则B中发生反应的化学方程式为______ 。
(2)若A中为浓氨水,B中为生石灰,C中为明矾溶液。
①将浓氨水逐滴滴入B中,可产生大量氨气,原因可能是__________ (填序号)。
a.生石灰和浓氨水反应产生氨气,氨气易溶于水
b.生石灰和水反应,消耗水,使氨气的溶解量减少
c.反应放出大量热,使氨气在水中溶解度明显降低
② C中通入过量氨气时,反应的离子方程式为________ 。
(3)若A中为水,B中为过氧化钠,C中为酸性淀粉碘化钾溶液,将水滴入B中后,B中的实验现象为________ ;若C中溶液变为蓝色,则C中发生反应的离子方程式为__________ 。

(1)若A中为浓硝酸,B中为铜单质,C中为氢氧化钠溶液。现将浓硝酸滴入B中,则B中发生反应的化学方程式为
(2)若A中为浓氨水,B中为生石灰,C中为明矾溶液。
①将浓氨水逐滴滴入B中,可产生大量氨气,原因可能是
a.生石灰和浓氨水反应产生氨气,氨气易溶于水
b.生石灰和水反应,消耗水,使氨气的溶解量减少
c.反应放出大量热,使氨气在水中溶解度明显降低
② C中通入过量氨气时,反应的离子方程式为
(3)若A中为水,B中为过氧化钠,C中为酸性淀粉碘化钾溶液,将水滴入B中后,B中的实验现象为
您最近一年使用:0次
2018高三上·全国·专题练习
3 . 下列有关实验原理或操作正确的是
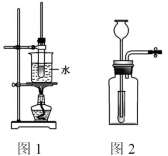

| A.配制0.1 mol/L烧碱溶液时,容量瓶应先用0.1 mol/L烧碱溶液润洗 |
| B.不用其他试剂即能鉴别出Al2(SO4)3、KOH、HCl、KCl四种溶液 |
| C.实验室可用如图1所示的装置制备乙酸丁酯 (已知乙酸丁酯的沸点为124~126 ℃,反应温度为115~125 ℃) |
| D.实验室用如图2所示的装置制备氢气时,该装置符合“随开随制、随关随停”的要求 |
您最近一年使用:0次
2017·浙江·一模
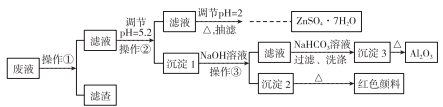
4 . 用Zn(主要含有Fe、Al、Pb杂质)和硫酸来制取H2,利用制氢废液制备硫酸锌晶体(ZnSO4·7H2O)、Al2O3和Fe2O3,流程如下:
已知Al3+、Fe3+、Zn2+的氢氧化物完全沉淀的pH分别为5.2、4.1和8.5,ZnSO4·7H2O晶体易溶于水,易风化。回答下列问题:
(1)调节pH=2的目的是______________ ,调节pH=2,可加入_________ (填化学式)。
(2)写出生成沉淀3的化学方程式:______________________ 。
(3)加热浓缩ZnSO4溶液出现极薄品膜时,要停止加热的主要原因是_____________ 。
(4)某同学用如图所示的装置抽滤。
①有关抽滤的说法正确的是__________ 。
A.抽滤的目的主要是得到较干燥的沉淀
B.滤纸的直径应略小于漏斗内径,又能盖住全部小孔
C.图中有一处出错
D.抽滤结束,从吸滤瓶的支管口倒出滤液
②抽滤,洗涤沉淀的具体操作是___________________________ 。
(5)为得到干燥的ZnSO4·7H2O产品,选择干燥方法是________ 。
A.加热烘干 B.用浓H2SO4干燥
C.用酒精洗干 D.在空气中自然干燥
已知Al3+、Fe3+、Zn2+的氢氧化物完全沉淀的pH分别为5.2、4.1和8.5,ZnSO4·7H2O晶体易溶于水,易风化。回答下列问题:
(1)调节pH=2的目的是
(2)写出生成沉淀3的化学方程式:
(3)加热浓缩ZnSO4溶液出现极薄品膜时,要停止加热的主要原因是
(4)某同学用如图所示的装置抽滤。
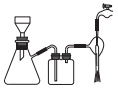
①有关抽滤的说法正确的是
A.抽滤的目的主要是得到较干燥的沉淀
B.滤纸的直径应略小于漏斗内径,又能盖住全部小孔
C.图中有一处出错
D.抽滤结束,从吸滤瓶的支管口倒出滤液
②抽滤,洗涤沉淀的具体操作是
(5)为得到干燥的ZnSO4·7H2O产品,选择干燥方法是
A.加热烘干 B.用浓H2SO4干燥
C.用酒精洗干 D.在空气中自然干燥
您最近一年使用:0次
2011·新疆乌鲁木齐·三模
解题方法
5 . A、B、C、D、E、F、G、H是元素周期表中八种原子序数依次增大的短周期元素。
①A元素的原子半径在周期表中最小
②B元素的原子最外层电子数是次外层电子数的两倍
③C元素的最高价氧化物的水化物和氢化物反应生成盐
④D元素和E元素可以形成E2D、E2D2两种离子化合物
⑤G与D两种元素同主族,F、G、H三种元素同周期
⑥F元素是同周元素中离子半径最小的元素,H元素是同周期元素中原子半径最小的元素
(1)写出A、D、E三种元素形成的化合物的电子式__________ ;
(2)用惰性电极电解由E与H两元素形成的化合物的水溶液,其化学方程式为_________ ;
(3)八种元素中任意三种组成的易溶于水的酸性物质,能促进水电离的是________ ,能抑制水电离的是______________ (各写一种化学式);
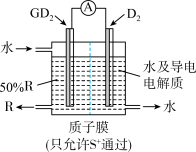
(4)某科研单位依据电化学原理用GD2来制备一种强酸R,装置如右图,电极为含有某种催化剂的多孔材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入GD2的电极为___________ 极,其电极反应式为___________ ;
(5)甲、乙、丙分别是B、F、G三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应产物不同。回答问题:
①向甲溶液中缓慢滴加过量的丙溶液,可观察到的实验现象是__________ ;
②向乙溶液中缓慢滴加过量的丙溶液发生反应的离子方程式为_________ 、_________ 。
①A元素的原子半径在周期表中最小
②B元素的原子最外层电子数是次外层电子数的两倍
③C元素的最高价氧化物的水化物和氢化物反应生成盐
④D元素和E元素可以形成E2D、E2D2两种离子化合物
⑤G与D两种元素同主族,F、G、H三种元素同周期
⑥F元素是同周元素中离子半径最小的元素,H元素是同周期元素中原子半径最小的元素
(1)写出A、D、E三种元素形成的化合物的电子式
(2)用惰性电极电解由E与H两元素形成的化合物的水溶液,其化学方程式为
(3)八种元素中任意三种组成的易溶于水的酸性物质,能促进水电离的是
(4)某科研单位依据电化学原理用GD2来制备一种强酸R,装置如右图,电极为含有某种催化剂的多孔材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入GD2的电极为

(5)甲、乙、丙分别是B、F、G三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应产物不同。回答问题:
①向甲溶液中缓慢滴加过量的丙溶液,可观察到的实验现象是
②向乙溶液中缓慢滴加过量的丙溶液发生反应的离子方程式为
您最近一年使用:0次



