1 . 硝酸铝是重要的化工原料。
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有_____ 。
A.可燃性 B.氧化性 C.还原性
(2)用Al作电极电解HNO3溶液制取Al(NO3)3,电解反应的离子方程式为____________ 。
(3)查资料得知:当Al(NO3)3溶液pH>3时,铝元素有多种存在形态,如Al3+、[Al(OH)]2+、[Al(OH)2]+等。写出[Al(OH)]2+转化为[Al(OH)2]+的离子方程式________________ 。
(4)用硝酸铝溶液(加入分散剂)制备纳米氧化铝粉体的一种工艺流程如下。

①(CH2)6N4水溶液显碱性。请补充完整下列离子方程式。
___(CH2)6N4+___H2O ___HCHO+______+___OH-
___HCHO+______+___OH-
___________________________________
②经搅拌Ⅱ,pH下降的原因是__________________ 。
③凝胶中含有的硝酸盐是____________ 。
(Ksp[Al(OH)3] =1.3×10−33 ;溶液中离子浓度小于1×10−5 mol∙L−1时,可认为这种离子在溶液中不存在)
④煅烧过程主要发生如下转化:凝胶 勃姆石(γ−AlOOH)
勃姆石(γ−AlOOH)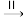 γ−Al2O3
γ−Al2O3 α−Al2O3。
α−Al2O3。
煅烧过程中样品的失重率(TG%)随温度变化如图。凝胶煅烧失重曲线有明显的三个阶段:

(i)a~b段:失重率82.12%;
(ii)b~c段:失重率9.37%;
(iii)c~d段:失重率几乎为0;
转化Ⅱ对应的失重阶段是______ (填序号),转化Ⅲ开始的温度是_______ 。
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有
A.可燃性 B.氧化性 C.还原性
(2)用Al作电极电解HNO3溶液制取Al(NO3)3,电解反应的离子方程式为
(3)查资料得知:当Al(NO3)3溶液pH>3时,铝元素有多种存在形态,如Al3+、[Al(OH)]2+、[Al(OH)2]+等。写出[Al(OH)]2+转化为[Al(OH)2]+的离子方程式
(4)用硝酸铝溶液(加入分散剂)制备纳米氧化铝粉体的一种工艺流程如下。

①(CH2)6N4水溶液显碱性。请补充完整下列离子方程式。
___(CH2)6N4+___H2O
 ___HCHO+______+___OH-
___HCHO+______+___OH-②经搅拌Ⅱ,pH下降的原因是
③凝胶中含有的硝酸盐是
(Ksp[Al(OH)3] =1.3×10−33 ;溶液中离子浓度小于1×10−5 mol∙L−1时,可认为这种离子在溶液中不存在)
④煅烧过程主要发生如下转化:凝胶
 勃姆石(γ−AlOOH)
勃姆石(γ−AlOOH)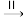 γ−Al2O3
γ−Al2O3 α−Al2O3。
α−Al2O3。煅烧过程中样品的失重率(TG%)随温度变化如图。凝胶煅烧失重曲线有明显的三个阶段:

(i)a~b段:失重率82.12%;
(ii)b~c段:失重率9.37%;
(iii)c~d段:失重率几乎为0;
转化Ⅱ对应的失重阶段是
您最近一年使用:0次
2 . 金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下图所示:

其中,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1)当Al与稀硝酸反应时,稀硝酸表现的性质是__________ 。
A.只表现强氧化性
B.只表现酸性
C.同时表现强氧化性及酸性
D.表现了强氧化性还表现了还原性
(2)在下列离子方程式的横线上填写产物的化学式(不需要配平)
Al + NO3-+ OH-+ H2O→____ +___ 。
(3)过量D的水溶液与A溶液反应的离子方程式是______________________ 。
(4)D→C反应的化学方程式是______________________________________________ 。
(5)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质是_______ 。
(6)除去C中的E气体杂质可用的化学方法是:(用化学方程式表示)____________ 。
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是_______ 。

其中,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1)当Al与稀硝酸反应时,稀硝酸表现的性质是
A.只表现强氧化性
B.只表现酸性
C.同时表现强氧化性及酸性
D.表现了强氧化性还表现了还原性
(2)在下列离子方程式的横线上填写产物的化学式(不需要配平)
Al + NO3-+ OH-+ H2O→
(3)过量D的水溶液与A溶液反应的离子方程式是
(4)D→C反应的化学方程式是
(5)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质是
(6)除去C中的E气体杂质可用的化学方法是:(用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是
您最近一年使用:0次
解题方法
3 . 铁、铝及其化合物的应用十分广泛,请回答:
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有____________ (填字母序号)。
A.可燃性 B.氧化性 C.还原性
(2)已知:当Al(NO3),溶液中pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式_________________ 。
(3)氯化铁溶液常用作印刷电路铜板的腐蚀剂,反应的离子方程式为___________ ;从腐蚀废液中回收金属铜还需要的试剂是__________ 。
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160 mL5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),溶液中铁元素的存在形式为________ (填离子符号),检验该离子的实验操作、现象和结论是_________ ;参加反应的铁粉的质量为______________ 。
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有
A.可燃性 B.氧化性 C.还原性
(2)已知:当Al(NO3),溶液中pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式
(3)氯化铁溶液常用作印刷电路铜板的腐蚀剂,反应的离子方程式为
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160 mL5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),溶液中铁元素的存在形式为
您最近一年使用:0次
名校
4 . 下列实验操作、现象和结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向FeSO4溶液中滴入少量酸性KMnO4溶液 | KMnO4溶液紫色褪去 | Fe2+有氧化性 |
| B | 向Na2SiO3溶液中通入适量的CO2 | 产生白色胶状物质 | 酸性:H2CO3>H2SiO3 |
| C | 将新制氯水和NaBr溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液呈橙红色 | 氧化性:Cl2>Br2 |
| D | 向Al2(SO4)3溶液中滴加过量氨水 | 溶液先浑浊后澄清 | Al3+与NH3·H2O不能大量共存 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2015-06-17更新
|
277次组卷
|
2卷引用:2015届广东省广州市高三综合测试(二)理综化学试卷
名校
5 . A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:___________ 。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:________ 。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:_________ 。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素为同主族,且溶液均显碱性,其中C可用作粘合剂。写出④反应的化学方程式:______ 。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于刻蚀印刷铜电路板,写出该反应的离子方程式:______ 。

(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素为同主族,且溶液均显碱性,其中C可用作粘合剂。写出④反应的化学方程式:
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于刻蚀印刷铜电路板,写出该反应的离子方程式:
您最近一年使用:0次
名校
解题方法
6 . A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):
A B
B C
C
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为___________ (填元素符号)
(2)若D是金属,C溶液在储存时应加入少量金属D,其理由是(用必要的文字和离子方程式表示)______
(3)若A、B、C为含同一种金属元素的无机化合物,且三种物质中有一种是白色不溶物。在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子力程式_________ 、_________
(4)某一离子反应体系有反应物和产物共以下六种:MnO4-、H+、O2、H2O、H2O2、Mn2+。
①写出该氧化还原反应的离子方程式_______
②溶液随着酸性的增强氧化性不断增强,应选择_________ (选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
③如反应转移了0.6mol电子,则产生的气体在标准状况下体积为__________
(5)一份溶液中可能含有K+、Al3+、Mg2+、Fe2+、 H+、NH4+、Cl-、HCO3-、ClO-、AlO2-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
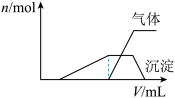
往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示;则该溶液中一定存在的离子是_______ ,一定不存在的离子是________ 。
A
 B
B C
C试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为
(2)若D是金属,C溶液在储存时应加入少量金属D,其理由是(用必要的文字和离子方程式表示)
(3)若A、B、C为含同一种金属元素的无机化合物,且三种物质中有一种是白色不溶物。在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子力程式
(4)某一离子反应体系有反应物和产物共以下六种:MnO4-、H+、O2、H2O、H2O2、Mn2+。
①写出该氧化还原反应的离子方程式
②溶液随着酸性的增强氧化性不断增强,应选择
③如反应转移了0.6mol电子,则产生的气体在标准状况下体积为
(5)一份溶液中可能含有K+、Al3+、Mg2+、Fe2+、 H+、NH4+、Cl-、HCO3-、ClO-、AlO2-等离子中的若干种。为了确定溶液的组成,进行了如下操作:

往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示;则该溶液中一定存在的离子是
您最近一年使用:0次
名校
解题方法
7 . A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。试回答:
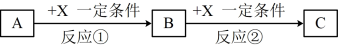
(1)若X是强氧化性单质,则A不可能是____ 。
a.S b.N2 c.Na d.Mg e.Al
(2)若A为强碱溶液,则X可能为____ 。
a.CO2 b.AlCl3 c.Al d.Mg e.Al2O3
(3)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____ ;C溶液在贮存时应加入少量X,理由是(离子方程式表示)___ ,检验此C溶液中金属元素价态的操作方法是____ 。
(4)若A、B、C为含有金属元素的化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为____ ,X的化学式可能为(写出不同类物质)____ 或____ ,反应②的离子方程式为___ 或___ 。

(1)若X是强氧化性单质,则A不可能是
a.S b.N2 c.Na d.Mg e.Al
(2)若A为强碱溶液,则X可能为
a.CO2 b.AlCl3 c.Al d.Mg e.Al2O3
(3)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为
(4)若A、B、C为含有金属元素的化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为
您最近一年使用:0次
2019-12-22更新
|
116次组卷
|
3卷引用:江西省宜春市奉新县冶城职业学校(奉新县第三中学)2020-2021学年高三上学期第四次月考化学试题
8 . 金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下:

已知气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。请回答下列问题:
(1)A和B两溶液混合产生白色沉淀,反应的离子方程式为_________________________ 。
(2)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C或E都转化为无毒的气态单质,任意写出其中一个反应的化学方程式:______________ 。
(3)写出铝在碱性条件下与NO3-反应的离子方程式:________________ 。
(4)除去气体C中的杂质气体E的化学方法:__________________ (用化学方程式表示)。
(5)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是________ 。
(6)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是___________________________ 。

已知气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。请回答下列问题:
(1)A和B两溶液混合产生白色沉淀,反应的离子方程式为
(2)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C或E都转化为无毒的气态单质,任意写出其中一个反应的化学方程式:
(3)写出铝在碱性条件下与NO3-反应的离子方程式:
(4)除去气体C中的杂质气体E的化学方法:
(5)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是
(6)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是
您最近一年使用:0次
9 . 根据下列实验操作和现象所得出的结论正确的是
| 操作 | 现象 | 结论 | |
| A | 向酸性高锰酸钾溶液中滴加双氧水 | 紫色褪色,产生气泡 | H2O2具有氧化性 |
| B | 向某溶液中滴加KSCN溶液 | 溶液变成红色 | 溶液中没有Fe2+ |
| C | 向NaCl、NaI的混合稀溶液中滴入几滴稀AgNO3溶液 | 出现黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| D | 向NaAlO2溶液中滴入NaHCO3溶液 | 有白色沉淀生成 | AlO2-结合H+的能力比CO32-强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10 . A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
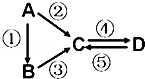
(1)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出B→C的化学方程式:________________ .
(2)若D物质具有两性,②、③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出A→C的离子方程式:_________________ .
(3)若A是太阳能电池用的光伏材料。B为A单质的氧化物,C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出写出B→C的离子方程式:_______________ .
(4)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出C→D的离子方程式:__________________ .
(5)若A为淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。B与C可反应生成A。已知B的燃烧热为586.16kJ/mol,写出B的燃烧热的热的化学方程式:_____________________ .

(1)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出B→C的化学方程式:
(2)若D物质具有两性,②、③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出A→C的离子方程式:
(3)若A是太阳能电池用的光伏材料。B为A单质的氧化物,C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出写出B→C的离子方程式:
(4)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出C→D的离子方程式:
(5)若A为淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。B与C可反应生成A。已知B的燃烧热为586.16kJ/mol,写出B的燃烧热的热的化学方程式:
您最近一年使用:0次



