名校
1 . 下列实验操作正确或实验设计能达到实验目的的是
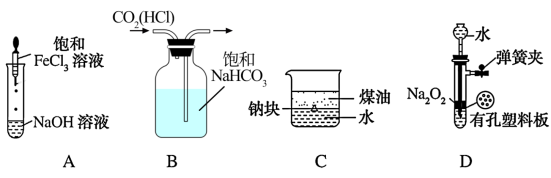

| A.制备氢氧化铁胶体 |
| B.除去二氧化碳中的氯化氢 |
| C.证明钠的密度小于水的密度但大于煤油的密度 |
| D.利用过氧化钠与水反应制备氧气,且随开随用、随关随停 |
您最近一年使用:0次
2022-01-18更新
|
637次组卷
|
4卷引用:山东省济南市2021-2022上学期高一上学期期末考试化学试题
名校
解题方法
2 . 下列实验方法不能 达到实验目的的是
| 证明铁钉能够发生析氢腐蚀 | 证明氨气易溶于水 | 制备乙酸乙酯 | 制备Fe(OH)3胶体 |
 |  |  | 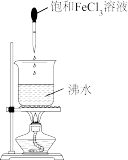 |
A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-04-05更新
|
464次组卷
|
4卷引用:北京市朝阳区2021届高三一模化学试题
11-12高三上·河南郑州·阶段练习
3 . 下列装置或操作不能达到实验目的的是 ( )
A.利用排空气法收集CO2  |
B.实验室制取NH3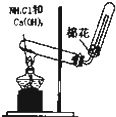 |
C.实验室制取Fe(OH)2 |
D.实验室制乙酸乙酯 |
您最近一年使用:0次
名校
4 . 下列实验操作或事实与预期实验目的或所得结论对应正确的是( )
选项 | 实验操作或事实 | 实验目的或结论 |
| A | 淡黄色试液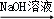 红褐色沉淀 红褐色沉淀 | 说明原溶液中一定含所有FeCl3 |
| B | CaO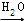 Ca(OH)2 Ca(OH)2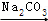 NaOH NaOH | 用生石灰制备NaOH溶液 |
| C | 新收集的酸雨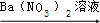 白色沉淀 白色沉淀 | 酸雨中一定含有SO42- |
| D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于三元酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-07-23更新
|
322次组卷
|
3卷引用:辽宁省瓦房店市高级中学2016-2017学年高二下学期期末考试化学试题
名校
解题方法
5 . 甲同学用下图所示装置进行Fe粉与水蒸气的反应.
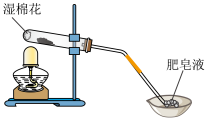
(1)请写出发生反应的化学方程式:____________________________________ ;证明实验中有氢气产生的操作及现象是_______________________________________
(2)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
①乙同学认为该条件下反应的固体产物不含+3价铁元素,丙同学认为该结论不正确,理由是______________________________________ .
②继续向Ⅱ溶液中滴加氯水,立即出现红色,写出该过程中 发生变化的离子方程式
发生变化的离子方程式_______________ .
③取Ⅰ所得溶液,加入过量 溶液观察到的实验现象是
溶液观察到的实验现象是_____________ ,其中发生的氧化还原反应的化学方程式为____________________________ .

(1)请写出发生反应的化学方程式:
(2)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
| 步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验Ⅰ中得到的溶液滴加几滴 溶液,振荡 溶液,振荡 | 溶液没有变红 |
②继续向Ⅱ溶液中滴加氯水,立即出现红色,写出该过程中
 发生变化的离子方程式
发生变化的离子方程式③取Ⅰ所得溶液,加入过量
 溶液观察到的实验现象是
溶液观察到的实验现象是
您最近一年使用:0次
解题方法
6 . 铁及其化合物在生产、生活中有重要作用。回答下列问题:
I.硫酸亚铁晶体 在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:

(1)证明经步骤①得到的滤液中含有 的方法如下:取样,先滴加
的方法如下:取样,先滴加___________ ,再滴加少量氯水,该过程的现象为___________ 。
(2)步骤②加入氯水发生反应的离子方程式是___________ 。
(3)步骤③产生的红褐色物质成分是___________ (写化学式)。
(4)步骤④中一系列操作为___________ 、洗涤、干燥、灼烧。
(5)若所取补血剂质量为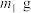 ,最终得到红棕色固体C的质量为
,最终得到红棕色固体C的质量为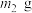 ,则补血剂中硫酸亚铁晶体的质量分数为
,则补血剂中硫酸亚铁晶体的质量分数为___________ (用含 、
、 的代数式表示,不考虑实验中铁元素的损失)。
的代数式表示,不考虑实验中铁元素的损失)。
II.高铁酸钾 是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:

(6)过程①制取1mol ,理论上需要
,理论上需要 物质的量为
物质的量为___________ ,步骤②中反应能够发生的原因是___________ ,分离出 固体的操作中使用的玻璃仪器有
固体的操作中使用的玻璃仪器有___________ 。
I.硫酸亚铁晶体
 在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
(1)证明经步骤①得到的滤液中含有
 的方法如下:取样,先滴加
的方法如下:取样,先滴加(2)步骤②加入氯水发生反应的离子方程式是
(3)步骤③产生的红褐色物质成分是
(4)步骤④中一系列操作为
(5)若所取补血剂质量为
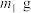 ,最终得到红棕色固体C的质量为
,最终得到红棕色固体C的质量为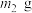 ,则补血剂中硫酸亚铁晶体的质量分数为
,则补血剂中硫酸亚铁晶体的质量分数为 、
、 的代数式表示,不考虑实验中铁元素的损失)。
的代数式表示,不考虑实验中铁元素的损失)。II.高铁酸钾
 是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
(6)过程①制取1mol
 ,理论上需要
,理论上需要 物质的量为
物质的量为 固体的操作中使用的玻璃仪器有
固体的操作中使用的玻璃仪器有
您最近一年使用:0次
名校
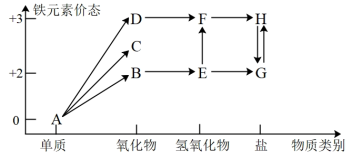
7 . 铁是人类较早使用的金属之一,下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系。运用铁及其化合物的知识,回答下列问题。_______ ;E→F反应的化学方程式是_______ ,该反应过程的现象为_______ 。
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,高铁酸钾作为自来水处理剂的优点_______ ;湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式
、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式_______ 。
(3)将FeCl3饱和溶液滴入沸水中,继续煮沸至液体呈_______ ,制得分散系为_______ ,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_______ 。
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路请写出FeCl3溶液与铜反应的离子方程式:_______ 。
(5)城市饮用水处理新技术用NaClO2、高铁酸钠代替Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么NaClO2、Na2FeO4、Cl2的消毒效率由大到小的顺序是_______ 。
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,高铁酸钾作为自来水处理剂的优点
 、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式
、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式(3)将FeCl3饱和溶液滴入沸水中,继续煮沸至液体呈
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路请写出FeCl3溶液与铜反应的离子方程式:
(5)城市饮用水处理新技术用NaClO2、高铁酸钠代替Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么NaClO2、Na2FeO4、Cl2的消毒效率由大到小的顺序是
您最近一年使用:0次
名校
8 . 高铁酸钾( )是优质水处理剂。实验室制取
)是优质水处理剂。实验室制取 的装置如图。
的装置如图。
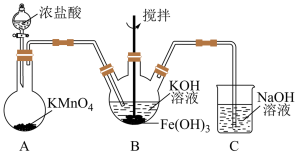
 的制备原理为:
的制备原理为:
回答下列问题
(1)A装置的作用是_______ 。盛浓盐酸的仪器名称为_______ 。
(2)装置C的作用是_______ 。B装置内出现_______ 现象时,说明B中反应已停止。
(3)分析 是优质水处理剂的原因可能是
是优质水处理剂的原因可能是_______ 。
(4)当上述反应消耗标准状况下 时,生成
时,生成 质量为
质量为_______ 。
 )是优质水处理剂。实验室制取
)是优质水处理剂。实验室制取 的装置如图。
的装置如图。
 的制备原理为:
的制备原理为:
回答下列问题
(1)A装置的作用是
(2)装置C的作用是
(3)分析
 是优质水处理剂的原因可能是
是优质水处理剂的原因可能是(4)当上述反应消耗标准状况下
 时,生成
时,生成 质量为
质量为
您最近一年使用:0次
9 . 铁泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)是一种常见的工业废料,为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁(FeSO4·7H2O)或柠檬酸铁铵。

(1)过程I
① Fe2O3与硫酸反应的离子方程式为_______ 。
② 分离出杂质的操作是_______ 。
(2)制备柠檬酸铁铵
① 补全过程II中发生反应的离子方程式:_______ 。
_______+1 H+ +1 H2O2 = 1 Fe3++1 _______。
② 过程III中,加入氨水后,可观察到的现象为_______ 。
(3)制备FeSO4·7H2O
过程V中,用离子方程式说明加入铁屑的主要目的是_______ 。

(1)过程I
① Fe2O3与硫酸反应的离子方程式为
② 分离出杂质的操作是
(2)制备柠檬酸铁铵
① 补全过程II中发生反应的离子方程式:
_______+1 H+ +1 H2O2 = 1 Fe3++1 _______。
② 过程III中,加入氨水后,可观察到的现象为
(3)制备FeSO4·7H2O
过程V中,用离子方程式说明加入铁屑的主要目的是
您最近一年使用:0次
名校
10 . 铁元素在化学中占据较高的地位,形成的化合物种类繁多,应用广泛,下列说法正确的是
| A.铁遇浓硫酸或浓硝酸发生钝化现象,不属于化学反应 |
| B.FeO与硝酸反应的离子方程式为FeO+2H+=Fe2++H2O |
| C.待测液中先滴加新制氯水,再滴加KSCN试液,若出现红色则待测液中含有Fe3+ |
| D.制备Fe(OH)2沉淀过程中一定要控制其反应体系内不能有氧气,以免沉淀被氧化 |
您最近一年使用:0次



