解题方法
1 . 氯化钡是重要的化工原料,是制备其他钡盐的主要中间原料,以毒重石(主要成分为BaCO3,还含有SiO2及含Ca、Mg、Fe、Al的化合物)为原料制备BaCl2·2H2O的工艺流程如下:
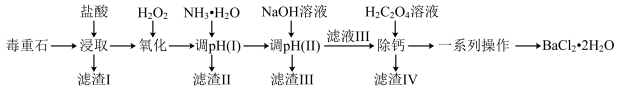
已知:盐酸“浸取”后,Ca、Mg、Fe、Al元素分别以Ca2+、Mg2+、Fe2+、Al3+形式存在于溶液中。
回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有_______ 因素。
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
分析表中数据,温度越高钡的浸出率越低的可能原因是_______ ;判断“浸取”的最佳液固比为_______ 。
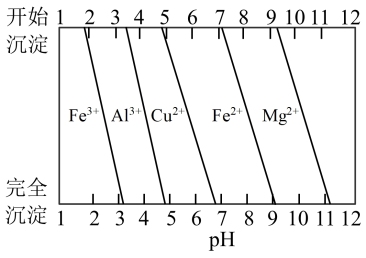
(3)常温时,几种金属离子沉淀的pH如图所示,加H2O2时发生反应的离子方程式为_______ 。“调pH(I)”时,调节溶液pH≈5,则“滤渣II”的主要成分为_______ (填化学式)。
(4)“一系列操作”中洗涤晶体时,通常采用乙醇洗而不采用水洗,原因是_______ 。
(5)“除钙”前,需测定溶液中钙离子的含量,从而确定加入草酸的量,测钙离子含量的操作为取“滤液III”V1mL,加入稍过量的铬酸钾,使钡离子完全沉淀,过滤,将滤液转入250mL容量瓶后再加水定容,取其中25. 00 mL于锥形瓶中,用NaOH溶液将pH调为13,加入黄绿素作指示剂(黄绿素溶液为红色,能与钙离子形成络合物使溶液呈黄绿色) ,用0.100 mol·L-1的标准EDTA溶液滴定(EDTA能与Ca2+以1: 1形成无色络合物)至终点,消耗标准EDTA溶液V2 mL。
①滴定至终点时的现象为_______ 。
②该溶液中钙离子的浓度为_______ (用含 V1、V2的代数式表示)g·mL-1。

已知:盐酸“浸取”后,Ca、Mg、Fe、Al元素分别以Ca2+、Mg2+、Fe2+、Al3+形式存在于溶液中。
回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
| 改变的条件 | 温度(℃) | 盐酸的浓度(%) | 液固比 | ||||||||||
| 30 | 55 | 75 | 10 | 15 | 20 | 25。 | 3:1 | 4:1 | 5:1 | 6:1 | |||
| 钡的浸出率(%) | 74.31 | 69.60 | 68.42 | 59.21 | 74.31 | 74.15 | 55.32 | 59.84 | 65.12 | 74.31 | 74.35 | ||
分析表中数据,温度越高钡的浸出率越低的可能原因是
(3)常温时,几种金属离子沉淀的pH如图所示,加H2O2时发生反应的离子方程式为

(4)“一系列操作”中洗涤晶体时,通常采用乙醇洗而不采用水洗,原因是
(5)“除钙”前,需测定溶液中钙离子的含量,从而确定加入草酸的量,测钙离子含量的操作为取“滤液III”V1mL,加入稍过量的铬酸钾,使钡离子完全沉淀,过滤,将滤液转入250mL容量瓶后再加水定容,取其中25. 00 mL于锥形瓶中,用NaOH溶液将pH调为13,加入黄绿素作指示剂(黄绿素溶液为红色,能与钙离子形成络合物使溶液呈黄绿色) ,用0.100 mol·L-1的标准EDTA溶液滴定(EDTA能与Ca2+以1: 1形成无色络合物)至终点,消耗标准EDTA溶液V2 mL。
①滴定至终点时的现象为
②该溶液中钙离子的浓度为
您最近一年使用:0次
2 . 将少量饱和 溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
甲:饱和 溶液滴加到冷水中;
溶液滴加到冷水中;
乙:饱和 溶液滴加到NaOH溶液中;
溶液滴加到NaOH溶液中;
丙:饱和 溶液滴加到沸水中。
溶液滴加到沸水中。
(1)将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为___________ 。
(2)用最简单的方法判断丙中是否成功制备胶体,请写出相关的操作、现象和结论___________ 。
(3)向经过检验后的丙中逐滴加入稀盐酸,会出现一系列变化,但最终得到和甲相同的溶液,写出该过程发生反应的离子方程式:___________ 。
(4)在氯化铁溶液、氢氧化铁胶体、氢氧化铁悬浊液三种分散系中,分散质粒子直径最小的是___________ ,最大的是___________ ,氢氧化铁胶体分散质粒子直径大小介于___________ 之间。
 溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:甲:饱和
 溶液滴加到冷水中;
溶液滴加到冷水中;乙:饱和
 溶液滴加到NaOH溶液中;
溶液滴加到NaOH溶液中;丙:饱和
 溶液滴加到沸水中。
溶液滴加到沸水中。(1)将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为
(2)用最简单的方法判断丙中是否成功制备胶体,请写出相关的操作、现象和结论
(3)向经过检验后的丙中逐滴加入稀盐酸,会出现一系列变化,但最终得到和甲相同的溶液,写出该过程发生反应的离子方程式:
(4)在氯化铁溶液、氢氧化铁胶体、氢氧化铁悬浊液三种分散系中,分散质粒子直径最小的是
您最近一年使用:0次
名校
解题方法
3 . 下列实验中,对应的实验现象及解释或结论都正确且有因果关系的是
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 常温下,用 计分别测定等体积 计分别测定等体积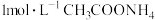 溶液和 溶液和 溶液的 溶液的 | 测得 都等于 都等于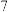 | 同温下,不同浓度的 溶液中水的电离程度相同 溶液中水的电离程度相同 |
| B | 工业上用 与焦炭在高温条件制备粗硅 与焦炭在高温条件制备粗硅 | 生成可燃性气体,得到黑色固体粗硅 | 非金属性: |
| C | 铁的氢氧化物溶于足量的 溶液中,滴加 溶液中,滴加 溶液 溶液 | 固体溶解,溶液未变红色 | 铁的氢氧化物一定是 |
| D | 向两支盛有 溶液的试管中分别滴加淀粉溶液和 溶液的试管中分别滴加淀粉溶液和 溶液 溶液 | 前者溶液变蓝,后者产生黄色沉淀 |  溶液中存在平衡 溶液中存在平衡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 铁泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)是一种常见的工业废料,为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁(FeSO4·7H2O)或柠檬酸铁铵。

(1)过程I
① Fe2O3与硫酸反应的离子方程式为_______ 。
② 分离出杂质的操作是_______ 。
(2)制备柠檬酸铁铵
① 补全过程II中发生反应的离子方程式:_______ 。
_______+1 H+ +1 H2O2 = 1 Fe3++1 _______。
② 过程III中,加入氨水后,可观察到的现象为_______ 。
(3)制备FeSO4·7H2O
过程V中,用离子方程式说明加入铁屑的主要目的是_______ 。

(1)过程I
① Fe2O3与硫酸反应的离子方程式为
② 分离出杂质的操作是
(2)制备柠檬酸铁铵
① 补全过程II中发生反应的离子方程式:
_______+1 H+ +1 H2O2 = 1 Fe3++1 _______。
② 过程III中,加入氨水后,可观察到的现象为
(3)制备FeSO4·7H2O
过程V中,用离子方程式说明加入铁屑的主要目的是
您最近一年使用:0次
5 . 如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。_______ 。
(2)仪器a的名称是_______ 。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃_______ (填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用图中_______ (填“甲”“乙”或“丙”)装置。_______ 。( )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整。

(2)仪器a的名称是
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃

 )
) (4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整。
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
| I.取样,滴加KSCN溶液 | 溶液不变红色 | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ② | Ⅲ.反应后的溶液中阳离子为 |
| Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现 | ③ ④Fe2++2OH- =Fe(OH)2↓ ⑤ |
您最近一年使用:0次
2021-01-13更新
|
256次组卷
|
2卷引用:黑龙江省实验中学2020-2021学年高一上学期期末考试化学试题
6 . 将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系甲、乙、丙。
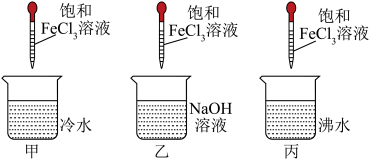
(1)将丙继续加热煮沸至液体呈红褐色,反应的化学方程式为_________ 。
(2)写出实验室制取氢氧化铁胶体的步骤_____________ 。
(3)如何用最简单的方法判断丙中是否成功制备出胶体?_____________ 。
向经过检验后的丙中逐滴加入盐酸,会出现一系列变化:
①先出现和乙中相同的现象,原因是______ 。
②随后发生变化得到和甲相同的溶液,此反应的化学方程式为_________ 。

(1)将丙继续加热煮沸至液体呈红褐色,反应的化学方程式为
(2)写出实验室制取氢氧化铁胶体的步骤
(3)如何用最简单的方法判断丙中是否成功制备出胶体?
向经过检验后的丙中逐滴加入盐酸,会出现一系列变化:
①先出现和乙中相同的现象,原因是
②随后发生变化得到和甲相同的溶液,此反应的化学方程式为
您最近一年使用:0次
名校
解题方法
7 . 某学习小组拟设计实验探究铁盐与碳酸盐反应的产物。
对实验Ⅰ、Ⅱ反应后的混合物进行过滤洗涤、低温凉干,分别得到M、N固体。
回答下列问题:
(1)用pH计分别测定0.5mol·L-1NaHCO3溶液、0.5mol·L-1Na2CO3溶液,得pH依次为a、b。预测a___ b(填“>”“<”或“=”)
(2)为了定性确认M、N成分,进行实验:
写出N和X的化学式:N___ ;X___ 。
(3)为了进一步探究M(无结晶水的纯净物)的组成进行如图实验:
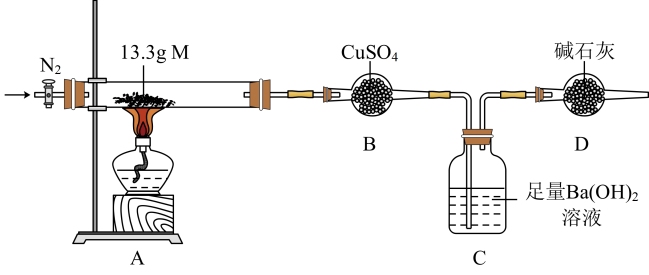
①点燃酒精灯前,先通入N2,其目的是___ 。加热一段时间后,装置A中棕色粉末变红色,装置B中白色粉末变蓝色;装置C中产生白色沉淀。当装置A中M完全反应时停止加热,继续通入N2。
②停止加热之前,__ 先拆去B、C之间导管(填“要”或“不要”)
③对装置C中混合物进行过滤、洗涤、干燥、称重,白色固体质量为19.7g。装置A中残留红色粉末的质量为8.0g,则M的化学式为__ 。
(4)FeCl3溶液和Na2CO3,溶液反应的离子方程式为___ 。
(5)铁盐与碳酸盐溶液反应产物不同可能与__ 、浓度、水解产物CO2有关。
| 序号 | 实验操作 | 主要现象 |
| Ⅰ | 10mL0.5mol•L-1FeCl3溶液和20mL0.5mol•L-1Na2CO3溶液混合 | 产生棕色沉淀,无气泡 |
| Ⅱ | 10mL0.5mol•L-1FeCl3溶液和20mL0.5mol•L-1NaHCO3溶液混合 | 产生红褐色沉淀,产生大量气泡 |
回答下列问题:
(1)用pH计分别测定0.5mol·L-1NaHCO3溶液、0.5mol·L-1Na2CO3溶液,得pH依次为a、b。预测a
(2)为了定性确认M、N成分,进行实验:
| 实验操作 | 实验现象 | 结论 |
| ①取少量M于试管,滴加足量的稀硫酸,再滴加X溶液 | 沉淀溶解,产生大量气泡,溶液变红色 | M一定含Fe3+、CO |
| ②取少量N于试管,滴加足量的稀硫酸,再滴加X溶液 | 沉淀溶解,无气泡产生,溶液变红色 | N是? |
(3)为了进一步探究M(无结晶水的纯净物)的组成进行如图实验:

①点燃酒精灯前,先通入N2,其目的是
②停止加热之前,
③对装置C中混合物进行过滤、洗涤、干燥、称重,白色固体质量为19.7g。装置A中残留红色粉末的质量为8.0g,则M的化学式为
(4)FeCl3溶液和Na2CO3,溶液反应的离子方程式为
(5)铁盐与碳酸盐溶液反应产物不同可能与
您最近一年使用:0次
2021-03-17更新
|
348次组卷
|
2卷引用:四川省成都市第七中学2021届高三下学期3月二诊模拟考试理综化学试题
8 . 在两支试管里分别加入少量的FeCl3和新制FeSO4溶液,然后滴入NaOH溶液,观察并记录现象。
(1)两试管中有什么现象?久置于空气中又有什么现象?___________
(2)在制备Fe(OH)2时,为什么要用新制的FeSO4溶液并将吸有NaOH溶液的胶头滴管尖嘴插入液面以下?___________
(3)在实验中,若想长时间观察到生成的白色Fe(OH)2沉淀,除使用新制FeSO4溶液外,还应创造一个怎样的反应环境?___________
| FeCl3溶液 | 新制FeSO4溶液 | |
| 实验操作 |  | 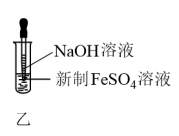 |
(2)在制备Fe(OH)2时,为什么要用新制的FeSO4溶液并将吸有NaOH溶液的胶头滴管尖嘴插入液面以下?
(3)在实验中,若想长时间观察到生成的白色Fe(OH)2沉淀,除使用新制FeSO4溶液外,还应创造一个怎样的反应环境?
您最近一年使用:0次
解题方法
9 . 实验室用废旧铝制易拉罐(含有少量铁)制备净水剂明矾有以下方案:
铝制易拉罐经稀硫酸微热溶解,加入H2O2溶液,调节pH=3.7,第一次过滤后向滤液中加入少量NaHCO3饱和溶液,第二次过滤出白色沉淀。趁热加入质量分数为a% H2SO4溶液和K2SO4固体,然后冷却、洗涤、第三次过滤,得到粗明矾。
完成实验报告:
(1)实验准备:
①为了加快溶解,铝制易拉罐首先要_______ ;
②配制a% H2SO4溶液的仪器:烧杯、玻璃棒、_______ (从图中选择,写出名称)。

(2)溶解、除杂(Fe2+、Fe3+):
①加入H2O2氧化Fe2+时,H2O2实际消耗量常超出氧化还原计算的用量,你预计可能的原因是_______ ;
②思考:在本实验中,含铁杂质在第_______ 次过滤中被去除。
(3)沉铝:
①现象记录:“向滤液中加入少量NaHCO3饱和溶液”处理,溶液中产生_______ 。
②思考:_______ (填“有”或“无”)必要用KHCO3替代NaHCO3。
(4)明矾的制备与结晶(15℃时明矾溶解度为4.9 g/100 g H2O):
①加入a%H2SO4溶液时,a最好是_______ (选填“20%”、“60%”或“98%”)。
②为了提高明矾收率,可采取_______ 、_______ 措施。
(5)实验改进:
为减少试剂用量、方便除杂,设计制备明矾的新方案如下:
易拉罐经_______ 溶液微热溶解,过滤后向滤液中加入_______ 溶液,第二次过滤出白色沉淀。加入H2SO4溶液和K2SO4固体,然后冷却、洗涤、过滤,得到粗明矾。
铝制易拉罐经稀硫酸微热溶解,加入H2O2溶液,调节pH=3.7,第一次过滤后向滤液中加入少量NaHCO3饱和溶液,第二次过滤出白色沉淀。趁热加入质量分数为a% H2SO4溶液和K2SO4固体,然后冷却、洗涤、第三次过滤,得到粗明矾。
完成实验报告:
(1)实验准备:
①为了加快溶解,铝制易拉罐首先要
②配制a% H2SO4溶液的仪器:烧杯、玻璃棒、

(2)溶解、除杂(Fe2+、Fe3+):
①加入H2O2氧化Fe2+时,H2O2实际消耗量常超出氧化还原计算的用量,你预计可能的原因是
②思考:在本实验中,含铁杂质在第
(3)沉铝:
①现象记录:“向滤液中加入少量NaHCO3饱和溶液”处理,溶液中产生
②思考:
(4)明矾的制备与结晶(15℃时明矾溶解度为4.9 g/100 g H2O):
①加入a%H2SO4溶液时,a最好是
②为了提高明矾收率,可采取
(5)实验改进:
为减少试剂用量、方便除杂,设计制备明矾的新方案如下:
易拉罐经
您最近一年使用:0次
名校
解题方法
10 . 铁是人类较早使用的金属之一、运用所学知识,回答下列问题。
(1)Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程为:___________ ;观察到的现象为:___________ ;为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(2)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入___________ 。
(3)除去蒸馏水中溶解的O2常采用___________ 的方法。
(4)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是___________ 。
(1)Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程为:
(2)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入
(3)除去蒸馏水中溶解的O2常采用
(4)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
您最近一年使用:0次



