名校
解题方法
1 . 某研究小组欲探究 能否与
能否与 溶液反应。
溶液反应。
【查阅资料】
i. 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。
ii. 遇
遇 可生成
可生成 ,
, 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。
【提出猜想】
(1)小组同学经过讨论后,认为 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:___________ 。
【设计实验】
(2)实验I:在试管中加入 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液_____ ,小组同学认为 和
和 溶液反应生成了
溶液反应生成了 。
。
(3)甲同学注意到盛放 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是______ 。
重新设计实验:
实验II:在试管中加入 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。
【获得结论】
(4)过氧化氢___________ (填“能”或者“不能”)氧化 。
。
【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。
(5)补全实验III的方案:在试管中加入 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入___________ ,产生___________ 。
【总结反思】
(6)小组同学经过讨论后,提出了 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中,___________ ,证明待测液含有 。
。
(7)从上述实验中可以得出结论,在物质性质的检验中,应注意___________ (至少写出两条)对实验结果的影响。
 能否与
能否与 溶液反应。
溶液反应。【查阅资料】
i.
 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。ii.
 遇
遇 可生成
可生成 ,
, 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。【提出猜想】
(1)小组同学经过讨论后,认为
 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:【设计实验】
(2)实验I:在试管中加入
 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液 和
和 溶液反应生成了
溶液反应生成了 。
。(3)甲同学注意到盛放
 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是重新设计实验:
实验II:在试管中加入
 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。【获得结论】
(4)过氧化氢
 。
。【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将
 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。(5)补全实验III的方案:在试管中加入
 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入【总结反思】
(6)小组同学经过讨论后,提出了
 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中, 。
。(7)从上述实验中可以得出结论,在物质性质的检验中,应注意
您最近一年使用:0次
2021-11-07更新
|
1003次组卷
|
4卷引用:北京市一零一中2021-2022学年高一上学期期中考试化学试题
21-22高一·全国·假期作业
解题方法
2 . 某催化剂为铁的氧化物,一化学兴趣小组在实验室里对该催化剂中铁元素的价态进行探究:查阅有关资料得知Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色;HNO3具有强氧化性。请完成对铁元素价态的探究:
(1)①提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2:催化剂中铁元素为+2价;
假设3:_______ 。
②设计实验方案。
③根据②的实验方案进行实验:
(2)步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是_______ ;步骤2:取少量样品于试管中,加入处理过的硫酸并加热,得到A溶液;
(3)步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设_______ 成立;若出现血红色,则假设_______ 成立;
(4)步骤4:另取A溶液于试管,加入KMnO4溶液,振荡,结合步骤3中的结论,若出现_______ 现象,则假设1成立;反之,则假设3成立。
(1)①提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2:催化剂中铁元素为+2价;
假设3:
②设计实验方案。
③根据②的实验方案进行实验:
(2)步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是
(3)步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设
(4)步骤4:另取A溶液于试管,加入KMnO4溶液,振荡,结合步骤3中的结论,若出现
您最近一年使用:0次
解题方法
3 . 铁是人体必需的微量元素之一,补铁剂中的Fe2+在空气中很容易被氧化为Fe3+,影响铁元素在人体中的吸收利用。某实验小组进行如图所示的对照实验,验证补铁剂和维生素C一起服用的科学性。
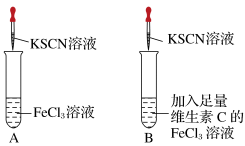
[实验操作]第一步:在A、B两支试管中加入对比试剂;第二步:振荡;第三步:滴加KSCN溶液。
[实验现象]
(1)A试管中溶液变___________ 色,B试管中无明显现象。
[实验结论]
(2)维生素C具有___________ (填“氧化性”或“还原性”),能防止Fe2+被氧化为Fe3+,所以补铁剂和维生素C一起服用具有科学依据。
[生活应用]
(3)某品牌泡腾片的主要成分为维生素C和NaHCO3,放入水中立即产生大量气泡(CO2)使口感更好,说明维生素C具有___________ (填“酸性”或“碱性”)。
(4)为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意___________ (写一条即可)。

[实验操作]第一步:在A、B两支试管中加入对比试剂;第二步:振荡;第三步:滴加KSCN溶液。
[实验现象]
(1)A试管中溶液变
[实验结论]
(2)维生素C具有
[生活应用]
(3)某品牌泡腾片的主要成分为维生素C和NaHCO3,放入水中立即产生大量气泡(CO2)使口感更好,说明维生素C具有
(4)为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意
您最近一年使用:0次
名校
4 . 高铁酸钾(K2FeO4)是一新型高效无毒的多功能水处理剂。资料:K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4
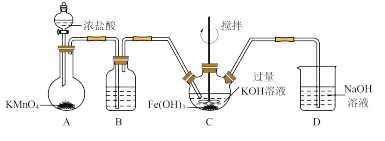
①写出A中发生反应的化学方程式______ 。
②除杂装置B中的试剂为____ 。
③C为制备K2FeO4装置,KOH溶液过量的原因是____ 。
④D为尾气处理装置,发生反应的离子方程式为____ 。
(2)探究K2FeO4的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl−而产生Cl2设计以下方案:
①由方案Ⅰ中溶液变红可知a中含有____ 。该离子的产生__ (填“能”或“不能”)判断一定是由K2FeO4被Cl−还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是____ ,方案Ⅱ得出氧化性:Cl2___ FeO42−(填“ ”或“
”或“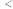 ”)。
”)。
(1)制备K2FeO4

①写出A中发生反应的化学方程式
②除杂装置B中的试剂为
③C为制备K2FeO4装置,KOH溶液过量的原因是
④D为尾气处理装置,发生反应的离子方程式为
(2)探究K2FeO4的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl−而产生Cl2设计以下方案:
| 方案Ⅰ | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生 |
①由方案Ⅰ中溶液变红可知a中含有
②方案Ⅱ用KOH溶液洗涤的目的是
 ”或“
”或“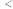 ”)。
”)。
您最近一年使用:0次
2020-06-08更新
|
182次组卷
|
2卷引用:高中化学苏教2019版必修第二册-全书综合测评
5 . 某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
(1)已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。________________ ;该反应中氧化剂是_____ ;若有0.75mol电子转移,则被还原的氧化剂粒子数为_______ 。(用NA表示)
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是______ (填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性: 维生素C > Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________ 。
| 药品 | NaNO2 (亚硝酸钠) |
| 性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是
A.NaNO2被还原 B.维生素C具有还原性
C.还原性: 维生素C > Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:
您最近一年使用:0次
2018-01-31更新
|
534次组卷
|
6卷引用:四川省成都市2017-2018学年高一上期期末调研考试化学试题
名校
6 . 铁元素的“价—类”二维图如图所示:
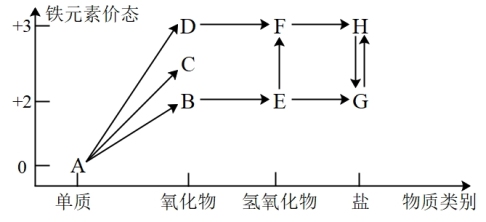
(1)C的化学式是_______ , 反应的化学方程式是
反应的化学方程式是_______ ,反应过程的现象为_______ 。
(2)维生素C可将H转化为G,维生素C具有_______ (填“酸性”、“氧化性”或“还原性”)。
(3)在指定条件下,下列铁及其化合物之间的转化不能实现的是_______ 。
A. B.
B.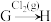 C.
C.
(4)某小组同学设计如下实验,研究亚铁盐与 溶液的反应。
溶液的反应。
试剂:酸化的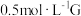 溶液,
溶液, 溶液
溶液
①上述实验中 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是_______ 。
②产生气泡的原因是_______ 。

(1)C的化学式是
 反应的化学方程式是
反应的化学方程式是(2)维生素C可将H转化为G,维生素C具有
(3)在指定条件下,下列铁及其化合物之间的转化不能实现的是
A.
 B.
B.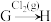 C.
C.
(4)某小组同学设计如下实验,研究亚铁盐与
 溶液的反应。
溶液的反应。试剂:酸化的
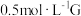 溶液,
溶液, 溶液
溶液| 操作 | 现象 |
取 酸化的G溶液于试管中,加入5滴 酸化的G溶液于试管中,加入5滴 溶液 溶液 | 溶液立即变为棕黄色,稍后,产生气泡。 |
向反应后的溶液中加入 溶液 溶液 | 溶液变红 |
 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是②产生气泡的原因是
您最近一年使用:0次
2022-01-23更新
|
804次组卷
|
8卷引用:3.1.2 铁盐和亚铁盐-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)
解题方法
7 . 某兴趣小组同学为探究黑木耳中含铁量,进行如下实验。
已知:ⅰ黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等。每100克黑木耳含铁量高达185mg。
ⅱFe2+与铁氰化钾(K3[Fe(CN)6])溶液反应生成蓝色沉淀。
ⅲ紫色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。
Ⅰ为确定黑木耳中含有铁元素,甲同学设计实验方案如图。
(1)得到滤液A的操作是___ 。
(2)步骤④检验Fe3+所用试剂是___ 溶液。
(3)下列有关上述实验得到的结论是___ (填字母序号)。
a.黑木耳中一定含二价铁和三价铁
b.滤液A中一定含Fe2+和Fe3+
c.黑木耳中一定含二价铁,不一定含有三价铁
Ⅱ为测定黑木耳中铁元素的含量,乙同学设计实验方案如图。

(4)可选为试剂B的物质是___ (填字母序号)。
a.Na b.Zn c.Fe d.Cu
(5)步骤⑥中观察到的实验现象是___ ,反应的离子方程式是___ 。
(6)若乙同学实验操作规范,但测得的含铁量远大于实际的含量,其可能的原因是___ 。
已知:ⅰ黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等。每100克黑木耳含铁量高达185mg。
ⅱFe2+与铁氰化钾(K3[Fe(CN)6])溶液反应生成蓝色沉淀。
ⅲ紫色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。
Ⅰ为确定黑木耳中含有铁元素,甲同学设计实验方案如图。

(1)得到滤液A的操作是
(2)步骤④检验Fe3+所用试剂是
(3)下列有关上述实验得到的结论是
a.黑木耳中一定含二价铁和三价铁
b.滤液A中一定含Fe2+和Fe3+
c.黑木耳中一定含二价铁,不一定含有三价铁
Ⅱ为测定黑木耳中铁元素的含量,乙同学设计实验方案如图。

(4)可选为试剂B的物质是
a.Na b.Zn c.Fe d.Cu
(5)步骤⑥中观察到的实验现象是
(6)若乙同学实验操作规范,但测得的含铁量远大于实际的含量,其可能的原因是
您最近一年使用:0次
8 . 为探究 的性质,某学习小组进行了如下探究。
的性质,某学习小组进行了如下探究。
(1)向制得的 溶液中加入铁粉,其目的是
溶液中加入铁粉,其目的是_______ 。
(2)预测 既有氧化性又有还原性。你认为预测的依据是
既有氧化性又有还原性。你认为预测的依据是_______ 。
(3)进行实验探究。实验室提供了下列试剂: 溶液、
溶液、 溶液、新制氯水、KSCN溶液、锌片、铜片。
溶液、新制氯水、KSCN溶液、锌片、铜片。
①向 溶液中滴入新制氯水,探究的是
溶液中滴入新制氯水,探究的是 的
的_______ 性(填“氧化”或“还原”),所发生反应的离子方程式为_______ 。
②在实验中,甲同学发现现象不太明显,老师分析可能是反应产物的含量太低,建议通过检验 反应产物的存在以获取证据。可选
反应产物的存在以获取证据。可选_______ 滴入甲同学所得的混合溶液中,并通过溶液出现_______ 的现象证明 具有还原性,能被氯水氧化。
具有还原性,能被氯水氧化。
③设计实验证明 具有氧化性:
具有氧化性:_______ 。
 的性质,某学习小组进行了如下探究。
的性质,某学习小组进行了如下探究。(1)向制得的
 溶液中加入铁粉,其目的是
溶液中加入铁粉,其目的是(2)预测
 既有氧化性又有还原性。你认为预测的依据是
既有氧化性又有还原性。你认为预测的依据是(3)进行实验探究。实验室提供了下列试剂:
 溶液、
溶液、 溶液、新制氯水、KSCN溶液、锌片、铜片。
溶液、新制氯水、KSCN溶液、锌片、铜片。①向
 溶液中滴入新制氯水,探究的是
溶液中滴入新制氯水,探究的是 的
的②在实验中,甲同学发现现象不太明显,老师分析可能是反应产物的含量太低,建议通过检验
 反应产物的存在以获取证据。可选
反应产物的存在以获取证据。可选 具有还原性,能被氯水氧化。
具有还原性,能被氯水氧化。③设计实验证明
 具有氧化性:
具有氧化性:
您最近一年使用:0次
2022-11-25更新
|
221次组卷
|
2卷引用:2019版鲁科化学必修第一册第3章第1节 铁的多样性课后习题
10-11高三上·福建莆田·期中
解题方法
9 . 某校化学实验兴趣小组在“探究溴水与氯化亚铁溶液反应”的实验中发现:在足量的稀氯化亚铁溶液中,加入1—2滴溴水,振荡后溶液呈黄色。查阅资料显示:溴水是溴(Br2)的水溶液,呈黄色;溴水中含有溴单质。
(1)提出问题:Fe3+、Br2,谁的氧化性更强。
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含_______ (填化学式,下同)所致
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_______ 所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
除氯化亚铁溶液和溴水外,还有供选用的试剂:
a、酚酞试液;b、CCl4;c、无水酒精;d、KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
(4)结论:氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1—2滴溴水,溶液呈黄色所发生的离子反应方程式为_______
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是_______ (填离子的化学式)。
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_______ 。
(1)提出问题:Fe3+、Br2,谁的氧化性更强。
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
除氯化亚铁溶液和溴水外,还有供选用的试剂:
a、酚酞试液;b、CCl4;c、无水酒精;d、KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为
您最近一年使用:0次
2019-01-30更新
|
445次组卷
|
7卷引用:上海市长宁区2022-2023学年高一上学期学业综合评价化学试题
上海市长宁区2022-2023学年高一上学期学业综合评价化学试题(已下线)专题九 铁及其化合物(已下线)2015届河南郑州市第四十七中学高三上第一次(10月)月考化学试卷2016届河南省周口中英文学校高三上学期期中测试化学试卷(已下线)2011届福建省莆田一中高三上学期期中考试化学试卷(已下线)2012届福建省莆田一中高三第一学段考试化学试卷(已下线)2014届浙江省衢州第二中学高三上学期期中考试化学试卷
名校
解题方法
10 . 某兴趣小组利用下列试剂:铁粉、锌粉、0.1mol/LFeCl2溶液、KSCN溶液、双氧水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(1)用所给试剂写出体现Fe2+具有还原性的反应的离子反应方程式:___________ 。
(2)设计实验方案,完成下列表格。
(3)该兴趣小组未说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为___________ 。
(4)电子工业中用过量的FeCl3溶液溶解电路板,产生的废液中含FeCl3、CuCl2和FeCl2.由该废液回收铜并得到净水剂(FeCl3·6H2O)的步骤如下:
Ⅰ. 废液中加入过量铁粉,过滤;
Ⅱ. 向Ⅰ的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
Ⅲ. 合并Ⅰ和Ⅱ中的滤液,通入足量氯气;
Ⅳ ……,得到FeCl3·6H2O晶体。
①试剂A是___________ ;
②取少量步骤Ⅲ所得的溶液于试管中,能够证明通入氯气足量的是___________ ;
a.检验Cl2的存在 b.检验Fe3+的存在 c.检验Fe2+的不存在
(1)用所给试剂写出体现Fe2+具有还原性的反应的离子反应方程式:
(2)设计实验方案,完成下列表格。
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe3+的化学性质 | 取少量0.1mol/LFeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液变成 |
| 结论:Fe3+具有 | ||
(4)电子工业中用过量的FeCl3溶液溶解电路板,产生的废液中含FeCl3、CuCl2和FeCl2.由该废液回收铜并得到净水剂(FeCl3·6H2O)的步骤如下:
Ⅰ. 废液中加入过量铁粉,过滤;
Ⅱ. 向Ⅰ的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
Ⅲ. 合并Ⅰ和Ⅱ中的滤液,通入足量氯气;
Ⅳ ……,得到FeCl3·6H2O晶体。
①试剂A是
②取少量步骤Ⅲ所得的溶液于试管中,能够证明通入氯气足量的是
a.检验Cl2的存在 b.检验Fe3+的存在 c.检验Fe2+的不存在
您最近一年使用:0次
2021-12-13更新
|
178次组卷
|
2卷引用:天津市静海区第一中学2021-2022学年高一上学期12月调研考试化学试题



