1 . 某次银镜反应实验完成后,甲同学在清洗试管时,发现向做过银镜反应的试管内滴加0.1
 溶液,银镜会消失。
溶液,银镜会消失。
Ⅰ.甲同学推测 溶液中的
溶液中的 具有氧化性,能够溶解单质Ag,设计如下实验方案,证明其结论:
具有氧化性,能够溶解单质Ag,设计如下实验方案,证明其结论:
取一支沾有少量Ag的试管,加入5mL 0.05
 溶液(过量),充分振荡,发现银镜消失较慢,溶液黄色明显变浅,产生较多白色沉淀。
溶液(过量),充分振荡,发现银镜消失较慢,溶液黄色明显变浅,产生较多白色沉淀。
(1)选用0.05
 溶液的目的是
溶液的目的是___________ 。
(2)实验完成后向试管中加入___________ (填序号,①KSCN溶液、② 溶液、③稀HCl),若出现
溶液、③稀HCl),若出现___________ ,则证明甲同学推测正确。
(3)该实验方案中涉及化学反应的离子方程式为___________ 。
Ⅱ.乙同学在甲同学实验方案基础上又设计了如下列实验方案:
(4)乙同学的实验目的为___________ ,根据实验目的可以判断出步骤c中的试剂A可为pH=___________ ,浓度为0.3 的
的___________ (填离子符号)溶液。
Ⅲ.丙同学查阅资料发现, 、
、 的氧化性差异不大,推测在一定条件下Ag与
的氧化性差异不大,推测在一定条件下Ag与 反应可能是可逆反应,改用如下图所示装置进行探究,连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
反应可能是可逆反应,改用如下图所示装置进行探究,连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
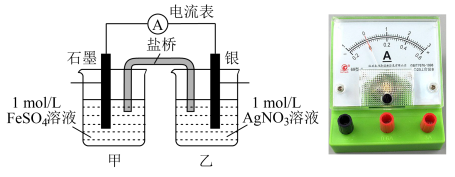
(5)根据步骤C中电流表读数x确定Ag与 反应是可逆反应,则读数x可能为
反应是可逆反应,则读数x可能为___________ ,请具体说明如何通过电流表的读数x判断该反应为可逆反应:___________ 。
(6) 和
和 反应的离子方程式为
反应的离子方程式为___________ 。

 溶液,银镜会消失。
溶液,银镜会消失。Ⅰ.甲同学推测
 溶液中的
溶液中的 具有氧化性,能够溶解单质Ag,设计如下实验方案,证明其结论:
具有氧化性,能够溶解单质Ag,设计如下实验方案,证明其结论:取一支沾有少量Ag的试管,加入5mL 0.05

 溶液(过量),充分振荡,发现银镜消失较慢,溶液黄色明显变浅,产生较多白色沉淀。
溶液(过量),充分振荡,发现银镜消失较慢,溶液黄色明显变浅,产生较多白色沉淀。(1)选用0.05

 溶液的目的是
溶液的目的是(2)实验完成后向试管中加入
 溶液、③稀HCl),若出现
溶液、③稀HCl),若出现(3)该实验方案中涉及化学反应的离子方程式为
Ⅱ.乙同学在甲同学实验方案基础上又设计了如下列实验方案:
| 序号 | 实验步骤 | 实验现象 |
| a | 用pH试纸测定0.1mol/L  的pH 的pH | pH=2 |
| b | 取一支沾有少量Ag的试管,加入5mL 0.1mol/L  溶液(过量),充分振荡。 溶液(过量),充分振荡。 | 银镜消失较快;溶液黄色略变浅; |
| c | 取一支沾有少量Ag的试管,加入试剂A,充分振荡。 | 银镜消失较快。 |
 的
的Ⅲ.丙同学查阅资料发现,
 、
、 的氧化性差异不大,推测在一定条件下Ag与
的氧化性差异不大,推测在一定条件下Ag与 反应可能是可逆反应,改用如下图所示装置进行探究,连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
反应可能是可逆反应,改用如下图所示装置进行探究,连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
| 序号 | 实验步骤 | 电流表读数(A) |
| A | 按上图连接装置并加入药品,电流表指针偏转,发现银电极质量有增加,读出电流表读数a | a(a>0) |
| B | 充分反应一段时间后,读出电流表读数b | b(0<b<a) |
| C | 再继续向烧杯甲中缓缓加入浓 溶液,读出电流表读数x 溶液,读出电流表读数x | x |
 反应是可逆反应,则读数x可能为
反应是可逆反应,则读数x可能为(6)
 和
和 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
2022-03-01更新
|
1593次组卷
|
5卷引用:专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)
(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)(已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)北京市通州区2022届高三查缺补漏化学试题(已下线)专题28 性质探究类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)广东省汕头市2022届高三下学期第一次模拟考试化学试题
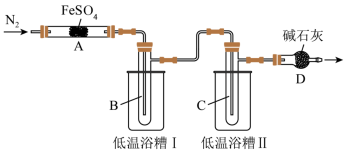
2 . 某学习小组拟研究FeSO4的分解实验探究,请你利用所学知识帮该小组完成以下实验方案。
[实验目的]探究FeSO4分解产物与温度关系。
[提出假设]
假设1:Fe2O3、SO3、SO2 ;
假设2:FeO、SO3、SO2;
假设3:Fe3O4、SO3、SO2。
[查阅资料]几种物质的物理性质如表所示。
回答下列问题:
(1)根据所学知识判断,假设2肯定不成立,理由是_______ 。
(2)实验过程中,在检查装置气密性之后点燃A处酒精灯之前的操作是_______ ,(只填操作),当A处固体完全分解后通入N2的目的是_______ 。
(3)实验室用饱和氯化铵溶液和亚硝酸钠溶液共热制备N2,该反应的离子方程式为_______ 。
(4)低温浴槽Ⅰ收集的物质是_______ (填化学式),低温浴槽Ⅱ控制的温度范围为_______ 。
(5)甲、乙组分别进行实验,实验数据如下(不考虑损失,固体已完全分解且固体产物为纯净物):
甲组实验中A装置得到固体产物是_______ (填化学式)。
(6)为进一步确认固体产物成分,取乙组实验得到的固体溶于稀硫酸,将溶液分成两份,进行如下实验:在一份溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,产生蓝色沉淀。在另一份溶液中滴加NH4SCN溶液,观察到的现象是_______ 。
[实验结论]通过上述实验,FeSO4分解产物与温度有关。
[交流反思]FeSO4分解反应中是否有O2生成?
(7)为验证实验猜想,他们设计两种方案检验O2:
方案1:将D管导出的气体通入酸化的淀粉-KI溶液中。
方案2:用带火星的木条放在D管口处。
假设过程中持续缓缓通入N2,对比以上两种方案,其中方案_______ (填“1”或“2”)可行。
[实验目的]探究FeSO4分解产物与温度关系。
[提出假设]
假设1:Fe2O3、SO3、SO2 ;
假设2:FeO、SO3、SO2;
假设3:Fe3O4、SO3、SO2。
[查阅资料]几种物质的物理性质如表所示。
| 物质 | SO3 | SO2 | O2 | N2 |
| 熔点/℃ | 16.8 | - 72.4 | -218.4 | -209.9 |
| 沸点/℃ | 44.8 | - 10 | -182.9 | - 195.8 |

回答下列问题:
(1)根据所学知识判断,假设2肯定不成立,理由是
(2)实验过程中,在检查装置气密性之后点燃A处酒精灯之前的操作是
(3)实验室用饱和氯化铵溶液和亚硝酸钠溶液共热制备N2,该反应的离子方程式为
(4)低温浴槽Ⅰ收集的物质是
(5)甲、乙组分别进行实验,实验数据如下(不考虑损失,固体已完全分解且固体产物为纯净物):
| 实验 | A处温度/℃ | FeSO4质量/g | 低温浴槽Ⅰ净增质量/g | 低温浴槽Ⅱ净增质量/g |
| 甲 | T1 | 3.04 | 0.80 | 0.64 |
| 乙 | T2 | 4.56 | 1.60 | 0.64 |
(6)为进一步确认固体产物成分,取乙组实验得到的固体溶于稀硫酸,将溶液分成两份,进行如下实验:在一份溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,产生蓝色沉淀。在另一份溶液中滴加NH4SCN溶液,观察到的现象是
[实验结论]通过上述实验,FeSO4分解产物与温度有关。
[交流反思]FeSO4分解反应中是否有O2生成?
(7)为验证实验猜想,他们设计两种方案检验O2:
方案1:将D管导出的气体通入酸化的淀粉-KI溶液中。
方案2:用带火星的木条放在D管口处。
假设过程中持续缓缓通入N2,对比以上两种方案,其中方案
您最近一年使用:0次
真题
3 . 下列设计的实验方案能达到实验目的的是( )
| A.制备Al(OH)3悬浊液:向1mol·L-1AlCl3溶液中加过量的6mol·L-1NaOH溶液 |
| B.提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 |
| C.检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 |
| D.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
您最近一年使用:0次
2019-01-30更新
|
1223次组卷
|
3卷引用:小题必刷27 化学反应速率、图像及其影响因素——2021年高考化学一轮复习小题必刷(通用版本)
(已下线)小题必刷27 化学反应速率、图像及其影响因素——2021年高考化学一轮复习小题必刷(通用版本)2015年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)江苏省南通市启东市吕四中学2020届高三第一次质量检测化学试题
名校
4 . 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂,是一种复盐,与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,利用这一性质可以用等物质的量的(NH4)2SO4和FeSO4混合制备。请回答以下问题:
I.硫酸亚铁铵晶体的制备
步骤一:称取一定质量铁屑,加入15mL10%Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体mg。
步骤二:将步骤一中的mg固体转移至锥形瓶,加入一定体积3mol·L-1H2SO4充分溶解,将溶液转移入蒸发皿
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入步骤二蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)步骤一中加入10%Na2CO3溶液,小火加热30分钟的目的是_____
(2)关于步骤五中的一系列操作的相关表述,错误的是_____(填字母)。
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。_____
(4)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中含有_____ 气体,写出D中发生反应的离子方程式_____ ;若去掉C,是否能得出同样结论,并解释其原因_____ 。
(5)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。其预期实验现象为:_____ 。
I.硫酸亚铁铵晶体的制备
步骤一:称取一定质量铁屑,加入15mL10%Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体mg。
步骤二:将步骤一中的mg固体转移至锥形瓶,加入一定体积3mol·L-1H2SO4充分溶解,将溶液转移入蒸发皿
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入步骤二蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)步骤一中加入10%Na2CO3溶液,小火加热30分钟的目的是
(2)关于步骤五中的一系列操作的相关表述,错误的是_____(填字母)。
| A.过滤时可使用玻璃棒搅拌的方式来缩短时间 |
| B.过滤和洗涤的速度都要尽可能的快,可以减少产品的氧化 |
| C.洗涤时使用无水乙醇既可以洗去晶体表面的杂质离子,又可以起到干燥作用 |
| D.所得的产品可以采取电热炉烘干的方式彻底干燥 |
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(4)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中含有
(5)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。其预期实验现象为:
| 实验步骤 | 预期现象 | 结论 |
| ①取少量A中残留物于试管中,加入适量稀硫酸,充分振荡便其完全溶解; ②将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶 液 | _____ | 固体残留物仅为Fe2O3 |
您最近一年使用:0次
2023高三·全国·专题练习
5 . 下列关于Fe3+、Fe2+性质实验的说法错误的是
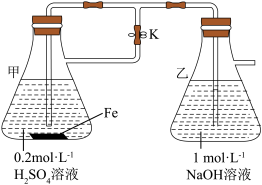

| A.用如图装置可以制备Fe(OH)2 |
| B.除去FeCl2溶液中的FeCl3杂质,可以向溶液中加入过量铁粉,然后过滤 |
| C.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象不能确定溶液中含有Fe2+ |
| D.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
您最近一年使用:0次
6 . 无水FeCl2为黄绿色晶体,在空气中易被氧化、易吸水,不溶于氯仿等有机溶剂。回答下列问题:
I.FeCl2的制备:
制备反应原理为2FeCl3+C6H5Cl 2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。
2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。
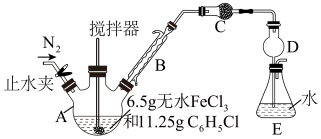
(1)仪器A的名称是___________ 。
(2)装置C中的试剂是______________________ (填化学式)。
II. 性质探究:将
性质探究:将 晶体配成溶液后进行如下实验。
晶体配成溶液后进行如下实验。
已知: 与
与 可在溶液中大量共存;
可在溶液中大量共存; 易被氧化为
易被氧化为 。
。
(3)对实验ⅰ中溶液变为浅红色的原因,甲同学提出以下假设。
假设1:加入饱和氯水的量少,生成的 的浓度小;
的浓度小;
假设2:氯水氧化性强,___________ 。
取实验i中浅红色溶液,___________ (填实验操作),溶液浅红色消失,从而排除假设1;向 水中滴加
水中滴加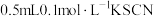 溶液,滴加
溶液,滴加 饱和氯水,加入
饱和氯水,加入___________ ,产生白色沉淀,说明假设2正确。
(4)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是______________________ (用离子方程式表示,已知 中C元素为
中C元素为 价)。
价)。
I.FeCl2的制备:
制备反应原理为2FeCl3+C6H5Cl
 2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。
2FeCl2+C6H4Cl2+HCl↑(C6H5Cl为氯苯,沸点132℃),制备装置如图所示(夹持及加热装置略去),收集的HCl气体可用于测定FeCl2的产率。
(1)仪器A的名称是
(2)装置C中的试剂是
II.
 性质探究:将
性质探究:将 晶体配成溶液后进行如下实验。
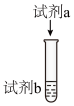
晶体配成溶液后进行如下实验。序号 | 装置 | 试剂b | 试剂a | 实验现象 |
实验i |
| 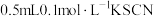 溶液、 溶液、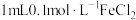 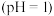 溶液 溶液 |
| 溶液立即变为浅红色 |
实验ii |
| 溶液变为红色,一段时间后,溶液褪为无色,且溶液中产生无色气泡,试管上方呈红棕色 |
 与
与 可在溶液中大量共存;
可在溶液中大量共存; 易被氧化为
易被氧化为 。
。(3)对实验ⅰ中溶液变为浅红色的原因,甲同学提出以下假设。
假设1:加入饱和氯水的量少,生成的
 的浓度小;
的浓度小;假设2:氯水氧化性强,
取实验i中浅红色溶液,
 水中滴加
水中滴加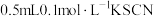 溶液,滴加
溶液,滴加 饱和氯水,加入
饱和氯水,加入(4)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是
 中C元素为
中C元素为 价)。
价)。
您最近一年使用:0次
名校
7 . 下列关于Fe3+和Fe2+说法错误的是
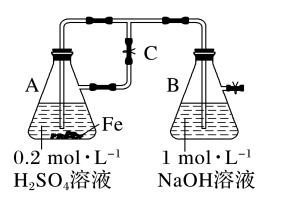

| A.用如图装置可以制备Fe(OH)2沉淀 |
| B.用酸性高锰酸钾溶液检验FeCl3溶液中是否含有FeCl2 |
| C.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
| D.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象可以证明原溶液中含有Fe2+ |
您最近一年使用:0次
8 . 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂,是一种复盐,一般亚铁盐在空气中易被氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,利用这一性质可以用等物质的量的(NH4)2SO4和FeSO4混合制备。请回答以下问题:
I.硫酸亚铁铵晶体的制备
步骤一:称取3.0g铁屑,加入15mLl0%Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1g。
步骤二:将步骤一中的m1g固体转移至锥形瓶,加入15mL3mol·L-1H2SO4,加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)碱煮30分钟的目的是____ 。
(2)步骤二中的加热,最佳加热方式为____ ,理由是____ 。
(3)关于步骤五中的一系列操作的相关表述,错误的是____ (填字母)。
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(4)B装置的作用是____ 。
(5)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中的某种气体,写出D中发生反应的离子方程式____ 。若去掉C,是否能得出同样结论,并解释其原因____ 。
(6)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。请填写表中的实验现象。
I.硫酸亚铁铵晶体的制备
步骤一:称取3.0g铁屑,加入15mLl0%Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1g。
步骤二:将步骤一中的m1g固体转移至锥形瓶,加入15mL3mol·L-1H2SO4,加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)碱煮30分钟的目的是
(2)步骤二中的加热,最佳加热方式为
(3)关于步骤五中的一系列操作的相关表述,错误的是
| A.过滤时可使用玻璃棒搅拌的方式来缩短时间 |
| B.过滤和洗涤的速度都要尽可能的快,可以减少产品的氧化 |
| C.洗涤时使用无水乙醇既可以洗去晶体表面的杂质离子,又可以起到干燥作用 |
| D.所得的产品可以采取电热炉烘干的方式彻底干燥 |
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(4)B装置的作用是
(5)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中的某种气体,写出D中发生反应的离子方程式
(6)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。请填写表中的实验现象。
| 实验步骤 | 预期现象 | 结论 |
| ①取少量A中残留物于试管中,加入适量稀硫酸,充分振荡便其完全溶解;②将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液 | 固体残留物仅为Fe2O3 |
您最近一年使用:0次
9 .  可用作净水剂、还原剂等。回答下列问题:
可用作净水剂、还原剂等。回答下列问题:
Ⅰ.制备 。装置如图所示(夹持装置省略)。已知
。装置如图所示(夹持装置省略)。已知 极易水解。
极易水解。
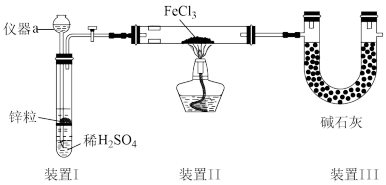
(1)仪器a的名称是___________ 。
(2)装置Ⅱ中制备 的化学方程式为
的化学方程式为___________ ,装置Ⅲ的作用:①吸收尾气;②___________ 。
(3)该装置存在的缺陷是___________ 。
Ⅱ.利用惰性电极电解 溶液,探究外界条件对电极反应产物的影响。
溶液,探究外界条件对电极反应产物的影响。
(4)实验数据如下表所示:
①实验2、3中阳极产生的气体是___________ (填化学式)。
②实验中,调节 溶液的
溶液的 宜选用
宜选用___________ (填“盐酸”、“硝酸”或“硫酸”)。
③由实验1、2现象可以得出结论___________ ;由实验1、4现象可以得出结论___________ 。
 可用作净水剂、还原剂等。回答下列问题:
可用作净水剂、还原剂等。回答下列问题:Ⅰ.制备
 。装置如图所示(夹持装置省略)。已知
。装置如图所示(夹持装置省略)。已知 极易水解。
极易水解。
(1)仪器a的名称是
(2)装置Ⅱ中制备
 的化学方程式为
的化学方程式为(3)该装置存在的缺陷是
Ⅱ.利用惰性电极电解
 溶液,探究外界条件对电极反应产物的影响。
溶液,探究外界条件对电极反应产物的影响。(4)实验数据如下表所示:
| 实验编号 | 电压 |  | 阳极现象 | 阴极现象 |
| 1 | 1.5 | 5.52 | 无气泡,滴加 显红色 显红色 | 无气泡,银白色金属析出 |
| 2 | 3.0 | 5.52 | 少量气泡,滴加 显红色 显红色 | 无气泡,银白色金属析出 |
| 3 | 4.5 | 5.52 | 大量气泡,滴加 显红色 显红色 | 较多气泡,极少量金属析出 |
| 4 | 1.5 |  | 无气泡,滴加 显红色 显红色 | 较多气泡,极少量金属析出 |
②实验中,调节
 溶液的
溶液的 宜选用
宜选用③由实验1、2现象可以得出结论
您最近一年使用:0次
名校
10 . 某兴趣小组通过实验制备Fe(NO3)3并进行性质探究。
(1)HNO3的制备:利用下图装置,模拟氨的催化氧化法制备硝酸。其中,甲为氨气的发生装置,且甲中所用试剂只能从下列物质选取:A. 浓氨水 B. NH4Cl C. NH4NO3 D. CaO
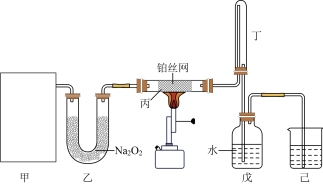
①若选择试剂A和D,则甲中发生反应的化学方程式为_______ 。
②若只用一种试剂制取氨气,则该试剂的最佳选择为_______ (选填试剂标号),此时,甲中空白处所需装置应为_______ (选填下列标号)。
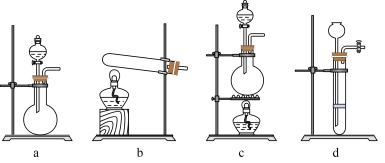
③实验结束后从戊中取出少量液体于试管中,滴入紫色石蕊试液,当观察到_______ 现象时,说明已制得硝酸。若没有观察到此现象,可能的原因是_______ 。
(2)Fe(NO3)3溶液的制备:利用硝酸与下列物质反应制备Fe(NO3)3溶液时,最佳选择为_______ (填标号)。
A. Fe B. FeO C. Fe2O3 D. Fe3O4 E. Fe(OH)2
(3)Fe(NO3)3溶液性质的探究:取适量0.1mol·L-1 Fe(NO3)3溶液,加入到新制的银镜中,发现银镜溶解,且无其它固体析出。
①实验任务:通过设计实验探究Fe(NO3)3溶液溶解银的原因。
②查阅资料: 在不同条件下的还原产物较复杂,有时难以观察到气体产生。
在不同条件下的还原产物较复杂,有时难以观察到气体产生。
③提出猜想:猜想a:Fe3+具有氧化性,能够氧化Ag;
猜想b:Fe(NO3)3溶液呈酸性,在此酸性条件下 能氧化Ag。
能氧化Ag。
④设计实验、验证猜想
Ⅰ. 甲同学从上述实验的生成物中检测出Fe2+,验证了猜想a成立。请写出Fe3+氧化Ag的离子方程式_______ 。
Ⅱ. 乙同学设计实验验证猜想 ,请帮他完成下表中内容
,请帮他完成下表中内容
(1)HNO3的制备:利用下图装置,模拟氨的催化氧化法制备硝酸。其中,甲为氨气的发生装置,且甲中所用试剂只能从下列物质选取:A. 浓氨水 B. NH4Cl C. NH4NO3 D. CaO

①若选择试剂A和D,则甲中发生反应的化学方程式为
②若只用一种试剂制取氨气,则该试剂的最佳选择为

③实验结束后从戊中取出少量液体于试管中,滴入紫色石蕊试液,当观察到
(2)Fe(NO3)3溶液的制备:利用硝酸与下列物质反应制备Fe(NO3)3溶液时,最佳选择为
A. Fe B. FeO C. Fe2O3 D. Fe3O4 E. Fe(OH)2
(3)Fe(NO3)3溶液性质的探究:取适量0.1mol·L-1 Fe(NO3)3溶液,加入到新制的银镜中,发现银镜溶解,且无其它固体析出。
①实验任务:通过设计实验探究Fe(NO3)3溶液溶解银的原因。
②查阅资料:
 在不同条件下的还原产物较复杂,有时难以观察到气体产生。
在不同条件下的还原产物较复杂,有时难以观察到气体产生。③提出猜想:猜想a:Fe3+具有氧化性,能够氧化Ag;
猜想b:Fe(NO3)3溶液呈酸性,在此酸性条件下
 能氧化Ag。
能氧化Ag。④设计实验、验证猜想
Ⅰ. 甲同学从上述实验的生成物中检测出Fe2+,验证了猜想a成立。请写出Fe3+氧化Ag的离子方程式
Ⅱ. 乙同学设计实验验证猜想
 ,请帮他完成下表中内容
,请帮他完成下表中内容| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② | 若银镜消失,猜想b成立; 若银镜不消失,猜想b不成立。 |
您最近一年使用:0次
2021-11-03更新
|
1162次组卷
|
6卷引用:备战2022年高考化学精准检测卷【全国卷】19
(已下线)备战2022年高考化学精准检测卷【全国卷】19(已下线)专题28 性质探究类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)广东省佛山顺德市2021-2022学年高三一模化学试题广东省揭阳市惠来县第一中学2021-2022学年高一下学期第二次阶段考试化学试题山东省新泰市第一中学北校2022-2023学年高三上学期期中考试化学试题广东省佛山顺德区2022届高三上学期第一次教学质量检测化学试题

 饱和氯水
饱和氯水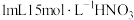 溶液
溶液

