名校
1 . 下列说法正确的有个
①将铁屑放入稀HNO3中,证明Fe比H2活泼
②FeCl3腐蚀Cu 制印刷电路板是由于铁比铜的金属性强
③检验溶液中是否含有Fe2+,取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN 溶液,观察实验现象
④磁性氧化铁溶于稀硝酸的离子方程式为:3Fe2++4H++NO3-==3Fe3++NO↑+3H2O
⑤将NaOH浓溶液滴加到饱和的FeCl3溶液中,制备Fe(OH)3胶体
⑥氢氧化铁与HI溶液反应的离子方程式为: Fe(OH)3+3H+==Fe3++3H2O
⑦铁与水蒸气在高温下的反应产物为Fe2O3 和H2
⑧1mol FeI2与足量氯气反应时转移的电子数为3NA
⑨检验Fe (NO3)2晶体是否氧化变质的方法是将Fe (NO3) 2样品溶于稀H2SO4后,滴加KSCN 溶液,观察溶液是否变红
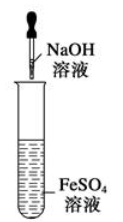
⑩图示装置能较长时间观察到Fe (OH) 2白色沉淀
①将铁屑放入稀HNO3中,证明Fe比H2活泼
②FeCl3腐蚀Cu 制印刷电路板是由于铁比铜的金属性强
③检验溶液中是否含有Fe2+,取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN 溶液,观察实验现象
④磁性氧化铁溶于稀硝酸的离子方程式为:3Fe2++4H++NO3-==3Fe3++NO↑+3H2O
⑤将NaOH浓溶液滴加到饱和的FeCl3溶液中,制备Fe(OH)3胶体
⑥氢氧化铁与HI溶液反应的离子方程式为: Fe(OH)3+3H+==Fe3++3H2O
⑦铁与水蒸气在高温下的反应产物为Fe2O3 和H2
⑧1mol FeI2与足量氯气反应时转移的电子数为3NA
⑨检验Fe (NO3)2晶体是否氧化变质的方法是将Fe (NO3) 2样品溶于稀H2SO4后,滴加KSCN 溶液,观察溶液是否变红
⑩图示装置能较长时间观察到Fe (OH) 2白色沉淀

| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
名校
2 . 如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。


(1)该实验的化学方程式为___________ 。
(2)仪器a的名称是___________ 。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃___________ (填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中___________ (填“甲”“乙”或“丙”)装置。
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.896L,则铁粉的转化率为___________ 。(转化率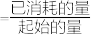 )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能存在的阳离子,小林同学进行如下实验,请你将下表补充完整:


(1)该实验的化学方程式为
(2)仪器a的名称是
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.896L,则铁粉的转化率为
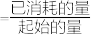 )
)(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能存在的阳离子,小林同学进行如下实验,请你将下表补充完整:
| 步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
| Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色(Fe3+与KSCN溶液反应显红色) | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②Fe+2H+=Fe2++H2↑ ③ | 反应后溶液的阳离子为⑦ |
| Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色。 | ④OH﹣+H+=H2O ⑤Fe2++2OH﹣=Fe(OH)2↓(白色) ⑥ |
您最近一年使用:0次
2021-09-15更新
|
251次组卷
|
2卷引用:河南省南阳市第一中学校2021-2022学年高一上学期第四次月考化学试题
3 . 某学习小组为了探究Fe(NO3)3的热稳定性和氧化性,特设计如下实验:
实验(一):热稳定性
利用如图装置进行实验,加热A中Fe(NO3)3固体,A和B中都有红棕色气体产生,A试管中生成了红色粉末。
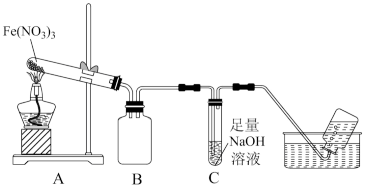
(1)图中B装置的作用是___________ ;要检验A中红色固体是否Fe2O3,应该选用的试剂是___________ 和 ___________ (填化学式)
(2)加热A中试管一段时间后,C中导管口有气泡产生,而集气瓶中无气泡产生原因是___________ ;
(3)写出硝酸铁受热分解的化学方程式:___________ ;
实验(二):氧化性
Fe3+和 Ag+的氧化性相对强弱一直是实验探究的热点。该小组设计了如下实验:
(4)实验a涉及反应的离子方程式为:___________ ;结论是:___________ ;实验c涉及反应的离子方程式为:___________ ;结论是:___________ ;
(5)请对比实验b和c,说明设计b的目的:___________ ;
(6)最终得出的结论是:Fe3+、Ag+氧化性的相对强弱与离子的___________ 有关。
实验(一):热稳定性
利用如图装置进行实验,加热A中Fe(NO3)3固体,A和B中都有红棕色气体产生,A试管中生成了红色粉末。

(1)图中B装置的作用是
(2)加热A中试管一段时间后,C中导管口有气泡产生,而集气瓶中无气泡产生原因是
(3)写出硝酸铁受热分解的化学方程式:
实验(二):氧化性
Fe3+和 Ag+的氧化性相对强弱一直是实验探究的热点。该小组设计了如下实验:
| 实验编号 | 实验操作 | 现象 |
| a | 向10 mL3 mol ·L- 1 AgNO3溶液中滴加2 mL 0.1 mol ·L- 1 FeSO4,振荡; 再加酸性高锰酸钾溶液 | 无气泡;紫红色溶液不褪色 |
| b | 向10mL 3mol· L- 1 KNO3酸性溶液(pH=1) 中插入一根洁净的银丝,并滴加氯化钠溶液 | 无气泡;无沉淀生成 |
| c | 向10mL3mol L- 1 Fe (NO3)3 (pH=1) 中插入一根洁净的银丝,并滴加氯化钠溶液 | 无气泡;但产生了白色沉淀 |
(5)请对比实验b和c,说明设计b的目的:
(6)最终得出的结论是:Fe3+、Ag+氧化性的相对强弱与离子的
您最近一年使用:0次
2021-10-16更新
|
201次组卷
|
2卷引用:河南省南阳市第一中学校2021-2022学年高一上学期第六次月考化学试题
名校
解题方法
4 . 资料显示Fe2+呈淡绿色、Fe3+呈棕黄色、FeSO3是墨绿色沉淀Fe(OH)3胶体是红褐色液体。某高三老师在讲授“Fe3+的氧化性”时,组织学生进行探究实验。
(1)在课堂教学探究Na2SO3溶液与FeCl3溶液的实际反应时,同学们有以下猜想,请补充完整:
猜想一:Na2SO3溶液与FeCl3溶液发生氧化还原反应;
猜想二:Na2SO3溶液与FeCl3溶液发生双水解反应,产生了Fe(OH)3胶体;
猜想三:___________ 。
(2)甲同学认可猜想一,他预测的实验现象是_____ ,其反应的离子方程式为____ 。
老师安排甲同学做了如下实验i:
(3)乙同学观察实验现象后认为猜想二合理,并想用红色激光笔照射该红褐色液体以验证自己的猜想正确,他预测的现象是_____ 。实验发现,乙同学的猜想成立,反应的离子方程式为_____ 。
(4)针对“氧化还原反应有没有发生”,老师组织同学们讨论,同学们思考得出以下检验方案:
方案①:取少量W液体,加铁氰化钾溶液,检验是否有Fe2+
方案②:取少量W液体,加酸性高锰酸钾溶液,检验是否有Fe2+
方案③:取少量W液体,加盐酸酸化,再加氯化钡溶液,检验是否有
你认为方案②______ (填“合理”或“不合理”),你的理由是______ 。
甲同学在老师的指导下迅速完成了实验ii:
乙同学也在老师的指导下完成了方案①的操作,发现有蓝色沉淀生成。
通过实验探究,大家认识到Fe3+与 的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。
的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。
(1)在课堂教学探究Na2SO3溶液与FeCl3溶液的实际反应时,同学们有以下猜想,请补充完整:
猜想一:Na2SO3溶液与FeCl3溶液发生氧化还原反应;
猜想二:Na2SO3溶液与FeCl3溶液发生双水解反应,产生了Fe(OH)3胶体;
猜想三:
(2)甲同学认可猜想一,他预测的实验现象是
老师安排甲同学做了如下实验i:
| 装置 | 操作 | 现象 |
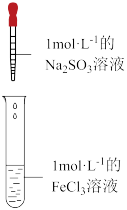 | 向2mL1mol•L-1的FeCl3溶液中,逐滴滴加2mL1mol•L-1的Na2SO3溶液 | 溶液黄色逐渐加深,最终得到红褐色液体(W) |
(4)针对“氧化还原反应有没有发生”,老师组织同学们讨论,同学们思考得出以下检验方案:
方案①:取少量W液体,加铁氰化钾溶液,检验是否有Fe2+
方案②:取少量W液体,加酸性高锰酸钾溶液,检验是否有Fe2+
方案③:取少量W液体,加盐酸酸化,再加氯化钡溶液,检验是否有

你认为方案②
甲同学在老师的指导下迅速完成了实验ii:
| 装置 | 操作 | 现象 |
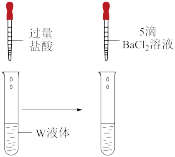 | 取1mLW液体于试管中,滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
通过实验探究,大家认识到Fe3+与
 的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。
的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。
您最近一年使用:0次
2020-12-01更新
|
323次组卷
|
2卷引用:河南省南阳市第一中学校2021届高三上期第五次考试化学试题
5 . 常温下,在没有氧气存在时,铁粉与水几乎不反应,但在高温下,铁粉能与水蒸气反应。
(1)铁粉与水蒸气反应的化学方程式是________________________________ 。
(2)停止反应,待装置冷却后,取出反应后的混合物,加入过量的稀硫酸充分反应,过滤。简述检验所得滤液中含有Fe3+的操作方法:______________________________ 。
(3)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得的产物中不含+3价的铁,原因是(结合化学方程式说明)___________________ 。
(4)向上述滤液中加入NaOH 溶液后,观察到的现象为_______________________ 。沉淀由白色变为红褐色的原因是______________________________________ (用化学方程式表示)
(5)为了得到白色的Fe(OH)2沉淀,并尽可能可能较长时间保持白色沉淀,该同学设计了如图所示的装置,请简述实验操作:______________________________________________________ 。

(1)铁粉与水蒸气反应的化学方程式是
(2)停止反应,待装置冷却后,取出反应后的混合物,加入过量的稀硫酸充分反应,过滤。简述检验所得滤液中含有Fe3+的操作方法:
(3)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得的产物中不含+3价的铁,原因是(结合化学方程式说明)
(4)向上述滤液中加入NaOH 溶液后,观察到的现象为
(5)为了得到白色的Fe(OH)2沉淀,并尽可能可能较长时间保持白色沉淀,该同学设计了如图所示的装置,请简述实验操作:

您最近一年使用:0次
2017-12-27更新
|
193次组卷
|
3卷引用:河南省南阳市第一中学2017-2018学年高一上学期第四次月考化学试题
6 . 已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:

(1)装置的连接顺序为(填写接口字母)_______ 。
(2)实验中制备氯气的离子方程式为_______ 。
(3)装置中碱石灰的作用是_______ 。
(4)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,对固体混合物进行如下实验:

淡红色溶液中加入过量 后,溶液颜色变深的原因有a:
后,溶液颜色变深的原因有a:_______ (写出离子方程式);b: 。
。
(5)该小组同学对红色褪去的原因进行探究。
步骤1:取褪色后溶液三份,第一份滴加 溶液无明显变化;
溶液无明显变化;
第二份滴加KSCN溶液,出现红色;
第三份滴加稀盐酸和 溶液,产生白色沉淀,该白色沉淀是
溶液,产生白色沉淀,该白色沉淀是_______ (填化学式)。
步骤2:另取同浓度的 溶液滴加2滴KSCN溶液,溶液变红,再通入
溶液滴加2滴KSCN溶液,溶液变红,再通入 ,无明显变化。
,无明显变化。
得出结论:溶液红色褪去的原因是_______ 。

(1)装置的连接顺序为(填写接口字母)
(2)实验中制备氯气的离子方程式为
(3)装置中碱石灰的作用是
(4)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,对固体混合物进行如下实验:

淡红色溶液中加入过量
 后,溶液颜色变深的原因有a:
后,溶液颜色变深的原因有a: 。
。(5)该小组同学对红色褪去的原因进行探究。
步骤1:取褪色后溶液三份,第一份滴加
 溶液无明显变化;
溶液无明显变化;第二份滴加KSCN溶液,出现红色;
第三份滴加稀盐酸和
 溶液,产生白色沉淀,该白色沉淀是
溶液,产生白色沉淀,该白色沉淀是步骤2:另取同浓度的
 溶液滴加2滴KSCN溶液,溶液变红,再通入
溶液滴加2滴KSCN溶液,溶液变红,再通入 ,无明显变化。
,无明显变化。得出结论:溶液红色褪去的原因是
您最近一年使用:0次
2023-01-31更新
|
385次组卷
|
2卷引用:2024届河南省南阳市方城县第一高级中学高一上学期1月期末模拟预测化学试题
名校
解题方法
7 . 二氯亚砜(SOCl2)是一种无色易挥发液体,与水剧烈水解生成两种气体,常用作脱水剂,其熔点—105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则三者的物质的量比为_______________ 。写出SOCl2吸收水蒸气的化学方程式:_______________________________ 。
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)。
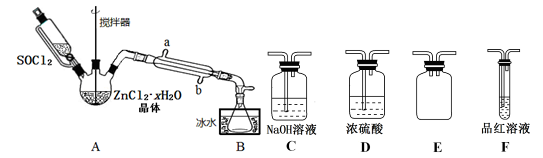
①装置的连接顺序为A→B→____ →___ →___ →____ 。
②冷凝管的进水口是_______________ 。(填“a”或“b”)
③实验结束,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤洗涤干燥,称得固体为bg。若 =
=___ (保留一位小数),即可证明ZnCl2·xH2O晶体已完全脱水。
④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热灼烧即可得到无水ZnCl2,但大家说此方法不行,请解释原因______________________ 。
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。戊同学设计了如下实验方案判断丁同学的观点:取少量FeCl3 •6H2O于试管中,加入SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程中发生了氧化还原反应。按照戊同学的思路方法,还可以选择证明__________ 或______________ (填离子符号)是否存在证明该过程是否发生了氧化还原反应。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则三者的物质的量比为
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)。

①装置的连接顺序为A→B→
②冷凝管的进水口是
③实验结束,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤洗涤干燥,称得固体为bg。若
 =
=④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热灼烧即可得到无水ZnCl2,但大家说此方法不行,请解释原因
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。戊同学设计了如下实验方案判断丁同学的观点:取少量FeCl3 •6H2O于试管中,加入SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程中发生了氧化还原反应。按照戊同学的思路方法,还可以选择证明
您最近一年使用:0次



