名校
解题方法
1 . 物质的性质决定着反应的多样性。对于 与
与 的反应,Z同学就有着不同想法。为此,他设计了以下实验:
的反应,Z同学就有着不同想法。为此,他设计了以下实验:
(1)研究 溶液与KI溶液反应
溶液与KI溶液反应
实验Ⅰ:向盛有1 mL 1 mol/L 溶液的试管中加入1 mL 1 mol/L KI溶液,振荡试管,静置。取上层清液,向其中加入
溶液的试管中加入1 mL 1 mol/L KI溶液,振荡试管,静置。取上层清液,向其中加入___________ ,溶液无明显变化。
结论Ⅰ:二者混合只发生沉淀反应,无明显氧化还原反应。
(2)探究 的氧化性强弱
的氧化性强弱
实验Ⅱ:将打磨光亮的铁丝伸入1 mol/L 溶液中,一段时间后将铁丝取出。除去溶液中剩余的
溶液中,一段时间后将铁丝取出。除去溶液中剩余的 ,取1~2 mL溶液于试管中,加入试剂X,振荡,溶液变为红色,证明溶液中存在
,取1~2 mL溶液于试管中,加入试剂X,振荡,溶液变为红色,证明溶液中存在 。试剂X应为
。试剂X应为___________ 。
结论Ⅱ:___________ 。
已知 氧化性大于
氧化性大于 ,则证明
,则证明 可与
可与 发生氧化还原反应。
发生氧化还原反应。
(3)①X同学测得常温下该 溶液的pH为5.5,于是对结论Ⅱ提出质疑,认为可能是酸性条件下
溶液的pH为5.5,于是对结论Ⅱ提出质疑,认为可能是酸性条件下 体现了氧化性。
体现了氧化性。
为了验证其质疑是否正确,他设计了一个对比实验:将打磨光亮的铁丝伸入___________ 溶液中,一段时间后将铁丝取出。取1~2 mL溶液于试管中,加入试剂X,观察溶液是否呈红色。
②同时,X同学考虑到 溶液与KI溶液反应体系中存在竞争反应。所以,他设计了以下实验来探究
溶液与KI溶液反应体系中存在竞争反应。所以,他设计了以下实验来探究 与
与 的氧化还原反应
的氧化还原反应

根据此装置,盐桥中可选择___________ 作为电解质。
a.KCl b. c.
c.
在此实验中,可通过___________ (填实验现象)证明 与
与 一定发生了氧化还原反应。
一定发生了氧化还原反应。
(4)X同学查阅资料,得知常温下,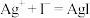
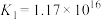 、
、

 ,试从速率和平衡两个方面解释
,试从速率和平衡两个方面解释 溶液与KI溶液混合只发生沉淀反应而无明显氧化还原反应的可能原因:
溶液与KI溶液混合只发生沉淀反应而无明显氧化还原反应的可能原因:___________ 。
 与
与 的反应,Z同学就有着不同想法。为此,他设计了以下实验:
的反应,Z同学就有着不同想法。为此,他设计了以下实验:(1)研究
 溶液与KI溶液反应
溶液与KI溶液反应实验Ⅰ:向盛有1 mL 1 mol/L
 溶液的试管中加入1 mL 1 mol/L KI溶液,振荡试管,静置。取上层清液,向其中加入
溶液的试管中加入1 mL 1 mol/L KI溶液,振荡试管,静置。取上层清液,向其中加入结论Ⅰ:二者混合只发生沉淀反应,无明显氧化还原反应。
(2)探究
 的氧化性强弱
的氧化性强弱实验Ⅱ:将打磨光亮的铁丝伸入1 mol/L
 溶液中,一段时间后将铁丝取出。除去溶液中剩余的
溶液中,一段时间后将铁丝取出。除去溶液中剩余的 ,取1~2 mL溶液于试管中,加入试剂X,振荡,溶液变为红色,证明溶液中存在
,取1~2 mL溶液于试管中,加入试剂X,振荡,溶液变为红色,证明溶液中存在 。试剂X应为
。试剂X应为结论Ⅱ:
已知
 氧化性大于
氧化性大于 ,则证明
,则证明 可与
可与 发生氧化还原反应。
发生氧化还原反应。(3)①X同学测得常温下该
 溶液的pH为5.5,于是对结论Ⅱ提出质疑,认为可能是酸性条件下
溶液的pH为5.5,于是对结论Ⅱ提出质疑,认为可能是酸性条件下 体现了氧化性。
体现了氧化性。为了验证其质疑是否正确,他设计了一个对比实验:将打磨光亮的铁丝伸入
②同时,X同学考虑到
 溶液与KI溶液反应体系中存在竞争反应。所以,他设计了以下实验来探究
溶液与KI溶液反应体系中存在竞争反应。所以,他设计了以下实验来探究 与
与 的氧化还原反应
的氧化还原反应
根据此装置,盐桥中可选择
a.KCl b.
 c.
c.
在此实验中,可通过
 与
与 一定发生了氧化还原反应。
一定发生了氧化还原反应。(4)X同学查阅资料,得知常温下,
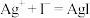
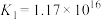 、
、

 ,试从速率和平衡两个方面解释
,试从速率和平衡两个方面解释 溶液与KI溶液混合只发生沉淀反应而无明显氧化还原反应的可能原因:
溶液与KI溶液混合只发生沉淀反应而无明显氧化还原反应的可能原因:
您最近一年使用:0次
2 . 绿矾(FeSO4·7H2O)可作还原剂、着色剂、制药等,在不同温度下易分解得到各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。回答下列问题:
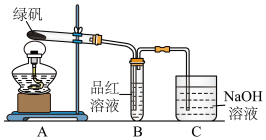
(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是____________ ,甲组由此得出绿矾的分解产物中含有SO2。装置C的作用是______________ 。
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中__________ (填字母)。
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解所得气态产物的装置:

①丙组同学的实验装置中,依次连接的合理顺序为___________ 。
②能证明绿矾分解产物中有O2的检验方法是____________ 。
(4)为证明绿矾分解产物中含有三价铁的操作及现象________ 。
(5)请用离子方程式表示下列化学反应
①向碳酸氢钠溶液中滴入三氯化铁溶液:_______
②硫酸亚铁溶液中逐滴加入酸性高锰酸钾溶液:_______

(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解所得气态产物的装置:

①丙组同学的实验装置中,依次连接的合理顺序为
②能证明绿矾分解产物中有O2的检验方法是
(4)为证明绿矾分解产物中含有三价铁的操作及现象
(5)请用离子方程式表示下列化学反应
①向碳酸氢钠溶液中滴入三氯化铁溶液:
②硫酸亚铁溶液中逐滴加入酸性高锰酸钾溶液:
您最近一年使用:0次
解题方法
3 . 某化学兴趣小组利用硫酸铁溶液与铜粉反应,又向反应后溶液中加入KSCN溶液以检验Fe3+是否有剩余,实验记录如下;
(1)写出实验1中第i步的离子方程式_______________ 。甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。查阅相关资料如下
①2Cu2++4SCN- 2CuSCN↓(白色)+(SCN)2(黄色)
2CuSCN↓(白色)+(SCN)2(黄色)
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
该同学又通过如下实验验证猜想
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是___________________________________________ 。
(3)根据实验2、3的实验现象,甲同学推断实验3中溶液变红是由于Fe2+被(SCN)2氧化,写出溶液变红的离子方程式_______________________ 。继续将实验2中的浊液进一步处理,验证了这一结论的可能性。

补充实验4的目的是排除了溶液存在Cu2+的可能,对应的现象是____________________________________________ 。
(4)乙同学同时认为,根据氧化还原反应原理,在此条件下,Cu2+也能氧化Fe2+,他的判断依据是_______ 。
(5)为排除干扰,小组同学重新设计如下装置。
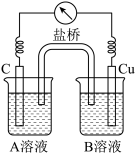
①A溶液为____________________________ 。
②“电流表指针偏转,说明Cu与Fe3+发生了反应”,你认为这种说法是否合理?__________________ (填合理或不合理),原因是__________________________________________ 。
③验证Fe3+是否参与反应的操作是________________________________________ 。
| 实验编号 | 操作 | 现象 |
| 实验1 |  | i.加入Cu粉后充分振荡,溶液逐渐变蓝; ii.取少量i中清液于试管中,滴加2滴 0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。 |
(1)写出实验1中第i步的离子方程式
①2Cu2++4SCN-
 2CuSCN↓(白色)+(SCN)2(黄色)
2CuSCN↓(白色)+(SCN)2(黄色)②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
该同学又通过如下实验验证猜想
| 实验编号 | 操作 | 现象 |
| 实验2 |  | 溶液呈绿色,一段时间后后开始出现白色沉淀,上层溶液变为黄色 |
| 实验3 | 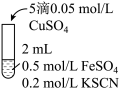 | 无色溶液立即变红,同时生成白色沉淀。 |
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是
(3)根据实验2、3的实验现象,甲同学推断实验3中溶液变红是由于Fe2+被(SCN)2氧化,写出溶液变红的离子方程式

补充实验4的目的是排除了溶液存在Cu2+的可能,对应的现象是
(4)乙同学同时认为,根据氧化还原反应原理,在此条件下,Cu2+也能氧化Fe2+,他的判断依据是
(5)为排除干扰,小组同学重新设计如下装置。

①A溶液为
②“电流表指针偏转,说明Cu与Fe3+发生了反应”,你认为这种说法是否合理?
③验证Fe3+是否参与反应的操作是
您最近一年使用:0次
2020-03-28更新
|
693次组卷
|
6卷引用:重庆市江津中学、实验中学等七校2020届高三下学期6月联考(三诊)理科综合化学试题
重庆市江津中学、实验中学等七校2020届高三下学期6月联考(三诊)理科综合化学试题北京市平谷区2020届高三第一次模拟考试化学试题北京市平谷区2020届高三3月质量监控(一模)化学试题(已下线)考点15 金属元素及其化合物-2020年高考化学命题预测与模拟试题分类精编(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精练)——2021年高考化学一轮复习讲练测
名校
4 . 下列物质的性质与用途不具有对应关系是
| A.CO具有还原性,可用于冶炼铁 | B.KNO3具有氧化性,可用于制黑火药 |
| C.Na2CO3溶液显碱性,可用于除油污 | D.FeCl3溶液显酸性,可用于刻蚀电路板上的铜 |
您最近一年使用:0次
名校
解题方法
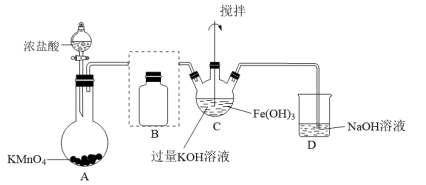
5 . K2FeO4是一种高效水处理剂,紫色固体。实验小组制备高铁酸钾(K2FeO4)并探究其性质。已知K2FeO4具有下列性质:
①可溶于水、微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定;③在酸性或中性条件下,能反应生成Fe(OH)3和O2。
(1)制备K2FeO4(夹持装置略)
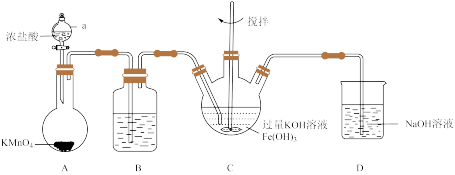
①A为氯气发生装置。其中,盛放KMnO4的仪器名称是_____ ;将Cl2通过装置B可除去杂质,以免影响实验,B中的试剂是_____ 。
②根据K2FeO4的制备实验得出:氧化性Cl2_____ FeO (填“>”或“<”),D装置的作用是
(填“>”或“<”),D装置的作用是_____ 。
③在不改变KOH溶液的浓度和体积的条件下,为了减少副反应,并提高K2FeO4产率,实验中可采取的措施是_____ 。
④C中得到紫色固体和溶液的化学方程式为_____ 。
(2)探究K2FeO4的性质
取C中紫色溶液,加入过量稀硫酸,产生黄绿色气体,得溶液X,经检验气体中含有Cl2。证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
①由方案Ⅰ中溶液变红可知X中含有Fe3+,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能因为_____ (请用离子方程式表示)。
②方案Ⅱ可证明K2FeO4氧化了Cl-,用KOH溶液洗涤的目的是_____ 。
①可溶于水、微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定;③在酸性或中性条件下,能反应生成Fe(OH)3和O2。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。其中,盛放KMnO4的仪器名称是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),D装置的作用是
(填“>”或“<”),D装置的作用是③在不改变KOH溶液的浓度和体积的条件下,为了减少副反应,并提高K2FeO4产率,实验中可采取的措施是
④C中得到紫色固体和溶液的化学方程式为
(2)探究K2FeO4的性质
取C中紫色溶液,加入过量稀硫酸,产生黄绿色气体,得溶液X,经检验气体中含有Cl2。证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量X,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液Y。取少量Y,滴加盐酸,有Cl2产生。 |
②方案Ⅱ可证明K2FeO4氧化了Cl-,用KOH溶液洗涤的目的是
您最近一年使用:0次
6 . 已知: K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。某实验小组制备高铁酸钾(K2FeO4)并探究其性质。
(1)制备K2FeO4 (夹持装置图略)
①A为氯气发生装置。A中反应的离子方程式是___________ (锰被还原为Mn2+)。
②将除杂装置图补充完整并标明所用试剂___________ 。
③C中得到紫色固体和溶液。C中Cl2发生的反应有① ,②(写离子方程式)
,②(写离子方程式)___________ 。
(2)探究K2FeO4的性质
首先,取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
①由方案I中溶液变红可知a中含有___________ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由___________ 产生。(用离子方程式表示)
②方案II可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是___________
③用高铁酸钠代替氯气作净水消毒剂的优点是___________ 。(答出两点即可)。
(1)制备K2FeO4 (夹持装置图略)

①A为氯气发生装置。A中反应的离子方程式是
②将除杂装置图补充完整并标明所用试剂

③C中得到紫色固体和溶液。C中Cl2发生的反应有①
 ,②(写离子方程式)
,②(写离子方程式)(2)探究K2FeO4的性质
首先,取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量,滴加盐酸,有Cl2产生。 |
②方案II可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
③用高铁酸钠代替氯气作净水消毒剂的优点是
您最近一年使用:0次
7 . Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
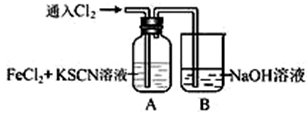
(1)B中反应的离子方程式是________________________________________________ 。
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在__________________ 。
(3)资料显示:SCN-的电子式为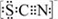 。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是
。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________ 。
②甲同学通过实验证明了SCN―中氮元素转化为NO3― ,已知SCN―中碳元素没有被氧化,若SCN―与Cl2反应生成0.5mol CO2,则转移电子的物质的量是_______________ mol。
Ⅱ. 8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄漏的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1)写出NaCN的电子式__________ ,偏碱性条件下,氰化钠溶液的CN― 被双氧水氧化为HCO3―,同时放出NH3,该反应的离子方程式:____________________________________ 。
(2)已知CN-离子、SCN-离子和Cl-离子有相似之处,氰分子(CN)2和硫氰分子(SCN)2的性质与Cl2也有相似之处,且常温常压均为气体,完成下列反应方程式:
①MnO2和HSCN的浓溶液共热的化学方程式方式为____________________________ 。
②(CN)2和NaOH溶液反应的离子反应方程式为_____________________________________ 。

(1)B中反应的离子方程式是
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在
(3)资料显示:SCN-的电子式为
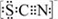 。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是
。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是②甲同学通过实验证明了SCN―中氮元素转化为NO3― ,已知SCN―中碳元素没有被氧化,若SCN―与Cl2反应生成0.5mol CO2,则转移电子的物质的量是
Ⅱ. 8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄漏的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1)写出NaCN的电子式
(2)已知CN-离子、SCN-离子和Cl-离子有相似之处,氰分子(CN)2和硫氰分子(SCN)2的性质与Cl2也有相似之处,且常温常压均为气体,完成下列反应方程式:
①MnO2和HSCN的浓溶液共热的化学方程式方式为
②(CN)2和NaOH溶液反应的离子反应方程式为
您最近一年使用:0次
名校
解题方法
8 . 下列物质性质陈述及其应用的描述中,均合理且有对应关系的是
| 选项 | 性质 | 应用 |
| A | 二氧化硫有较强的还原性 | 用于漂白纸浆、毛、丝等 |
| B | 聚乙烯燃烧生成CO2和H2O | 用聚乙烯塑料制作食品保鲜膜 |
| C | 二氧化硅常温下能和强碱溶液反应 | 可用氢氧化钠溶液雕刻玻璃 |
| D | 氯化铁具有一定的氧化性 | 铁制广告牌上的图形可用氯化铁溶液蚀刻而成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 根据实验目的,下列方案设计、现象和结论不正确的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 验证NaCl、Na2SO4混合溶液中的Cl- | 取少量混合溶液于试管中,加入过量的Ba(NO3)2溶液,静置,向上层清液中滴加AgNO3溶液 | 若上层清液变浑浊,则混合溶液中含有Cl- |
| B | 探究碳酸钠溶液显碱性是由 水解导致 水解导致 | 取2.0mL0.1 mol∙L-1Na2CO3溶液,滴入3滴酚酞,观察现象,再滴入几滴1mol/L BaCl2溶液 | 滴入酚酞溶液变红,再滴入BaCl2后出现白色沉淀,溶液颜色变浅 |
| C | 探究铝在浓硝酸中会发生钝化 | 将去除氧化膜的铝片放入浓硝酸中,一段时间后取出用水洗净,放入硫酸铜溶液 | 铝片表面未见紫红色固体,说明铝片已钝化 |
| D | 证明氧化性:Cl2>Fe3+> | 向2支盛有FeCl2溶液的试管中分别通入氯气。向其中一支滴加KSCN溶液,向另一支依次滴加H2SO3溶液和BaCl2溶液 | 第一支试管中溶液变成血红色,第二支试管中产生白色沉淀,则证明氧化性:Cl2>Fe3+> |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
真题
名校
10 . 下列实验操作及其现象与对应结论不匹配的是
| 选项 | 实验操作及其现象 | 结论 |
| A | 将CO与水蒸气通过炽热的催化剂,所得气体通入澄清石灰水,溶液变浑浊 | 水蒸气有氧化性 |
| B | 将新制Cu(OH)2加入葡萄糖溶液中,加热至沸腾,有砖红色沉淀产生 | 葡萄糖具有还原性 |
| C | 将NaBiO3固体加入酸性MnSO4溶液中,充分振荡,溶液变为紫红色 | NaBiO3有氧化性 |
| D | 有FeCl2溶液和KSCN溶液混合后,滴加H2O2溶液,溶液变为红色 | H2O2有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-27更新
|
3219次组卷
|
2卷引用:重庆市2021年高考真题化学试题



