名校
1 .  和
和 是
是 的两种重要的氯化物。
的两种重要的氯化物。
Ⅰ.某研究小组用如图装置模拟工业上生产无水 的过程。利用该装置制备
的过程。利用该装置制备 的原理可表示为:
的原理可表示为:
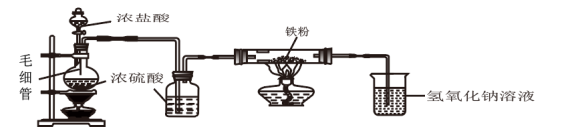
(1)装置中毛细管的作用是___________ 。
(2)从安全角度看,本装置的缺点是___________ 。(任答一条即可)
Ⅱ.现代工业生产中常用电解 溶液的方法制取
溶液的方法制取 溶液,用于吸收有毒的
溶液,用于吸收有毒的 气体。
气体。
(3)工艺原理如图所示,回答下列问题:
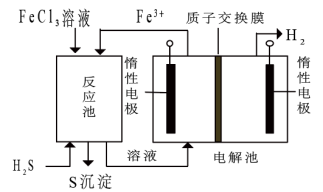
①解池中的总反应离子方程式___________ 。
②工艺中,___________ 溶液可以循环利用(填“ ”或“
”或“ ”)
”)
Ⅲ.探究 的各种平衡表现:
的各种平衡表现:
(4)25℃时,向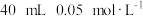 的
的 溶液中一次性加入
溶液中一次性加入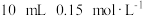 的
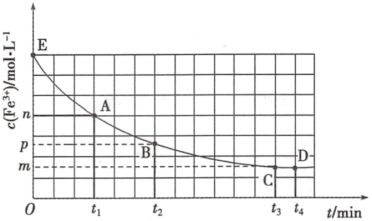
的 溶液,发生反应,混合溶液中
溶液,发生反应,混合溶液中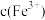 与反应时间(
与反应时间(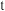 )的变化如图所示。下列说法正确的是___________。
)的变化如图所示。下列说法正确的是___________。
(5) 溶液与
溶液与 的反应体系中存在下列两种化学变化:
的反应体系中存在下列两种化学变化:
(ⅰ) 与
与 发生络合反应生成
发生络合反应生成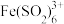 (红棕色);
(红棕色);
(ⅱ) 与
与 发生氧化还原反应,其离子方程式为①
发生氧化还原反应,其离子方程式为①___________ 。
④实验结论:反应(ⅰ)、(ⅱ)的活化能大小关系是: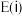
___________ 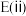 (填“>”“<”或“=”,下同),平衡常数大小关系:
(填“>”“<”或“=”,下同),平衡常数大小关系: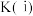
___________ 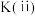 。
。
 和
和 是
是 的两种重要的氯化物。
的两种重要的氯化物。Ⅰ.某研究小组用如图装置模拟工业上生产无水
 的过程。利用该装置制备
的过程。利用该装置制备 的原理可表示为:
的原理可表示为:

(1)装置中毛细管的作用是
(2)从安全角度看,本装置的缺点是
Ⅱ.现代工业生产中常用电解
 溶液的方法制取
溶液的方法制取 溶液,用于吸收有毒的
溶液,用于吸收有毒的 气体。
气体。(3)工艺原理如图所示,回答下列问题:

①解池中的总反应离子方程式
②工艺中,
 ”或“
”或“ ”)
”) Ⅲ.探究
 的各种平衡表现:
的各种平衡表现:(4)25℃时,向
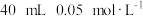 的
的 溶液中一次性加入
溶液中一次性加入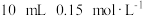 的
的 溶液,发生反应,混合溶液中
溶液,发生反应,混合溶液中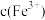 与反应时间(
与反应时间(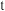 )的变化如图所示。下列说法正确的是___________。
)的变化如图所示。下列说法正确的是___________。
A.该反应的离子方程式为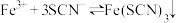 |
B.E点对应的坐标为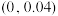 |
C.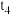 时向溶液中加入 时向溶液中加入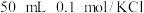 溶液,平衡不移动 溶液,平衡不移动 |
D.若该反应是可逆反应,在25℃时平衡常数的数值为: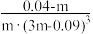 |
 溶液与
溶液与 的反应体系中存在下列两种化学变化:
的反应体系中存在下列两种化学变化:(ⅰ)
 与
与 发生络合反应生成
发生络合反应生成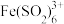 (红棕色);
(红棕色);(ⅱ)
 与
与 发生氧化还原反应,其离子方程式为①
发生氧化还原反应,其离子方程式为①| 步骤 | 现象 | 结论 |
Ⅰ.取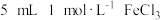 溶液于试管中,通入 溶液于试管中,通入 至饱和 至饱和 | 溶液很快由黄色变为红棕色 | — |
| Ⅱ.用激光笔照射步骤Ⅰ中的红棕色溶液 | 溶液中无明显光路 | ②红棕色物质不是 |
| Ⅲ.将步骤Ⅰ中的溶液静置 | 1小时后,溶液逐渐变为浅绿色 | — |
Ⅳ.向步骤Ⅲ中所得溶液加入2滴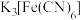 溶液 溶液 | ③ | 溶液中含有 |
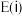
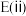 (填“>”“<”或“=”,下同),平衡常数大小关系:
(填“>”“<”或“=”,下同),平衡常数大小关系: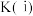
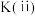 。
。
您最近一年使用:0次
2 . 下列实验现象和结论正确的是
| 选项 | 实验目的 | 实验操作 | 实验现象、结论 |
| A | 探究化学反应的限度 | 取5mL0.1mol/LFeCl3溶液,滴加0.1mol/LKI溶液5~6滴,充分反应后,取溶液分别加入KSCN溶液和淀粉溶液中 | 若溶液呈现血红色和蓝色,则该反应是有限度 |
| B | 醋酸钠溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体[Ka(CH3COOH)=Kb(NH3·H2O)],观察溶液颜色变化 | 若溶液颜色加深,则存在水解平衡 |
| C | 比较AgCl和AgI的Ksp大小 | 向NaCl和NaI的混合溶液中滴加少量AgNO3溶液,观察现象 | 若溶液中产生黄色沉淀,则Ksp(AgI)<Ksp(AgCl) |
| D | 卤代烃中卤原子的检验 | 将C(CH3)3CH2Br加入NaOH乙醇溶液中,充分加热:冷却后,取混合液加足量硝酸酸化后滴加AgNO3溶液 | 若不产生浅黄色沉淀,则卤代烃中不含有溴元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 下列实验设计、现象和结论都正确的是
| 选项 | 实验目的 | 实验设计和现象 | 实验结论 |
| A | 探究淀粉的水解程度 | 将淀粉溶液在酸性条件下加热一段时间后,向水解液中滴加银氨溶液,加热,未出现光亮的银镜 | 淀粉尚未水解 |
| B | 判断久置的亚硫酸钠是否变质 | 取一定质量的亚硫酸钠固体于试管中,加蒸馏水完全溶解后,滴加BaCl2溶液,出现白色沉淀 | 亚硫酸钠已变质 |
| C | 检验溶液中是否含Fe2+ | 向待测液中通入氯气并加入KSCN溶液,溶液变红 | 溶液中含有Fe2+ |
| D | 探究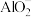 和 和 反应原理 反应原理 | 向 溶液中滴加 溶液中滴加 溶液,有白色沉淀生成 溶液,有白色沉淀生成 | 溶液中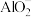 结合 结合 的能力比 的能力比 强 强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 室温下,下列实验探究方案能达到实验目的的是
| 选项 | 探究方案 | 实验目的 |
| A | 将铁锈溶于足量浓盐酸,再向溶液中滴入几滴 溶液,观察溶液颜色变化 溶液,观察溶液颜色变化 | 检验铁锈中是否含有二价铁 |
| B | 将 溶液与 溶液与 溶液混合,观察现象 溶液混合,观察现象 | 验证结合质子能力: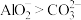 |
| C | 向 溶液中滴入硫酸酸化的 溶液中滴入硫酸酸化的 溶液,观察溶液颜色变化 溶液,观察溶液颜色变化 | 验证氧化性: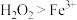 |
| D | 用pH计分别测定等体积的 溶液和 溶液和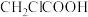 溶液的pH 溶液的pH | 探究键的极性对羟酸酸性的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-27更新
|
324次组卷
|
2卷引用:重庆市第八中学2024届高三上学期高考适应性月考卷(三)化学试题
名校
解题方法
5 . 根据实验目的,下列方案设计、现象和结论不正确的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 验证NaCl、Na2SO4混合溶液中的Cl- | 取少量混合溶液于试管中,加入过量的Ba(NO3)2溶液,静置,向上层清液中滴加AgNO3溶液 | 若上层清液变浑浊,则混合溶液中含有Cl- |
| B | 探究碳酸钠溶液显碱性是由 水解导致 水解导致 | 取2.0mL0.1 mol∙L-1Na2CO3溶液,滴入3滴酚酞,观察现象,再滴入几滴1mol/L BaCl2溶液 | 滴入酚酞溶液变红,再滴入BaCl2后出现白色沉淀,溶液颜色变浅 |
| C | 探究铝在浓硝酸中会发生钝化 | 将去除氧化膜的铝片放入浓硝酸中,一段时间后取出用水洗净,放入硫酸铜溶液 | 铝片表面未见紫红色固体,说明铝片已钝化 |
| D | 证明氧化性:Cl2>Fe3+> | 向2支盛有FeCl2溶液的试管中分别通入氯气。向其中一支滴加KSCN溶液,向另一支依次滴加H2SO3溶液和BaCl2溶液 | 第一支试管中溶液变成血红色,第二支试管中产生白色沉淀,则证明氧化性:Cl2>Fe3+> |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 下列实验能达到预期目的的是
| 选项 | 实验内容 | 实验目的 |
| A | 向浓碱溶液中滴入FeCl3饱和溶液,煮沸,溶液变红褐色 | 制备 Fe(OH)3胶体 |
| B | 向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液 | 比较氧化性:Fe3+<I2 |
| C | 向盛有2 g碳酸钠粉末的试管中加入少量水后,碳酸钠粉末结块变成晶体,用手触摸试管壁 | 验证碳酸钠粉末遇水生成碳酸钠晶体是放热反应 |
| D | 向盛有5 mL 0.05 mol·L-1FeCl3溶液中加入1 mL 0.15 mol·L-1 KSCN 溶液,溶液显红色,再加入1mol· L-1 KSCN溶液 | 验证 Fe3+和SCN-的反应为可逆反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 下列实验操作能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 检验补铁剂硫酸亚铁片是否被氧化 | 将K3[Fe(CN)6]溶液滴入硫酸亚铁片的水溶液 |
| B | 验证SO2的漂白性 | 将SO2通入酸性KMnO4溶液 |
| C | 制备少量的NH3 | 将浓氨水滴加到生石灰上 |
| D | 检验洁厕剂的主要成分是盐酸 | 向待测液中滴加硝酸银溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
8 . 为了保护环境、利用锰资源,可通过如下流程用废旧电池中黑锰粉(含有 、MnOOH、
、MnOOH、 和少量
和少量 、
、 及炭黑等)制备
及炭黑等)制备 。
。
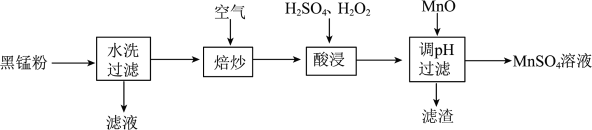
请回答下列问题:
(1)元素Mn在周期表中的位置是_______ , 中含有的化学键类型是
中含有的化学键类型是_______ 。
(2)“焙炒”时 除氧化MnOOH外,还有一个作用是
除氧化MnOOH外,还有一个作用是_______ ;写出 与MnOOH反应的化学方程式
与MnOOH反应的化学方程式_______ 。
(3)加快“酸浸”速率的措施是_______ (写两条即可);“酸浸”时除了固体溶解、溶液颜色变化外,还可能有的现象是_______ ;“酸浸”中加 的目的是
的目的是_______ 。
(4)“滤渣”的主要成分是_______ 。
(5)请设计实验方案检验所得 溶液中无
溶液中无 :
:_______ (写出操作、现象和结论)。
 、MnOOH、
、MnOOH、 和少量
和少量 、
、 及炭黑等)制备
及炭黑等)制备 。
。
请回答下列问题:
(1)元素Mn在周期表中的位置是
 中含有的化学键类型是
中含有的化学键类型是(2)“焙炒”时
 除氧化MnOOH外,还有一个作用是
除氧化MnOOH外,还有一个作用是 与MnOOH反应的化学方程式
与MnOOH反应的化学方程式(3)加快“酸浸”速率的措施是
 的目的是
的目的是(4)“滤渣”的主要成分是
(5)请设计实验方案检验所得
 溶液中无
溶液中无 :
:
您最近一年使用:0次
9 . 某小组在验证反应“ ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。
向硝酸酸化的 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
(1)检测到滤液中含有 ,可以选用的试剂为
,可以选用的试剂为___________ (填化学式)溶液。 产生的原因可能有以下几种。
产生的原因可能有以下几种。
假设a:可能是铁粉表面有氧化层,能产生 。
。
假设b:空气中存在 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:___________ 。
假设c:酸性溶液中的 具有氧化性,可产生
具有氧化性,可产生 。
。
(2)某同学证明上面假设c不成立,向硝酸酸化的___________ 硝酸钠溶液中加入过量铁粉,搅拌后静置,一段时间后,上层清液未变黄色,经检验无 。
。
(3)取过滤后的黑色固体,洗涤后,___________ (填操作和现象),证明黑色固体中含有Ag。
(4)某同学利用原电池证明 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为___________ 。写出石墨电极上发生的电极反应式:___________ 。电流表指针不再偏转后,向左侧烧杯中加入 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为___________ (填“正极”或“负极”),银电极的电极反应式为___________ 。
 ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。向硝酸酸化的
 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。(1)检测到滤液中含有
 ,可以选用的试剂为
,可以选用的试剂为 产生的原因可能有以下几种。
产生的原因可能有以下几种。假设a:可能是铁粉表面有氧化层,能产生
 。
。假设b:空气中存在
 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:假设c:酸性溶液中的
 具有氧化性,可产生
具有氧化性,可产生 。
。(2)某同学证明上面假设c不成立,向硝酸酸化的
 。
。(3)取过滤后的黑色固体,洗涤后,
(4)某同学利用原电池证明
 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为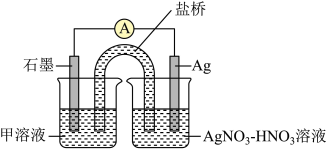
您最近一年使用:0次
2023-10-26更新
|
636次组卷
|
7卷引用:重庆市百师联盟2024届高三一轮复习联考(二)
名校
解题方法
10 . 物质的性质决定着反应的多样性。对于 与
与 的反应,Z同学就有着不同想法。为此,他设计了以下实验:
的反应,Z同学就有着不同想法。为此,他设计了以下实验:
(1)研究 溶液与KI溶液反应
溶液与KI溶液反应
实验Ⅰ:向盛有1 mL 1 mol/L 溶液的试管中加入1 mL 1 mol/L KI溶液,振荡试管,静置。取上层清液,向其中加入
溶液的试管中加入1 mL 1 mol/L KI溶液,振荡试管,静置。取上层清液,向其中加入___________ ,溶液无明显变化。
结论Ⅰ:二者混合只发生沉淀反应,无明显氧化还原反应。
(2)探究 的氧化性强弱
的氧化性强弱
实验Ⅱ:将打磨光亮的铁丝伸入1 mol/L 溶液中,一段时间后将铁丝取出。除去溶液中剩余的
溶液中,一段时间后将铁丝取出。除去溶液中剩余的 ,取1~2 mL溶液于试管中,加入试剂X,振荡,溶液变为红色,证明溶液中存在
,取1~2 mL溶液于试管中,加入试剂X,振荡,溶液变为红色,证明溶液中存在 。试剂X应为
。试剂X应为___________ 。
结论Ⅱ:___________ 。
已知 氧化性大于
氧化性大于 ,则证明
,则证明 可与
可与 发生氧化还原反应。
发生氧化还原反应。
(3)①X同学测得常温下该 溶液的pH为5.5,于是对结论Ⅱ提出质疑,认为可能是酸性条件下
溶液的pH为5.5,于是对结论Ⅱ提出质疑,认为可能是酸性条件下 体现了氧化性。
体现了氧化性。
为了验证其质疑是否正确,他设计了一个对比实验:将打磨光亮的铁丝伸入___________ 溶液中,一段时间后将铁丝取出。取1~2 mL溶液于试管中,加入试剂X,观察溶液是否呈红色。
②同时,X同学考虑到 溶液与KI溶液反应体系中存在竞争反应。所以,他设计了以下实验来探究
溶液与KI溶液反应体系中存在竞争反应。所以,他设计了以下实验来探究 与
与 的氧化还原反应
的氧化还原反应___________ 作为电解质。
a.KCl b. c.
c.
在此实验中,可通过___________ (填实验现象)证明 与
与 一定发生了氧化还原反应。
一定发生了氧化还原反应。
(4)X同学查阅资料,得知常温下,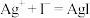
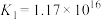 、
、

 ,试从速率和平衡两个方面解释
,试从速率和平衡两个方面解释 溶液与KI溶液混合只发生沉淀反应而无明显氧化还原反应的可能原因:
溶液与KI溶液混合只发生沉淀反应而无明显氧化还原反应的可能原因:___________ 。
 与
与 的反应,Z同学就有着不同想法。为此,他设计了以下实验:
的反应,Z同学就有着不同想法。为此,他设计了以下实验:(1)研究
 溶液与KI溶液反应
溶液与KI溶液反应实验Ⅰ:向盛有1 mL 1 mol/L
 溶液的试管中加入1 mL 1 mol/L KI溶液,振荡试管,静置。取上层清液,向其中加入
溶液的试管中加入1 mL 1 mol/L KI溶液,振荡试管,静置。取上层清液,向其中加入结论Ⅰ:二者混合只发生沉淀反应,无明显氧化还原反应。
(2)探究
 的氧化性强弱
的氧化性强弱实验Ⅱ:将打磨光亮的铁丝伸入1 mol/L
 溶液中,一段时间后将铁丝取出。除去溶液中剩余的
溶液中,一段时间后将铁丝取出。除去溶液中剩余的 ,取1~2 mL溶液于试管中,加入试剂X,振荡,溶液变为红色,证明溶液中存在
,取1~2 mL溶液于试管中,加入试剂X,振荡,溶液变为红色,证明溶液中存在 。试剂X应为
。试剂X应为结论Ⅱ:
已知
 氧化性大于
氧化性大于 ,则证明
,则证明 可与
可与 发生氧化还原反应。
发生氧化还原反应。(3)①X同学测得常温下该
 溶液的pH为5.5,于是对结论Ⅱ提出质疑,认为可能是酸性条件下
溶液的pH为5.5,于是对结论Ⅱ提出质疑,认为可能是酸性条件下 体现了氧化性。
体现了氧化性。为了验证其质疑是否正确,他设计了一个对比实验:将打磨光亮的铁丝伸入
②同时,X同学考虑到
 溶液与KI溶液反应体系中存在竞争反应。所以,他设计了以下实验来探究
溶液与KI溶液反应体系中存在竞争反应。所以,他设计了以下实验来探究 与
与 的氧化还原反应
的氧化还原反应
a.KCl b.
 c.
c.
在此实验中,可通过
 与
与 一定发生了氧化还原反应。
一定发生了氧化还原反应。(4)X同学查阅资料,得知常温下,
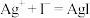
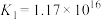 、
、

 ,试从速率和平衡两个方面解释
,试从速率和平衡两个方面解释 溶液与KI溶液混合只发生沉淀反应而无明显氧化还原反应的可能原因:
溶液与KI溶液混合只发生沉淀反应而无明显氧化还原反应的可能原因:
您最近一年使用:0次



