1 . 某兴趣小组同学为探究黑木耳中含铁量,进行如下实验。
已知:ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等。每100 g黑木耳含铁量高达185 mg。
ⅱ.紫红色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。
Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下。
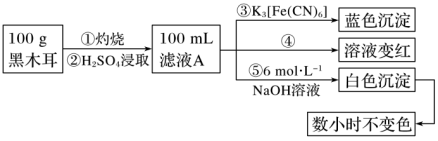
(1)步骤②得到滤液A的操作是___________ 。
(2)步骤④检验Fe3+所用试剂是___________ 溶液。
(3)根据上述实验得出的结论是___________ (填字母)。
a.黑木耳中一定含Fe2+和Fe3+
b.滤液A中一定含Fe2+和Fe3+
c.白色沉淀中一定含Fe(OH)2
Ⅱ.为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
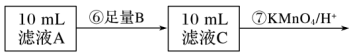
(4)可选做试剂B的物质是___________ (填字母)。
a.Na b.Zn c.Fe d.Cu
(5)步骤⑦中观察到的实验现象是___________ ,反应的离子方程式是___________ 。
(6)若乙同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是___________ 。
已知:ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等。每100 g黑木耳含铁量高达185 mg。
ⅱ.紫红色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。
Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下。

(1)步骤②得到滤液A的操作是
(2)步骤④检验Fe3+所用试剂是
(3)根据上述实验得出的结论是
a.黑木耳中一定含Fe2+和Fe3+
b.滤液A中一定含Fe2+和Fe3+
c.白色沉淀中一定含Fe(OH)2
Ⅱ.为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。

(4)可选做试剂B的物质是
a.Na b.Zn c.Fe d.Cu
(5)步骤⑦中观察到的实验现象是
(6)若乙同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是
您最近一年使用:0次
2022-03-31更新
|
198次组卷
|
5卷引用:云南省楚雄州民族中学2021-2022学年高一下学期2月开学考试化学试题
名校
解题方法
2 . 某同学用如图装置制备 并探究其性质。查阅资料知:
并探究其性质。查阅资料知:
i. 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii. 有较强的还原性
有较强的还原性
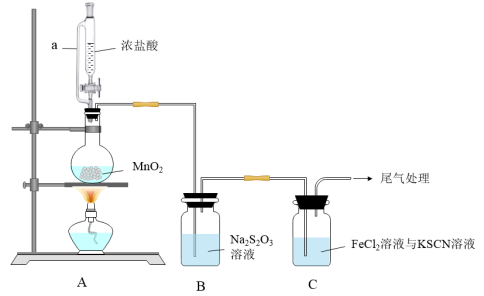
(1)装置A中a的作用是___________ ;装置A中制备 的离子方程式为
的离子方程式为___________ 。
(2)上述装置中存在一处缺陷,会干扰 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是___________ 。
(3)改进实验装置后,B中 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。
(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①生成使KSCN溶液变为血红色物质的离子方程式___________ ;
②某同学对褪色原因提出假设:
假设1: 被
被 氧化为更高价态;
氧化为更高价态;
假设2:___________ ;
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,___________ (写出操作及现象)说明假设2成立。
 并探究其性质。查阅资料知:
并探究其性质。查阅资料知:i.
 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii.
 有较强的还原性
有较强的还原性
(1)装置A中a的作用是
 的离子方程式为
的离子方程式为(2)上述装置中存在一处缺陷,会干扰
 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是(3)改进实验装置后,B中
 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①生成使KSCN溶液变为血红色物质的离子方程式
②某同学对褪色原因提出假设:
假设1:
 被
被 氧化为更高价态;
氧化为更高价态;假设2:
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,
您最近一年使用:0次
2020-12-31更新
|
136次组卷
|
2卷引用:云南省马关县第一中学校2021-2022学年高一下学期开学考试化学试题
名校
3 . 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
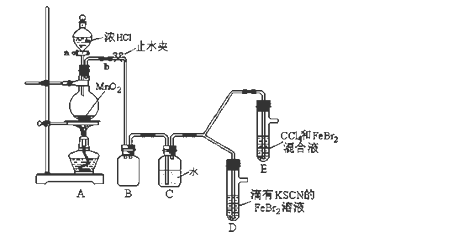
(1)①装置A中发生反应的离子方程式是_____________________ 。
②整套实验装置存在一处明显的不足,请指出_______________________ 。
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化 。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________ ,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________ 溶液,若溶液颜色________ ,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式 (离子或化学方程式不限定)解释产生白色沉淀原因__________________ 、_______________________

(1)①装置A中发生反应的离子方程式是
②整套实验装置存在一处明显的不足,请指出
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由 |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN- Fe(SCN)3 是一个可逆反应。 Fe(SCN)3 是一个可逆反应。ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。 ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 ⅳ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用
您最近一年使用:0次
2016-12-09更新
|
1549次组卷
|
5卷引用:云南省文山州广南一中2019-2020学年高一上学期期中考试化学试题
名校
4 . (1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下,请配平此氧化还原反应方程式:_____ FeS2+_____H++_____N =______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为
=______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为_____________ 。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是____________ (填字母)

A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1 L 0.2 mol·L-1的FeBr2溶液中通入标准状况下氯气2.24 L,被氧化的粒子是________ ,此反应的离子方程式:________ 。
 =______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为
=______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是

A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1 L 0.2 mol·L-1的FeBr2溶液中通入标准状况下氯气2.24 L,被氧化的粒子是
您最近一年使用:0次
2020-01-13更新
|
238次组卷
|
4卷引用:云南省云龙县第二中学2019-2020学年高一上学期期末考试化学试题
名校
解题方法
5 . 铁是人体必需的微量元素,下面是一种常见补铁药品说明书中的部分内容:该药品含 33%~36%,不溶于水但能溶于人体中的胃酸:与维生素C(Vc)同服可增加本品吸收。某同学设计了以下实验检测该补铁药品中是否含有
33%~36%,不溶于水但能溶于人体中的胃酸:与维生素C(Vc)同服可增加本品吸收。某同学设计了以下实验检测该补铁药品中是否含有 并探究Vc的作用:
并探究Vc的作用:不正确 的是
 33%~36%,不溶于水但能溶于人体中的胃酸:与维生素C(Vc)同服可增加本品吸收。某同学设计了以下实验检测该补铁药品中是否含有
33%~36%,不溶于水但能溶于人体中的胃酸:与维生素C(Vc)同服可增加本品吸收。某同学设计了以下实验检测该补铁药品中是否含有 并探究Vc的作用:
并探究Vc的作用:
A.试剂1为 溶液,目的是溶解药片 溶液,目的是溶解药片 |
B.加入 溶液后溶液变为淡红色,说明溶液中有少量 溶液后溶液变为淡红色,说明溶液中有少量 |
| C.加入Vc后红色溶液颜色褪去,说明Vc具有一定的氧化性 |
| D.新制氯水可替换为双氧水进行实验 |
您最近一年使用:0次
2024-02-16更新
|
108次组卷
|
2卷引用:云南师范大学附属中学2023-2024学年高一下学期第一次月考化学试题
6 . 某化学学习小组欲探究铁及其化合物的氧化性和还原性。请你协助他们完成实验报告。
实验目的:探究铁及其化合物的氧化性和还原性
(1)实验试剂及仪器:
试剂:氯化亚铁溶液、氯化铁溶液、氯水、KSCN溶液、铁、 锌片、铜片、稀硫酸
仪器:除胶头滴管外,你认为本实验必不可少的一种玻璃仪器是______ 。
(2)实验记录(仿照①实验作答,填写划线部分)。
(3)学习小组的同学将从本实验中获得的知识推广到其他类物质的学习,请判断下列物质既有氧化性又有还原性的是______
A.Cl2 B.Na C. Mg2+D.H2O2
(4)在实验②中,有部分同学在氯化亚铁溶液中滴入KSCN溶液后,出现了血红色,你认为是什么原因:__ ,你对实验员在配制氯化亚铁溶液时,提出的建议是____ 。
(5)在配制氯化铁溶液时,含有少量Fe2+, 为检验少量Fe2+的存在,请从下列物质中选择合适的试剂__
A.KSCN溶液 B.稀盐酸 C.KMnO4溶液 D.NaOH溶液
实验目的:探究铁及其化合物的氧化性和还原性
(1)实验试剂及仪器:
试剂:氯化亚铁溶液、氯化铁溶液、氯水、KSCN溶液、铁、 锌片、铜片、稀硫酸
仪器:除胶头滴管外,你认为本实验必不可少的一种玻璃仪器是
(2)实验记录(仿照①实验作答,填写划线部分)。
| 序号 | 实验设计 | 实验现象 | 离子方程式 | 解释与结论 |
| ① | 在铁粉中滴入稀硫酸 | 铁粉溶解,溶液由无色变成浅绿色,生成无色无味气体 | Fe+2H+=H2↑+Fe2+ | Fe具有还原性 |
| ② | FeCl2溶液中滴入KSCN溶液,再加氯水 | 滴入KSCN溶液无明显变化,加入氯水立即变成血红色 | ||
| ③ | FeCl2溶液中加入锌片 | Fe2++Zn=Fe+Zn2+ | | |
| ④ | 2Fe3++Cu=2Fe2++Cu2+ | Fe3+具有氧化性。 |
A.Cl2 B.Na C. Mg2+D.H2O2
(4)在实验②中,有部分同学在氯化亚铁溶液中滴入KSCN溶液后,出现了血红色,你认为是什么原因:
(5)在配制氯化铁溶液时,含有少量Fe2+, 为检验少量Fe2+的存在,请从下列物质中选择合适的试剂
A.KSCN溶液 B.稀盐酸 C.KMnO4溶液 D.NaOH溶液
您最近一年使用:0次
2021-04-01更新
|
119次组卷
|
2卷引用:云南省玉溪市通海县第一中学2021—2022学年高一上学期期末考试化学试题
名校
解题方法
7 . 已知下述四个实验均能发生化学反应:
下列判断不正确的是( )
| ① | ② | ③ | ④ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴氯水 | 将铜丝放入氯化铁溶液中 | 向FeCl2溶液中滴入KSCN溶液,无明显现象,再滴入氯水,变红 |
| A.实验①中铁钉只做还原剂 |
| B.实验②中Fe2+只显还原性 |
| C.实验③中发生的是置换反应 |
| D.上述实验证明:氧化性:Fe3+>Cu2+>Fe2+,Fe2+遇KSCN溶液无红色物质生成 |
您最近一年使用:0次
2021-01-29更新
|
140次组卷
|
7卷引用:云南省泸西县泸源普通高级中学2021-2022 学年高一上学期第三次月考(期末)化学试题
名校
8 . 已知如下三个实验均能发生化学反应:
下列判断正确的是
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴氯水 | 将铜丝放入氯化铁溶液中 |
| A.实验①中铁作还原剂 | B.实验②中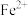 既显氧化性又显还原性 既显氧化性又显还原性 |
| C.实验③中发生的是置换反应 | D.上述实验证明氧化性: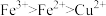 |
您最近一年使用:0次
2020-02-14更新
|
943次组卷
|
29卷引用:云南省楚雄第一中学2022-2023学年高一下学期期末考试化学试题
云南省楚雄第一中学2022-2023学年高一下学期期末考试化学试题浙江省宁波诺丁汉大学附属中学2017-2018学年高一上学期期中考试化学试题江西省鹰潭市2017-2018学年高一上学期期末质量检测化学试题2018-2019学年苏教版高中化学必修一 专题综合测评3河北省承德市第一中学2018-2019学年高一上学期第三次月考化学试题宁夏回族自治区吴忠市青铜峡市高级中学2019-2020学年高一上学期第二次月考化学试题辽宁省实验中学东戴河分校2019-2020学年高一上学期12月月考化学试题陕西省黄陵中学2019-2020学年高一上学期期末考试化学试题(普通班)安徽省淮北师范大学附属实验中学2019-2020学年高一上学期期末考试化学试题四川省双流棠湖中学2019-2020学年高一上学期期末模拟考试化学试题安徽省六安市第一中学2019-2020学年高一下学期延期开学期间辅导专题卷(二)化学试题(已下线)3.1.2 铁及其化合物之间的转化关系练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)人教版(2019)高一必修第一册第三章 铁 金属材料 第一节 铁及其化合物 课时2 铁盐、亚铁盐鲁科版(2019)高一必修第一册第三章第1节 铁的多样性 课时1 亚铁盐和铁盐铁 铁的氧化物和铁的氢氧化物陕西省榆林市第十二中学2021届高三上学期第一次月考化学试题(已下线)江西省宜丰中学2018_2019学年高一化学上学期期末考试试卷(已下线)3.1.1 铁的单质(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)宁夏石嘴山市第三中学2020-2021学年高一上学期第二次月考化学试题新疆昌吉州第二中学2020-2021学年高一下学期第一次月考化学试题(苏教版2019)必修第二册专题9 金属与人类文明 第二单元 探究铁及其化合物的转化(已下线)3.1.2 铁盐和亚铁盐-2021-2022学年高一化学课后培优练(人教版2019必修第一册)山东省临沂市莒南县第二中学2021-2022学年高一12月月考化学试题宁夏青铜峡市宁朔中学2022-2023学年高一上学期线上期末考试化学试题天津市武清区2022-2023学年高一上学期期末考试化学试题作业(十八) 铁盐和亚铁盐(已下线)BBWYhjhx1006.pdf山东省肥城市第一高级中学等学校2023-2024学年高一上学期12月大联考化学试题天津市武清区黄花店中学2023-2024学年高一上学期第二次形成性练习化学试题四川省成都市龙泉驿区东竞高级中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
9 . 下列有关物质的性质与用途具有对应关系的是
| A.Al2O3具有两性,可用作耐高温材料 |
| B.NaHCO3溶液呈碱性,可用于制备纯碱 |
| C.铝具有良好导热性,可用作贮运浓硝酸 |
| D.FeCl3溶液具有氧化性,可用作蚀刻铜电路板 |
您最近一年使用:0次
2020-07-22更新
|
278次组卷
|
5卷引用:云南省普洱市景东彝族自治县第一中学2020-2021学年高一上学期1月考化学试题
10 . 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是_______________ 。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是______________________________ ,可能观察到的现象是溶液由浅绿色变为________ 色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选_________ 滴入小明所得的混合液中,并通过溶液出现______ 色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为__________ (填化学式)。
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是______ ,相关反应的离子方程式是_____________ 。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是
您最近一年使用:0次
2018-05-06更新
|
434次组卷
|
7卷引用:云南省彝良县民中2018-2019学年高一上学期12月份考试化学试题
云南省彝良县民中2018-2019学年高一上学期12月份考试化学试题贵州省遵义航天高级中学2017-2018学年高一下学期期中考试理科综合化学试题(已下线)专题10 性质探究类综合实验-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)陕西省渭南市华州区咸林中学2021-2022学年高一上学期第三阶段质量检测化学试题陕西省铜川市耀州中学2022-2023学年高一上学期期末考试化学试题作业(十八) 铁盐和亚铁盐河南省南阳市六校2023-2024学年高一上学期12月月考化学试题



