名校
解题方法
1 . 某同学用如图装置制备 并探究其性质。查阅资料知:
并探究其性质。查阅资料知:
i. 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii. 有较强的还原性
有较强的还原性
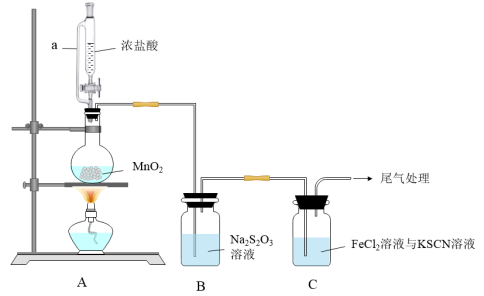
(1)装置A中a的作用是___________ ;装置A中制备 的离子方程式为
的离子方程式为___________ 。
(2)上述装置中存在一处缺陷,会干扰 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是___________ 。
(3)改进实验装置后,B中 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。
(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①生成使KSCN溶液变为血红色物质的离子方程式___________ ;
②某同学对褪色原因提出假设:
假设1: 被
被 氧化为更高价态;
氧化为更高价态;
假设2:___________ ;
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,___________ (写出操作及现象)说明假设2成立。
 并探究其性质。查阅资料知:
并探究其性质。查阅资料知:i.
 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii.
 有较强的还原性
有较强的还原性
(1)装置A中a的作用是
 的离子方程式为
的离子方程式为(2)上述装置中存在一处缺陷,会干扰
 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是(3)改进实验装置后,B中
 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①生成使KSCN溶液变为血红色物质的离子方程式
②某同学对褪色原因提出假设:
假设1:
 被
被 氧化为更高价态;
氧化为更高价态;假设2:
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,
您最近一年使用:0次
2020-12-31更新
|
136次组卷
|
2卷引用:云南省马关县第一中学校2021-2022学年高一下学期开学考试化学试题
2 . 化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:
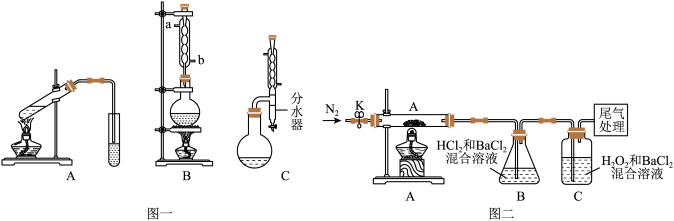
I.图一中A为教材制备乙酸乙酯的实验装置,甲同学认为图一中B装置比A要好,则冷却水应从______ 口进入;乙同学认为图一中C装置效果更好,理由是_______ 。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)[提出猜想]小组同学认为分解产物可能有以下几种情况:
A.Fe2O3、SO2、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO3、SO2、NH3、H2O
根据所学知识,可确定_________ 不成立(填序号)
(2)[药品验纯]甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和_________ 溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加_______ (填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)[实验探究]为检验分解产物,甲同学设计了如下实验装置。
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是________ 。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为________ 。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含______ 。
(4)[实验结论与反思]通过实验现象和认真反思,上述猜想中一定正确的是______ 。(填序号)

I.图一中A为教材制备乙酸乙酯的实验装置,甲同学认为图一中B装置比A要好,则冷却水应从
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)[提出猜想]小组同学认为分解产物可能有以下几种情况:
A.Fe2O3、SO2、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO3、SO2、NH3、H2O
根据所学知识,可确定
(2)[药品验纯]甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和
(3)[实验探究]为检验分解产物,甲同学设计了如下实验装置。
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含
(4)[实验结论与反思]通过实验现象和认真反思,上述猜想中一定正确的是
您最近一年使用:0次
2019-09-29更新
|
186次组卷
|
7卷引用:云南省麻栗坡民族中学2019-2020学年高三上学期期末考试化学试题
3 . 铁在地壳中含量丰富,也是重要的人体微量元素之一、
(1)用铁粉进行如图所示的实验,铁与水蒸气反应的化学方程式为_______ 。
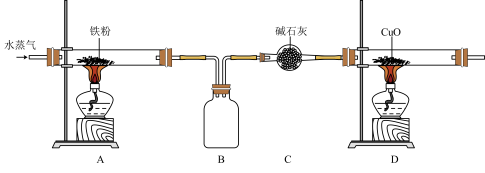
(2)图中盛放碱石灰的仪器名称为_______ ;D装置中观察到的实验现象为_______ 。
(3)从安全角度考虑,实验过程中应先点燃的酒精灯为_______ (填“A”或“D”)。
(4)为了防止缺铁性贫血,一些食品中允许添加含铁物质。某种麦片含有微量的还原铁粉,铁粉在胃酸的作用下会溶解。该溶解过程中的离子方程式为_______ 。
(5)某同学为了进一步确定反应是否发生,对实验后试管内残留黑色固体的成分进行了下列实验探究:已知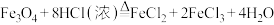 。
。
根据上述实验,他们不能完全确定残留固体的成分,但肯定能确定残留黑色固体中含有的一种物质是_______ ;若②实验中要出现血红色可向烧杯中加入_______ 。
(1)用铁粉进行如图所示的实验,铁与水蒸气反应的化学方程式为

(2)图中盛放碱石灰的仪器名称为
(3)从安全角度考虑,实验过程中应先点燃的酒精灯为
(4)为了防止缺铁性贫血,一些食品中允许添加含铁物质。某种麦片含有微量的还原铁粉,铁粉在胃酸的作用下会溶解。该溶解过程中的离子方程式为
(5)某同学为了进一步确定反应是否发生,对实验后试管内残留黑色固体的成分进行了下列实验探究:已知
 。
。| 实验序号 | 实验操作 | 实验现象 |
| ① | 取少量残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色 |
| ② | 向上述烧杯中滴加几滴KSCN溶液,充分振荡 | 溶液没有出现血红色 |
您最近一年使用:0次
名校
4 . 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
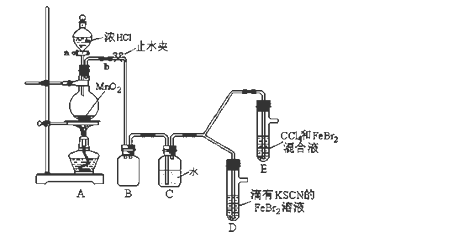
(1)①装置A中发生反应的离子方程式是_____________________ 。
②整套实验装置存在一处明显的不足,请指出_______________________ 。
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化 。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________ ,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________ 溶液,若溶液颜色________ ,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式 (离子或化学方程式不限定)解释产生白色沉淀原因__________________ 、_______________________

(1)①装置A中发生反应的离子方程式是
②整套实验装置存在一处明显的不足,请指出
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由 |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN- Fe(SCN)3 是一个可逆反应。 Fe(SCN)3 是一个可逆反应。ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。 ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 ⅳ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用
您最近一年使用:0次
2016-12-09更新
|
1548次组卷
|
5卷引用:云南省文山州广南一中2019-2020学年高一上学期期中考试化学试题



