名校
解题方法
1 . 某化学实验室产生的废液中含有 Fe3+、Cu2+、Ag+三种金属离子,甲同学设计了如图所示的方案对废液进行处理,以回收金属,下列说法正确的是
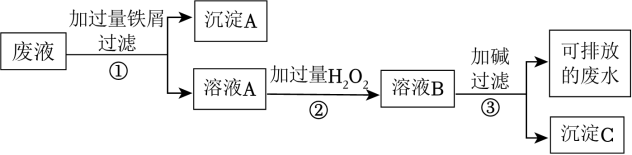

| A.沉淀A中含有2种金属单质 |
| B.可用KSCN溶液来检验溶液B中所含的金属离子 |
| C.溶液A若只经过操作③最终将无法得到沉淀C |
| D.操作①②③中都需要用到玻璃棒、漏斗 |
您最近一年使用:0次
2024-03-19更新
|
116次组卷
|
20卷引用:云南省楚雄天人中学2019-2020学年高一上学期12月月考化学试题
云南省楚雄天人中学2019-2020学年高一上学期12月月考化学试题浙江省温州市新力量联盟2018-2019学年高一上学期期末考试化学试题贵州省思南中学2018-2019学年高一下学期期末考试化学试题江西省上高县第二中学2019-2020学年高一上学期第三次月考化学试题河北省安平中学2019-2020学年高一上学期第四次月考化学试题江苏省盐城市大丰区新丰中学2019-2020学年高一上学期期末考试化学试题河北省保定市涞水波峰中学2019-2020学年高一下学期第三次质检考试化学试题山西省太原市第五中学2020-2021学年高一上学期12月阶段性检测化学试题宁夏石嘴山市第三中学2020-2021学年高一上学期第二次月考化学试题(已下线)【浙江新东方】在线化学 (14)(已下线)练习9 铁的多样性-2020-2021学年【补习教材·寒假作业】高一化学(鲁科版2019)(已下线)【浙江新东方】在线化学33浙江省淳安县汾口中学2020-2021学年高二12月月考化学试题四川师范大学附属中学2020-2021学年高一上学期12月月考化学试题云南省玉溪师范学院附属中学2021-2022学年高一下学期开学测试化学试题湖南省常德市桃源县第一中学2022-2023学年高三上学期9月月考化学试题河北省廊坊市第一中学2022~2023 学年高一上学期期末考试化学试题甘肃省张掖市高台县第一中学2022-2023学年高一下学期开学检测化学试题广东省广州天省实验学校2022-2023学年高一上学期期末考试化学试卷浙江省淳安县汾口中学2023-2024学年高二上学期12月检测化学试题
2 . 某化学兴趣小组对含某些离子(如表)的工业废水进行研究,废水中各离子的物质的量浓度相等,均为 。
。
(1)该溶液为无色溶液,则一定不存在的离子是_______ 。
(2)向废水中加入过量KOH溶液微热,有白色沉淀和无色气体产生,则沉淀是_______ (填化学式,下同),气体是_______ 。
(3)若向废水中加入过量盐酸,会生成遇空气变为红棕色的无色气体和 ,写出生成该无色气体和
,写出生成该无色气体和 的离子方程式:
的离子方程式:_______ 。一定条件下红棕色气体与(2)中产生的气体能反应生成无污染的气体,该反应的化学方程式为_______ 。
(4)向(3)中最后所得的溶液中加入过量的 溶液,充分反应后观察到有白色沉淀产生。
溶液,充分反应后观察到有白色沉淀产生。
①白色沉淀是_______ 。
②_______ (填“能”或“不能”)仅依据该现象判断废水中存在白色沉淀中的阴离子,理由是_______ 。
(5)结合(1)(2)(3),该废水中一定存在的离子是_______ 。
 。
。| 阳离子 |  、 、 、 、 、 、 |
| 阴离子 |  、 、 、 、 、 、 、 、 |
(2)向废水中加入过量KOH溶液微热,有白色沉淀和无色气体产生,则沉淀是
(3)若向废水中加入过量盐酸,会生成遇空气变为红棕色的无色气体和
 ,写出生成该无色气体和
,写出生成该无色气体和 的离子方程式:
的离子方程式:(4)向(3)中最后所得的溶液中加入过量的
 溶液,充分反应后观察到有白色沉淀产生。
溶液,充分反应后观察到有白色沉淀产生。①白色沉淀是
②
(5)结合(1)(2)(3),该废水中一定存在的离子是
您最近一年使用:0次
2023-04-27更新
|
91次组卷
|
2卷引用:云南省楚雄州2022-2023学年高一下学期期中学业质量监测化学试题
解题方法
3 . K3[Fe(C2O4)3]•3H2O(三草酸合铁酸钾)为亮绿色晶体。小李和小赵同学在老师的指导下探究K3[Fe(C2O4)3]•3H2O的热分解产物。
【查阅资料】①碱石灰可用于吸收CO2、水蒸气
②含有Fe2+的盐溶液可与K3[Fe(CN)6]发生反应产生蓝色沉淀
③含有Fe3+的盐溶液可与KSCN发生反应生成红色溶液
【提出问题】样品完全分解后,除水蒸气外还生成哪些产物?
(1)【猜想与假设】猜想一:气体产物中含有CO。
猜想二:气体产物中含有CO2。
猜想三:气体产物中含有______ 。
【实验探究】
(2)探究气体产物。
小李同学对气体产物进行探究,设计如图实验(夹持装置及部分装置省略):

实验中观察到装置B中澄清石灰水变浑浊,装置D中的固体变为红色。由此判断猜想______ 正确。
(3)探究固体产物。
小赵同学对固体产物进行如表探究:取K3[Fe(C2O4)3]•3H2O热分解后的固体产物(经实验证明无磁性物质)于试管中,加水充分溶解、过滤,再进行如表实验:
【实验结论】K3[Fe(C2O4)3]•3H2O的热分解产物有______ 种。
【查阅资料】①碱石灰可用于吸收CO2、水蒸气
②含有Fe2+的盐溶液可与K3[Fe(CN)6]发生反应产生蓝色沉淀
③含有Fe3+的盐溶液可与KSCN发生反应生成红色溶液
【提出问题】样品完全分解后,除水蒸气外还生成哪些产物?
(1)【猜想与假设】猜想一:气体产物中含有CO。
猜想二:气体产物中含有CO2。
猜想三:气体产物中含有
【实验探究】
(2)探究气体产物。
小李同学对气体产物进行探究,设计如图实验(夹持装置及部分装置省略):

实验中观察到装置B中澄清石灰水变浑浊,装置D中的固体变为红色。由此判断猜想
(3)探究固体产物。
小赵同学对固体产物进行如表探究:取K3[Fe(C2O4)3]•3H2O热分解后的固体产物(经实验证明无磁性物质)于试管中,加水充分溶解、过滤,再进行如表实验:
| 实验 | 现象 | 结论 | |
| 取滤液加入硫酸 | ① | 固体中含有K2CO3 | |
| 取滤渣加入硫酸溶解后,分成两份 | 一份中加入K3[Fe(CN)6] | ② | 固体中含有FeO |
| 另一份中加入KSCN | 溶液变为红色 | 固体中含有③ | |
您最近一年使用:0次
4 . 某兴趣小组同学为探究黑木耳中含铁量,进行如下实验。
已知:ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等。每100 g黑木耳含铁量高达185 mg。
ⅱ.紫红色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。
Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下。
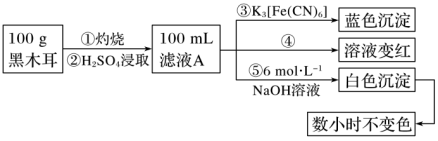
(1)步骤②得到滤液A的操作是___________ 。
(2)步骤④检验Fe3+所用试剂是___________ 溶液。
(3)根据上述实验得出的结论是___________ (填字母)。
a.黑木耳中一定含Fe2+和Fe3+
b.滤液A中一定含Fe2+和Fe3+
c.白色沉淀中一定含Fe(OH)2
Ⅱ.为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
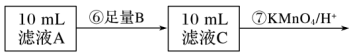
(4)可选做试剂B的物质是___________ (填字母)。
a.Na b.Zn c.Fe d.Cu
(5)步骤⑦中观察到的实验现象是___________ ,反应的离子方程式是___________ 。
(6)若乙同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是___________ 。
已知:ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等。每100 g黑木耳含铁量高达185 mg。
ⅱ.紫红色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。
Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下。

(1)步骤②得到滤液A的操作是
(2)步骤④检验Fe3+所用试剂是
(3)根据上述实验得出的结论是
a.黑木耳中一定含Fe2+和Fe3+
b.滤液A中一定含Fe2+和Fe3+
c.白色沉淀中一定含Fe(OH)2
Ⅱ.为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。

(4)可选做试剂B的物质是
a.Na b.Zn c.Fe d.Cu
(5)步骤⑦中观察到的实验现象是
(6)若乙同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是
您最近一年使用:0次
2022-03-31更新
|
198次组卷
|
5卷引用:云南省楚雄州民族中学2021-2022学年高一下学期2月开学考试化学试题
名校
5 . 下列除杂试剂选用正确且除杂过程中不涉及氧化还原反应的是
| 选项 | 物质(括号内为杂质) | 除杂试剂 |
| A | Fe(Al) | NaOH溶液 |
| B |  ( ( ) ) | 稀硫酸 |
| C | NaCl溶液( ) ) | NaOH溶液、稀盐酸 |
| D |  溶液( 溶液( ) ) | Cu粉 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-19更新
|
441次组卷
|
13卷引用:云南省楚雄州2021-2022学年高一上学期期末教育学业质量监测化学试题
云南省楚雄州2021-2022学年高一上学期期末教育学业质量监测化学试题山西省吕梁市2021-2022学年高一上学期期末考试化学试题广东省名校联盟2021-2022学年高一上学期期末考试化学试题河北省秦皇岛市2021-2022学年高一上学期期末统一考试化学试题河北省廊坊市2021-2022学年高一上学期期末统一考试化学试题湖南省长沙市实验中学2021-2022学年高一下学期入学考试化学试题宁夏银川唐徕回民中学2021-2022学年高一下学期3月月考化学试题湖南省衡阳市祁东县2021-2022学年高一上学期期末考试化学试题重庆市三峡名校联盟2022-2023学年高一上学期联考化学试题广东省江门市第一中学2022-2023学年高一上学期期末考试化学试题江西省湖口中学2022-2023学年高一下学期5月期中考试化学试题广东省佛山市三水中学2022-2023学年高一上学期第二次统测化学试题河北省秦皇岛市青龙满族自治县实验中学2022-2023学年高一上学期期末考试化学试题
10-11高一上·河南周口·期中
名校
解题方法
6 . 下列化合物中,不能通过两种单质间化合直接制取的是
| A.FeCl3 | B.CuCl2 | C.HCl | D.FeCl2 |
您最近一年使用:0次
2021-09-12更新
|
1399次组卷
|
61卷引用:云南省楚雄市楚雄实验中学2019--2020学年高一上学期期末检测化学试题
云南省楚雄市楚雄实验中学2019--2020学年高一上学期期末检测化学试题(已下线)2010年河南省周口市高一上学期期中考试化学卷(已下线)2012-2013学年陕西省宝鸡中学高一上学期期末考试化学试卷(已下线)2012-2013年福建省清流一中高一上学期第二阶段考试化学试卷(已下线)2012-2013学年甘肃省兰州五十五中高一上学期期末考试化学试卷(已下线)2014-2015学年福建省三明一中高一上学期期中化学试卷2015-2016学年吉林省长春外国语学校高一上期末化学试卷2015-2016学年河北石家庄一中高一下学情反馈一化学卷2017届河北省故城县高级中学高三上学期第一次月考化学试卷2016-2017学年福建省三明市清流一中高一上期中化学试卷2016-2017学年甘肃省武威市第十八中学高一下学期第一次月考化学试卷西藏山南地区第二高级中学2016-2017学年高一下学期期中考试化学试题山西省忻州市第一中学2016-2017学年高一必修一:4.2.1 富集在海水中的元素-氯同步练习化学试题河北省大名县第一中学2018届高三(普通班)上学期第一次月考化学试题山东省枣庄市第三中学2017-2018学年高一10月学情调研化学试题山东省枣庄市第八中学东校区2017-2018学年高一10月月考化学试题山东省枣庄市第八中学东校区2017-2018学年高一上学期10月月考化学试题福建省三明市三地三校2017-2018学年高一上学期期中联考化学试题山东省桓台第二中学2017-2018学年高一4月月考化学试题(已下线)【走进新高考】(人教版必修一)4.2.1富集在海水中的元素——氯 (氯气) 同步练习01【全国百强校】吉林省长春市外国语学校2018-2019学年高一下学期期中考试化学试题第1课时 研究物质性质的基本程序练习河南省周口中英文学校2020届高三上学期期中考试化学试题福建省厦门集美中学2017-2018学年高一上学期期中考试化学试题山东省淄博市淄川区般阳中学2019-2020学年高一上学期期中考试化学试题沪科版化学拓展性课程5《非金属元素》测试题人教版(2019)高一必修第一册第二章 海水中的重要元素 第二节 氯及其化合物 课时1 氯气的性质上海市延安中学2019-2020学年高一上学期期中考化学试题高一必修第一册(苏教2019版)专题3 第一单元 氯气及氯的化合物 课时2 氯气的性质及应用湖北省沙市中学2020-2021学年高一上学期期中考试化学(选考)试题(已下线)【浙江新东方】双师 (55)河南省新乡市长垣市第十中学2020-2021学年高一上学期期中考试化学试题河北省石家庄市第二中学西校区2020-2021学年高一上学期12月月考化学试卷黑龙江农垦建三江管理局第一高级中学2020-2021学年高一上学期12月月考化学试题(已下线)练习13 铁铜的获取和应用-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)海南省东方市八所中学2020-2021学年高一上学期期中考试化学试题天津市第二中学2020-2021学年高一下学期2月开学考试化学试题四川省自贡市2020-2021学年高一下学期期末考试化学试题(已下线)第9讲 卤素-2020-2021学年秋季班高一上学期化学教材知识点精讲练(沪科版)石家庄市第十五中学2020-2021学年高一上学期期中考试化学试题(已下线)专题六 铁及其化合物(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)黑龙江省双鸭山市第一中学2020-2021学年高一第二次月考化学试题浙江省浦江县建华中学2022届高三上学期第一次月考化学试题 河南省南阳市南召现代中学2021-2022学年高一上学期第一次月考化学试题广东省惠州市2021-2022学年高一上学期期末质量检测化学试题黑龙江省大庆市大庆中学2021-2022学年高一下学期开学考试化学试题甘肃省永昌县第一高级中学2021-2022学年高一上学期期末补考化学试题 黑龙江省饶河县高级中学2021-2022学年高一上学期第二次月考化学试题湖南省郴州市2021~2022学年高一上学期期末教学质量检测化学试题北京市丰台区2022-2023学年高一上学期期中考试化学(B卷)试题河北省石家庄市第十五中学2022-2023学年高一上学期期中考试化学试题山东省滨州高新高级中学2022-2023学年高一10月月考化学试题山东省滨州高新高级中学2022-2023学年高一上学期期中考试(3-10班)化学试题山东省滨州高新高级中学2021-2022学年高一上学期期中考试化学试题(A)广西南宁市第五十六中学2021-2022学年高一上学期期中考试化学试题广东省惠州市丰湖高级中学2022-2023学年高一上学期期中考试化学试题广东省惠州市龙门县高级中学2021-2022学年高一下学期开学测试化学试题四川省泸州市泸县2022-2023学年高一下学期开学考试化学试题浙江省杭州东方中学2023-2024学年高一上学期期中考试化学试题浙江省杭州第十一中学2023-2024学年高一上学期期中考试化学试题安徽省蚌埠市五河致远实验学校 固镇县汉兴学校联考2023-2024学年高一上学期10月月考化学试题
解题方法
7 . 由硫铁矿“烧渣”(主要成分:Fe3O4、Fe2O3和FeO)制备绿矾(FeSO4·7H2O)的流程如图:已知:FeS2(S的化合价为-1)难溶于水。

(1)①中加入的酸为_______ ,滤渣2的主要成分是_______ 。
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、_______ 。
(3)检验②中Fe3+已经完全转化成Fe2+的实验方法:取适量溶液2,_______ 。
(4) 通过③得到绿矾晶体的实验操作:_______ 、_______ 、_______ 、_______ 、_______ 。

(1)①中加入的酸为
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、
(3)检验②中Fe3+已经完全转化成Fe2+的实验方法:取适量溶液2,
(4) 通过③得到绿矾晶体的实验操作:
您最近一年使用:0次
8 . 下列有关物质的性质与用途具有对应关系的是
| A.NH4HCO3受热易分解,可用作化肥 | B.NH3易溶于水,可用作制冷剂 |
| C.SO2具有氧化性,可用于纸浆漂白 | D.稀硫酸具有酸性,可用于除去铁锈 |
您最近一年使用:0次
名校
9 . 向稀硝酸和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体,该气体遇空气变成红棕色,溶液中Fe2+的物质的量和加入铁粉的物质的量之间的关系如图所示:则原混合溶液中HNO3和Fe(NO3)3的物质的量浓度之比为
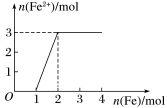

| A.2∶1 | B.1∶1 | C.4∶1 | D.3∶1 |
您最近一年使用:0次
2021-04-19更新
|
490次组卷
|
13卷引用:云南省楚雄彝族自治州民族中学2021-2022学年高一下学期3月月考化学试题
云南省楚雄彝族自治州民族中学2021-2022学年高一下学期3月月考化学试题辽宁省大连市普兰店区第二中学2017-2018学年高一上学期期末考试化学试题福建省晋江市季延中学2017-2018学年高一下学期期末考试化学试题鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第3节 氮的循环 综合训练高一必修第二册(人教2019版)第五章 第二节 氮及其化合物 综合训练江西省南昌市第十中学2020-2021学年高一下学期第一次月考化学试题安徽省淮北市第一中学2020-2021学年高一下学期第二次月考化学试题山西省太原师范学院附属中学、太原市师苑中学校2021-2022学年高一下学期3月月考化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021-2022学年高一下学期第一次线上测试化学试题河南省安阳市中原名校2021-2022学年高一下学期第三次联考化学试题河南省新蔡县四校联考2021-2022学年高三上学期调研考试化学试题山东省潍坊高密市第三中学2022-2023学年高三上学期9月月考化学试题河南省郑州外国语学校2022-2023学年高一下学期第一次月考化学试题
10-11高三上·吉林长春·期中
名校
解题方法
10 . 把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的溶度恰好相等,则未反应的Fe3+和已反应的Fe3+的物质的量的比为
| A.1∶1 | B.1∶2 | C.3∶2 | D.2∶3 |
您最近一年使用:0次
2021-04-15更新
|
1217次组卷
|
85卷引用:云南省楚雄中学2020-2021学年高一下学期4月月考化学试题
云南省楚雄中学2020-2021学年高一下学期4月月考化学试题(已下线)吉林省长春市十一高中2010-2011学年度高三上学期期中考(已下线)2011届陕西省西安交大阳光中学高三上学期期中考试化学卷(已下线)2010年福建省三明一中高一上学期期中考试化学卷(已下线)2010年上海市吴淞中学高二上学期期中考试化学试卷(已下线)2010—2011学年海南省洋浦中学高一上学期期末考试化学试卷(已下线)2011-2012学年甘肃省武威第五中学高一期末考试化学试卷(已下线)2011-2012学年江西省赣州市信丰县信丰中学高一第二次月考化学试卷(已下线)2011-2012学年甘肃省白银市平川中恒学校高一上学期期末考试化学试卷(已下线)2011-2012学年吉林省长春外国语学校高一上学期期末考试文科化学试卷(已下线)2011-2012学年吉林省长春市十一高中高一上学期期末考试化学试卷(已下线)2011—2012学年海南省洋浦中学高一第一学期期末考试化学试卷(已下线)2011-2012学年云南省玉溪一中高一下学期期中考试化学试卷(已下线)2012-2013学年福建省福清东张中学高一上学期期末考试化学试卷(已下线)2012-2013学年陕西省宝鸡中学高一上学期期末考试化学试卷(已下线)2013-2014学年福建省厦门市高一上学期期末质量检测模拟化学试卷(已下线)2013-2014学年北京市西城区高一上学期期末考试化学试卷(已下线)2012-2013湖北省孝感高中高一上学期期末考试化学试卷(已下线)2014-2015江苏省宿迁市五校高一上学期期中联考化学试卷2014-2015辽宁省大连市第二十高中高一上学期期末化学试卷2014-2015江苏省涟水中学高一12月月考化学试卷2014-2015陕西省西安市一中高一上学期期末化学试卷2014-2015四川省乐山市高一年级上学期期末考试化学试卷2015-2016学年北大附中河南分校高一上9月考化学试卷2015-2016学年河北省永年二中高一上学期12月月考化学试卷2015-2016学年四川阆中中学校高一上第二次段考化学试卷2015-2016学年陕西省西安一中高一上12月月考化学试卷2015-2016学年湖北省宜昌市部分示范高中高一上期末联考化学试卷2016-2017学年浙江省余姚中学高一上期中化学试卷2016-2017学年山东省枣庄八中高一12月月考化学卷重庆市第一中学2016-2017学年高一上学期期末考试化学试题2016-2017学年江西省南昌市第十中学高一上学期期末考试化学试卷云南省峨山彝族自治县第一中学2016-2017学年高二下学期期末考试化学试题山西省忻州市第一中学2016-2017学年高一必修一:3.2.3几种重要的金属化合物同步练习化学试题黑龙江省牡丹江市第一高级中学2017-2018学年高二10月月考(文)化学试题江苏省东台市创新学校2018届高三10月月考化学试题甘肃省甘谷县第一中学2017-2018学年高一上学期第二次月考化学试题上海杨浦高级中学2017-2018学年高二上学期12月月考化学试题湖北省宜昌市长阳县第一高级中学2017-2018学年高一12月月考化学试题山西省太原市成成中学校2017-2018学年高一12月月考化学试题宁夏育才中学2017-2018学年高一上学期期末考试化学试题新疆昌吉市2017-2018学年高一上学期期末考试化学试题天津市和平区2017-2018学年高一上学期期末考试化学试题江西省临川实验学校2017-2018学年高一上学期期末质量检测化学试题云南省玉溪第一中学2017-2018学年高一上学期期末考试化学试题河南省开封市兰考县第三高级中学2017-2018学年高一上学期期末考试化学试卷陕西省黄陵中学2017-2018学年高一(普通班)下学期开学考试化学试题2018-2019学年苏教版高中化学必修一 专题综合测评3【全国百强校】山东省泰安市第一中学2018-2019学年高一上学期期中考试化学试题【全国百强校】甘肃省兰州市第一中学2018-2019学年高一上学期12月月考化学试题山西省忻州市实验中学2018-2019学年高一上学期第三次教学质量检测化学试题河南省封丘县一中2018-2019学年高一上学期12月月考化学试题山东省泰安市宁阳一中2018-2019学年高一上学期阶段性考试二(12月)化学试题山西省晋中市平遥县第二中学2018-2019学年高一上学期12月月考化学试题河南省永城市实验高级中学2019届高三上学期期中考试化学试题甘肃省白银市会宁县第一中学2018届高三上学期期中考试化学试题吉林省白城市通榆县第一中学2020届高三上学期第二次月考化学试题山西省晋中市平遥县第二中学2019-2020学年高一12月月考化学试题四川省三台中学2019-2020学年高一上学期第三次月考化学试题云南省兰坪县第一中学2019-2020学年高一上学期期末考试化学试题陕西省西安中学2019-2020学年高一上学期期末考试化学试题鲁科版高中化学必修1第二章《元素与物质世界》测试卷广东省梅州市蕉岭县蕉岭中学2019—2020学年高一上学期期末考试化学试题四川省眉山市2019-2020学年高一上学期期末教学质量检测化学试题湖北省荆州市2019-2020学年高一上学期期末考试化学试题上海市闵行区向明世博中学2018-2019学年高二上学期期中考试化学试题河南省焦作市沁阳市第一中学2019-2020学年高一上学期12月月考化学试题陕西省咸阳市实验中学2019-2020学年高一上学期第三次月考化学试题山东省枣庄市2019-2020学年高一下学期期末考试化学试题(已下线)3.1.1 铁及其化合物练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)第03章 铁 金属材料(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)人教版(2019)高一必修第一册 第三章 第一节 铁及其化合物鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第1节 铁的多样性重庆市铜梁中学校等七校2019-2020学年高一上学期期末联考化学试题高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 教材帮(已下线)3.1.1 铁的单质-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)宁夏石嘴山市平罗中学2020-2021学年高一上学期第三次月考化学试题甘肃省兰州市第一中学2020-2021学年高一上学期期末考试化学(文)试题湖南省常德市石门县第六中学2019-2020学年高一下学期第三次月考化学试题云南省梁河县第一中学2020-2021学年高一上学期第二次月考化学试题宁夏固原市隆德县2020-2021学年高一上学期期末考试化学试题广西南宁市邕宁高中2020-2021学年高一上学期期末考试化学试题江西省抚州市金溪县第一中学2020-2021学年高一上学期第二次月考化学试题甘肃省武威市民勤县第四中学2020-2021学年高一下学期第一次月考化学(实验班)试题(已下线)专题08 铁及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练



