名校
1 . 软锰矿浆(主要成分 )可吸收烟气中的
)可吸收烟气中的 ,同时可制备
,同时可制备 ,工艺流程如下:
,工艺流程如下: 后的软锰矿浆中含有
后的软锰矿浆中含有 等阳离子:
等阳离子:
②金属离子沉淀的 如下表
如下表
(1)脱硫的产物是 ,软锰矿中
,软锰矿中 所起的作用是
所起的作用是___________ 。
(2)过程1向浆液中通入 的目的是
的目的是___________ 。
(3)滤渣1的成分是___________ ,过程2中发生反应的离子方程式为___________ 。
(4)写出制备 时发生反应的离子方程式
时发生反应的离子方程式___________ 。
(5)取 碳酸锰样品,加适量硫酸加热溶解后,用
碳酸锰样品,加适量硫酸加热溶解后,用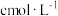 的
的 溶液测定,至反应完全时,消耗
溶液测定,至反应完全时,消耗 溶液的体积为
溶液的体积为 。 (已知:反应产物为
。 (已知:反应产物为 ,杂质不参与反应)
,杂质不参与反应)
样品中 质量分数的计算式为
质量分数的计算式为___________  。
。
 )可吸收烟气中的
)可吸收烟气中的 ,同时可制备
,同时可制备 ,工艺流程如下:
,工艺流程如下:
 后的软锰矿浆中含有
后的软锰矿浆中含有 等阳离子:
等阳离子:②金属离子沉淀的
 如下表
如下表| 金属离子 |  |  |  |  |  |
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 | 6.2 |
沉淀完全的 | 10.1 | 8.3 | 2.8 | 4.7 | 8.2 |
(1)脱硫的产物是
 ,软锰矿中
,软锰矿中 所起的作用是
所起的作用是(2)过程1向浆液中通入
 的目的是
的目的是(3)滤渣1的成分是
(4)写出制备
 时发生反应的离子方程式
时发生反应的离子方程式(5)取
 碳酸锰样品,加适量硫酸加热溶解后,用
碳酸锰样品,加适量硫酸加热溶解后,用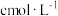 的
的 溶液测定,至反应完全时,消耗
溶液测定,至反应完全时,消耗 溶液的体积为
溶液的体积为 。 (已知:反应产物为
。 (已知:反应产物为 ,杂质不参与反应)
,杂质不参与反应)样品中
 质量分数的计算式为
质量分数的计算式为 。
。
您最近一年使用:0次
名校
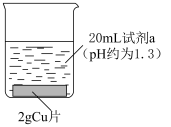
2 . 为了检验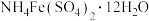 晶体中的离子,下列实验操作及结论正确的是
晶体中的离子,下列实验操作及结论正确的是
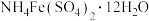 晶体中的离子,下列实验操作及结论正确的是
晶体中的离子,下列实验操作及结论正确的是A.取少量样品放入试管中,加入 溶液,将湿润的红色石蕊试纸粘在试管口,试纸变蓝,证明晶体中含有 溶液,将湿润的红色石蕊试纸粘在试管口,试纸变蓝,证明晶体中含有 |
B.取少量样品溶于水,向溶液中滴入几滴新制氯水,再滴入2滴 溶液,溶液变为红色,证明晶体中含有 溶液,溶液变为红色,证明晶体中含有 |
C.取少量样品溶于水,加少量稀盐酸,无现象,再滴入几滴 溶液,有白色沉淀生成,证明晶体中含有 溶液,有白色沉淀生成,证明晶体中含有 |
D.取少量样品溶于水,滴加 溶液,溶液变红,证明晶体中含有 溶液,溶液变红,证明晶体中含有 |
您最近一年使用:0次
解题方法
3 . 下列过程与氧化还原反应有关的是
A.用 去除废水中的 去除废水中的 | B.用 净水 净水 |
C.用 对自来水消毒 对自来水消毒 | D.由海水制取蒸馏水 |
您最近一年使用:0次
名校
4 . 下列“实验结论”与“实验操作及现象”相符的一组是
| 实验操作及现象 | 实验结论 | |
| A | 向某溶液中加入赤血盐溶液,有蓝色沉淀生成 | 该溶液中一定含有Fe2+ |
| B | 向某溶液中加入氢氧化钠溶液,有白色沉淀生成 | 该溶液中一定含有Al3+ |
| C | 向某溶液中滴加KSCN溶液,溶液变红 | 该溶液中一定有Fe3+、无Fe2+ |
| D | 常温下,把光洁的铁钉放入浓硝酸中,无明显现象 | 铁与浓硝酸不反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 下列实验过程中的颜色变化,与氧化还原反应无关的是
| A.向FeSO4溶液中加入NaOH溶液,先产生白色沉淀,然后迅速变成灰绿色,最后变成红褐色 |
| B.向NaBr溶液中滴入少量氯水,溶液变为黄色 |
| C.向CuSO4溶液中逐滴加入氨水,先有蓝色沉淀生成,后沉淀溶解得到深蓝色的溶液 |
| D.将FeCl3溶液滴在淀粉—KI试纸上,试纸变蓝 |
您最近一年使用:0次
名校
解题方法
6 . 下列反应的离子方程式书写正确的是
A.氯化铝与过量氨水反应:Al3++4NH3·H2O=[Al(OH)4]-+4 |
| B.用盐酸溶解氢氧化镁:H++OH-=H2O |
| C.用FeCl3溶液腐蚀覆铜板:2Fe3++3Cu=2Fe+3Cu2+ |
D.过量的CO2通入NaAlO2溶液中发生反应:CO2+ +2H2O=Al(OH)3↓+ +2H2O=Al(OH)3↓+ |
您最近一年使用:0次
名校
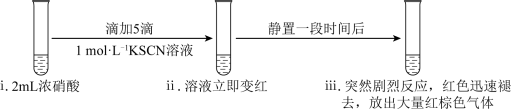
7 . 某化学兴趣小组研究浓硝酸与KSCN溶液的反应。
资料:Ⅰ.SCN‒中S、C、N元素的化合价依次为:-2价、+4价、-3价。
Ⅱ.SCN‒的性质类似卤素离子,能被氧化为(SCN)2,(SCN)2可聚合为红色的(SCN)x。
Ⅲ.NO2可溶于浓硝酸。
(1)实验一:___________ (填化学式)。
(2)实验二:研究SCN‒的转化产物。
a.将实验一ⅲ中的气体通入Ba(OH)2和NaOH的混合溶液中,有白色沉淀生成。
b.过滤、洗涤白色沉淀,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色。
c.另取少量实验一ⅲ中试管内的溶液加入BaCl2溶液,产生大量白色沉淀。
①甲同学根据实验一iii的现象推断SCN‒的氧化产物中一定有NO2,乙同学认为证据不足,理由是___________ 。
②通过b证实了红棕色气体中不含SO2,证据是___________ 。
③由上述实验现象可知:SCN‒转化的最终产物中一定有___________ 。
(3)实验三:研究实验一ⅲ中“静置一段时间后,突然剧烈反应,红色迅速褪去”的原因。丙同学设计了实验三,与实验一进行对比,证实了一定浓度的NO2能加快浓硝酸氧化(SCN)x的化学反应速率。
实验三:___________ 。
②操作2是___________ 。
资料:Ⅰ.SCN‒中S、C、N元素的化合价依次为:-2价、+4价、-3价。
Ⅱ.SCN‒的性质类似卤素离子,能被氧化为(SCN)2,(SCN)2可聚合为红色的(SCN)x。
Ⅲ.NO2可溶于浓硝酸。
(1)实验一:
(2)实验二:研究SCN‒的转化产物。
a.将实验一ⅲ中的气体通入Ba(OH)2和NaOH的混合溶液中,有白色沉淀生成。
b.过滤、洗涤白色沉淀,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色。
c.另取少量实验一ⅲ中试管内的溶液加入BaCl2溶液,产生大量白色沉淀。
①甲同学根据实验一iii的现象推断SCN‒的氧化产物中一定有NO2,乙同学认为证据不足,理由是
②通过b证实了红棕色气体中不含SO2,证据是
③由上述实验现象可知:SCN‒转化的最终产物中一定有
(3)实验三:研究实验一ⅲ中“静置一段时间后,突然剧烈反应,红色迅速褪去”的原因。丙同学设计了实验三,与实验一进行对比,证实了一定浓度的NO2能加快浓硝酸氧化(SCN)x的化学反应速率。
实验三:
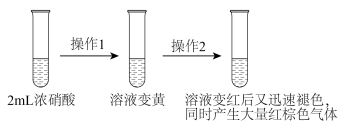
②操作2是
您最近一年使用:0次
8 . 下列依据实验现象得到的结论正确的是
| 选项 | 实验 | 实验现象 | 结论 |
| A | 将稀硫酸加入铁粉中,再滴加 溶液 溶液 | 溶液呈红色 | 稀硫酸将 氧化为 氧化为 |
 | 将铜粉加入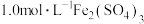 溶液中 溶液中 | 溶液变蓝 | 金属铁比铜活泼 |
| C | 加热盛有少量 固体的试管,并在试管口放置湿润的红色石蕊试纸 固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 |  显碱性 显碱性 |
| D | 向两支盛有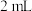 相同浓度的银氨溶液的试管中分别加入2滴相同浓度的 相同浓度的银氨溶液的试管中分别加入2滴相同浓度的 和 和 溶液 溶液 | 一支试管中产生黄色沉淀,另一支中无明显现象 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
9 . 某研究小组探究Fe3+盐溶液与Cu的反应,进行了如下实验。
资料:i.CuCl、CuSCN是难溶于水的白色固体;
ii.Fe2+ + NO⇌[Fe(NO)]2+ (棕色)。
(1)用化学用语解释Fe3+盐溶液显酸性的原因___________ 。
(2)实验I中发生反应的离子方程式为___________ 。
(3)小组同学取2 mL实验I中反应2天后的溶液于试管中,加入2滴1 mol·L-1 KSCN溶液,观察到溶液迅速变红,产生大量白色沉淀。
甲同学猜想Fe2+可能在该条件下被Cu2+氧化了。
①用离子方程式表示甲同学的猜想___________ 。
②甲同学通过实验证实了其猜想,实验方案是___________ 。
(4)对比实验I和实验Ⅱ,小组同学推测Cl-可以催化Fe3+与Cu反应。其理由是___________ 。
(5)实验Ⅱ中产生大量红褐色沉淀的原因是___________ 。
(6)实验Ⅲ所得溶液的颜色不是蓝色,小组同学猜测反应中生成了[Fe(NO)]2+,设计并实施了以下实验,验证了其猜想。
试剂X是___________ 。
综合以上实验,Fe3+盐溶液与Cu反应的多样性与阴离子种类、生成物存在形式等有关。
| 实验装置 | 序号 | 试剂a | 实验现象 |
| I | 0.25 mol·L-1Fe2(SO4)3溶液 | 溶液逐渐变为蓝色。2天后,Cu片有较大量剩余,溶液仍为蓝色 |
| Ⅱ | 0.5 mol·L-1FeCl3溶液 | 溶液逐渐变为蓝绿色,铜片表面覆盖有白色固体(经检验为CuCl)。2天后,白色固体消失,Cu片无剩余,溶液中产生大量红褐色沉淀 | |
| Ⅲ | 0.5 mol·L-1 Fe(NO3)3溶液 | 溶液逐渐变为绿色,实验过程中未见气泡产生。 2天后,Cu片少量剩余,溶液中产生大量红褐色沉淀 |
ii.Fe2+ + NO⇌[Fe(NO)]2+ (棕色)。
(1)用化学用语解释Fe3+盐溶液显酸性的原因
(2)实验I中发生反应的离子方程式为
(3)小组同学取2 mL实验I中反应2天后的溶液于试管中,加入2滴1 mol·L-1 KSCN溶液,观察到溶液迅速变红,产生大量白色沉淀。
甲同学猜想Fe2+可能在该条件下被Cu2+氧化了。
①用离子方程式表示甲同学的猜想
②甲同学通过实验证实了其猜想,实验方案是
(4)对比实验I和实验Ⅱ,小组同学推测Cl-可以催化Fe3+与Cu反应。其理由是
(5)实验Ⅱ中产生大量红褐色沉淀的原因是
(6)实验Ⅲ所得溶液的颜色不是蓝色,小组同学猜测反应中生成了[Fe(NO)]2+,设计并实施了以下实验,验证了其猜想。
| 步骤 | 实验操作 | 实验现象 |
| ① | 向盛有2 g金属Cu片的烧杯中加入试剂X | 2天后溶液颜色无明显变化,铜片表面有细小气泡附着 |
| ② | 继续加入少量FeSO4固体 | 溶液迅速变为浅棕色 |
综合以上实验,Fe3+盐溶液与Cu反应的多样性与阴离子种类、生成物存在形式等有关。
您最近一年使用:0次
2024-04-01更新
|
279次组卷
|
2卷引用:北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题
10 . Fe3O4呈黑色,有磁性,应用广泛。以Fe3O4为吸附剂去除水中含磷物质是一种新的除磷措施。请回答下列问题:
(1)检验Fe3O4中铁元素的价态:用盐酸溶解Fe3O4,再进行下列步骤:
①取少量溶液滴加KSCN溶液,溶液变_____ (填“红色”或“淡蓝色”),则证明Fe3O4中含有_____ 价的铁元素。
②另取少量溶液滴加K3[Fe(CN)6]溶液,产生化学式Fe3[Fe(CN)6]2的蓝色沉淀。则证明Fe3O4中含有_____ 价的铁元素。
(2)Fe3O4制备方法有多种,下面用氧化—沉淀法制备Fe3O4:
①向稀硫酸中加入过量铁粉,得到FeSO4溶液。空气中存在O2,由于_____ (用离子方程式表示),可产生Fe3+。过量铁粉的作用是除去Fe3+;
②在N2保护下,向热NaOH溶液中加入FeSO4溶液,搅拌,得到Fe(OH)2浊液。将NaNO3溶液滴入浊液中,充分反应得到Fe3O4.,用湿润红色石蕊试纸检验产物,试纸变_____ (填“红色”或“蓝色”),证明生成了NH3,发生的反应离子方程式为:12Fe(OH)2+ =4Fe3O4+NH3↑+X+10H2O,则X的化学式为
=4Fe3O4+NH3↑+X+10H2O,则X的化学式为_____ 。
(3)含磷各微粒在溶液中的物质的量分数与pH的关系如下图1所示。下列分析正确的是_____ 。
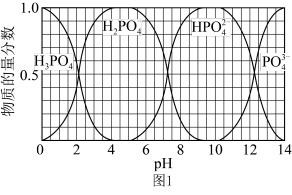
A.KH2PO4的水溶液中:c(H+)>c(OH-)
B.K2HPO4溶液显碱性
C.H3PO4是强电解质,在溶液中完全电离
(4)将Fe3O4加到KH2PO4溶液中,调节溶液的pH。Fe3O4由于异种电荷吸附而去除水中含磷物种,pH对吸附剂表面所带电荷的影响:pH<6.8,Fe3O4表面带正电荷;pH=6.8,Fe3O4表面不带电荷;pH>6.8,Fe3O4表面带负电荷。Fe3O4对含磷微粒的去除率随pH的变化如图2.则:

①pH=4~5时,吸附的主要微粒是_____ 。
②去除率的大小与吸附剂和含磷的主要微粒之间的静电排斥作用有关。与pH=5时相比,pH=9时的去除率明显下降,说明吸附剂和含磷的主要微粒之间的静电排斥作用:pH=9时_____ (填“强于”或“弱于”pH=5时)
(1)检验Fe3O4中铁元素的价态:用盐酸溶解Fe3O4,再进行下列步骤:
①取少量溶液滴加KSCN溶液,溶液变
②另取少量溶液滴加K3[Fe(CN)6]溶液,产生化学式Fe3[Fe(CN)6]2的蓝色沉淀。则证明Fe3O4中含有
(2)Fe3O4制备方法有多种,下面用氧化—沉淀法制备Fe3O4:
①向稀硫酸中加入过量铁粉,得到FeSO4溶液。空气中存在O2,由于
②在N2保护下,向热NaOH溶液中加入FeSO4溶液,搅拌,得到Fe(OH)2浊液。将NaNO3溶液滴入浊液中,充分反应得到Fe3O4.,用湿润红色石蕊试纸检验产物,试纸变
 =4Fe3O4+NH3↑+X+10H2O,则X的化学式为
=4Fe3O4+NH3↑+X+10H2O,则X的化学式为(3)含磷各微粒在溶液中的物质的量分数与pH的关系如下图1所示。下列分析正确的是

A.KH2PO4的水溶液中:c(H+)>c(OH-)
B.K2HPO4溶液显碱性
C.H3PO4是强电解质,在溶液中完全电离
(4)将Fe3O4加到KH2PO4溶液中,调节溶液的pH。Fe3O4由于异种电荷吸附而去除水中含磷物种,pH对吸附剂表面所带电荷的影响:pH<6.8,Fe3O4表面带正电荷;pH=6.8,Fe3O4表面不带电荷;pH>6.8,Fe3O4表面带负电荷。Fe3O4对含磷微粒的去除率随pH的变化如图2.则:

①pH=4~5时,吸附的主要微粒是
②去除率的大小与吸附剂和含磷的主要微粒之间的静电排斥作用有关。与pH=5时相比,pH=9时的去除率明显下降,说明吸附剂和含磷的主要微粒之间的静电排斥作用:pH=9时
您最近一年使用:0次