名校
1 . 绿矾 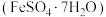 是自然界存在的一种矿石, 翠绿如宝石,很早就引起人们的重视。 已知:
是自然界存在的一种矿石, 翠绿如宝石,很早就引起人们的重视。 已知: 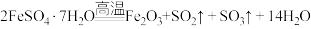 。某研究性学习小组用如图所示装置对绿矾进行培烧,并检验其培烧产物。请回答下列问题:
。某研究性学习小组用如图所示装置对绿矾进行培烧,并检验其培烧产物。请回答下列问题:___________ 作用是___________ ,若盛放的是无水硫酸铜现象是___________ 。
(2)装置 D 可以观察到的实验现象是___________ 。
(3)装置E的作用是除去多余的SO2,请写出该反应的离子方程式___________ 。
(4)实验结束后,请设计一个实验方案,检验装置A 中生成的固体产物(不考虑其他反应)___________ 。
(5)下列说法正确的是___________。
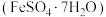 是自然界存在的一种矿石, 翠绿如宝石,很早就引起人们的重视。 已知:
是自然界存在的一种矿石, 翠绿如宝石,很早就引起人们的重视。 已知: 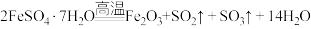 。某研究性学习小组用如图所示装置对绿矾进行培烧,并检验其培烧产物。请回答下列问题:
。某研究性学习小组用如图所示装置对绿矾进行培烧,并检验其培烧产物。请回答下列问题: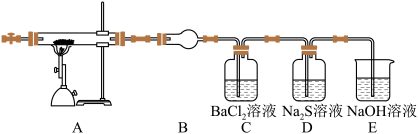
(2)装置 D 可以观察到的实验现象是
(3)装置E的作用是除去多余的SO2,请写出该反应的离子方程式
(4)实验结束后,请设计一个实验方案,检验装置A 中生成的固体产物(不考虑其他反应)
(5)下列说法正确的是___________。
A.装置C的作用是检验并吸收  |
B.为了让实验结果更准确,实验开始前应先通一段时间的  , 以排尽装置中的空气 , 以排尽装置中的空气 |
| C.实验操作的顺序为:先组装装置,然后加入各种试剂,再检查气密性,最后点燃酒精喷灯开始实验 |
D.若要除去  溶液中混有的 溶液中混有的  杂质,可向溶液中加入过量的铜粉,充分反应后,过滤即可 杂质,可向溶液中加入过量的铜粉,充分反应后,过滤即可 |
您最近一年使用:0次
解题方法
2 . 已知物质A~H之间存在如图所示转化关系:
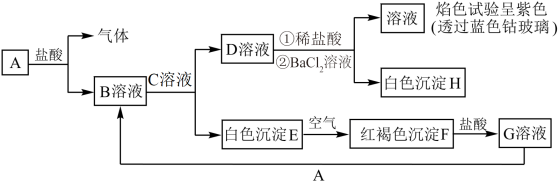
回答下列问题:
(1)D溶液为________ (填化学式)溶液。
(2)检验G溶液中是否含有B溶液中金属阳离子可以用酸性高锰酸钾溶液,写出溶液B中金属阳离子与酸性高锰酸钾溶液反应的离子方程式:________ (已知:酸性条件下高锰酸钾被还原为 )。
)。
(3)G溶液能否用铜制容器盛放,理由是________ 。
(4)白色沉淀E变为红褐色沉淀F时反应的化学方程式为________ 。
(5)下列物质不可以通过化合反应制得的是________ (填字母)。
a.物质B b.物质C c.物质F d.物质G
(6)制备溶液B时一般会加入稍过量的A,其目的是________ 。

回答下列问题:
(1)D溶液为
(2)检验G溶液中是否含有B溶液中金属阳离子可以用酸性高锰酸钾溶液,写出溶液B中金属阳离子与酸性高锰酸钾溶液反应的离子方程式:
 )。
)。(3)G溶液能否用铜制容器盛放,理由是
(4)白色沉淀E变为红褐色沉淀F时反应的化学方程式为
(5)下列物质不可以通过化合反应制得的是
a.物质B b.物质C c.物质F d.物质G
(6)制备溶液B时一般会加入稍过量的A,其目的是
您最近一年使用:0次
名校
3 . 铁及其化合物在生产,生活中有着重要作用。按要求回答下列问题
(1)铁及其化合物的价类分布及转化关系如图所示:
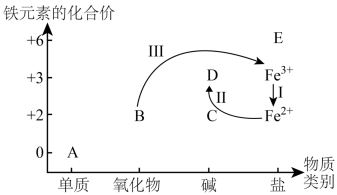
①氯化铁溶液常用于蚀刻铜制电路板,实现了反应Ⅰ的转化,写出反应的离子方程式:_____
②往氯化亚铁溶液中滴加氢氧化钠溶液的过程可实现E→C→D的转化,可观察到的现象为_____
③为实现反应Ⅲ的转化,可选择的试剂为稀硝酸,被还原的N和未被还原的N的物质的量之比为_____ 。
(2)探究某铁盐X的组成与性质(忽略过程中氧气的参与):
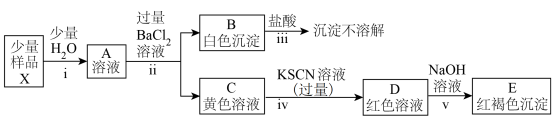
①由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为_____ (填离子符号)。
②根据步骤ⅳ、ⅴ及其现象分析,体系中与 结合能力最强的离子是
结合能力最强的离子是_____ (填“ ”或“
”或“ ”)。
”)。
(3)高铁酸钾( )是一种新型污水处理剂。可以次氯酸钠和氯化铁为原料,在碱性溶液中反应生成高铁酸钠,然后加入氢氧化钾,将高铁酸钠转化成高铁酸钾。
)是一种新型污水处理剂。可以次氯酸钠和氯化铁为原料,在碱性溶液中反应生成高铁酸钠,然后加入氢氧化钾,将高铁酸钠转化成高铁酸钾。
①写出生成高铁酸钠的反应的离子方程式:_____
②若反应过程中转移了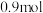 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为_____ mol。
③低温下,向高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾( ),由此可说明溶解度:
),由此可说明溶解度: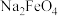
_____ (填“>”“<”或“=”) 。
。
(1)铁及其化合物的价类分布及转化关系如图所示:

①氯化铁溶液常用于蚀刻铜制电路板,实现了反应Ⅰ的转化,写出反应的离子方程式:
②往氯化亚铁溶液中滴加氢氧化钠溶液的过程可实现E→C→D的转化,可观察到的现象为
③为实现反应Ⅲ的转化,可选择的试剂为稀硝酸,被还原的N和未被还原的N的物质的量之比为
(2)探究某铁盐X的组成与性质(忽略过程中氧气的参与):

①由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为
②根据步骤ⅳ、ⅴ及其现象分析,体系中与
 结合能力最强的离子是
结合能力最强的离子是 ”或“
”或“ ”)。
”)。(3)高铁酸钾(
 )是一种新型污水处理剂。可以次氯酸钠和氯化铁为原料,在碱性溶液中反应生成高铁酸钠,然后加入氢氧化钾,将高铁酸钠转化成高铁酸钾。
)是一种新型污水处理剂。可以次氯酸钠和氯化铁为原料,在碱性溶液中反应生成高铁酸钠,然后加入氢氧化钾,将高铁酸钠转化成高铁酸钾。①写出生成高铁酸钠的反应的离子方程式:
②若反应过程中转移了
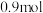 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为③低温下,向高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(
 ),由此可说明溶解度:
),由此可说明溶解度: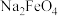
 。
。
您最近一年使用:0次
2023-12-29更新
|
223次组卷
|
3卷引用:2024届青海省协作联考高三上学期一模理综试题
4 . 用硫酸渣(主要成分为Fe2O3、SiO2)制备铁基颜料铁黄(FeOOH)的一种工艺流程如图。
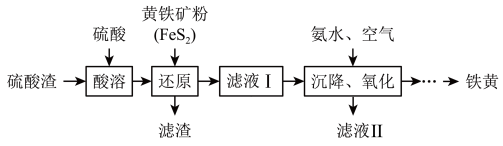
已知:“还原”时,发生反应FeS2+14Fe3++8H2O=2SO +15Fe2++16H+。
+15Fe2++16H+。
下列有关说法错误的是

已知:“还原”时,发生反应FeS2+14Fe3++8H2O=2SO
 +15Fe2++16H+。
+15Fe2++16H+。下列有关说法错误的是
| A.“滤渣”中含SiO2 |
| B.“还原”时溶液由浅绿色变为棕黄色 |
| C.“滤液Ⅱ”的主要成分可用作化学肥料 |
D.“沉降、氧化”时发生反应的离子方程式:4Fe2++8NH3•H2O+O2=8NH +4FeOOH↓+2H2O +4FeOOH↓+2H2O |
您最近一年使用:0次
解题方法
5 . 下列各组离子在指定溶液中能大量共存的是
A.0.1mol·L-1NaHCO3溶液中:H+、Mg2+、Cl-、 |
B.0.1mol·L-1FeCl3溶液中:Fe2+、 、I-、 、I-、 |
C.0.1mol·L-1HCl溶液中:Fe2+、 、Br-、 、Br-、 |
D.0.1mol·L-1NaOH溶液中:K+、Ba2+、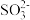 、Br- 、Br- |
您最近一年使用:0次
6 . 某实验小组在实验室制备干燥纯净的氯气,并探究其性质。所用仪器及药品如下图,回答问题。
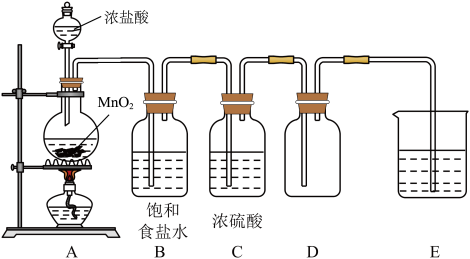
(1)根据实验设计上述制取氯气装置时,按照各装置的功能,连接顺序为:气体发生装置→___________ →收集装置→___________ 。
(2)A中盛放浓盐酸的仪器名称为___________ ,反应的化学方程式为___________ 。
(3)E中反应的离子方程式为___________ 。
(4)若要验证干燥的氯气不具有漂白性,可将下图所示装置连接到原实验装置中,连接的最佳位置是___________ (填选项序号)。
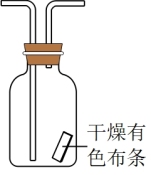
①A、B间 ②B、C间 ③C、D间
(5)该小组同学将制得的氯气配制成氯水,以探究FeI2的还原性。进行了如下实验:取一定量的FeI2溶液,向其中滴加少量新制氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:I-被Cl2氧化
假设2:Fe2+被Cl2氧化
完成下表,设计实验验证假设。
(6)若用MnO2与浓盐酸反应制取常温常压下1LCl2,计算:理论上需要MnO2的质量是___________ 克?(已知常温常压下气体的摩尔体积Vm≈24.5L/mol;写出计算过程,结果保留两位小数。)

(1)根据实验设计上述制取氯气装置时,按照各装置的功能,连接顺序为:气体发生装置→
(2)A中盛放浓盐酸的仪器名称为
(3)E中反应的离子方程式为
(4)若要验证干燥的氯气不具有漂白性,可将下图所示装置连接到原实验装置中,连接的最佳位置是

①A、B间 ②B、C间 ③C、D间
(5)该小组同学将制得的氯气配制成氯水,以探究FeI2的还原性。进行了如下实验:取一定量的FeI2溶液,向其中滴加少量新制氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:I-被Cl2氧化
假设2:Fe2+被Cl2氧化
完成下表,设计实验验证假设。
| 实验步骤 | 预期现象 | 结论 |
| ①取少量黄色溶液于试管中,滴加几滴淀粉溶液 | 假设1正确 | |
| ②取少量黄色溶液于试管中,滴加几滴 | 溶液变成血红色 | 假设2正确 |
您最近一年使用:0次
2023-04-05更新
|
153次组卷
|
2卷引用:青海省西宁市2022-2023学年高一上学期期末考试化学试题
解题方法
7 . 下列离子方程式书写正确的是
A.钠放入水中: |
B.氯化铁溶液与铜反应: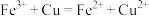 |
C.氢氧化钡溶液与稀硫酸反应: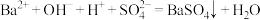 |
D.NaHCO3溶液与稀盐酸混合: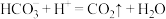 |
您最近一年使用:0次
名校
解题方法
8 . 将1.28g铜片加入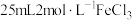 溶液中,完全反应后,下列说法正确的是
溶液中,完全反应后,下列说法正确的是
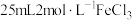 溶液中,完全反应后,下列说法正确的是
溶液中,完全反应后,下列说法正确的是A.溶液中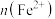 与 与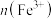 之比为2∶1 之比为2∶1 |
| B.向反应后溶液中滴加KSCN溶液无明显现象 |
C.铜片有剩余,溶液呈浅绿色,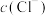 基本不变 基本不变 |
| D.氧化产物与还原产物的物质的量之比为1∶2 |
您最近一年使用:0次
2023-01-07更新
|
123次组卷
|
3卷引用:青海省西宁市大通回族土族自治县第二完全中学2022-2023学年高一下学期开学检测化学试卷
9 . 铁是人类较早使用的金属之一,如图为铁及其化合物的“价—类”二维图。
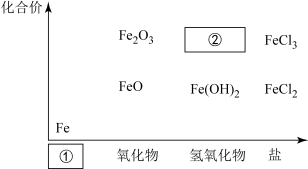
(1)填写二维图缺失的类别①_______ 和化学式②_______ 。
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:①Cl2 ②Fe ③NaOH ④AgNO3。从物质类别上看,FeCl3属于_______ ,可能与_______ 发生反应(填序号);从化合价角度看,Fe3+具有_______ 性,可能与_______ 发生反应(填序号)。
(3)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:_______ 。
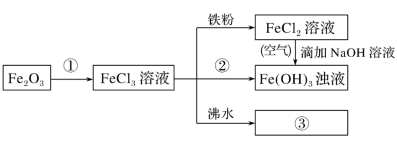
(5)Fe2O3与物质①反应的化学方程式为_______ 。
(6)FeCl2溶液→Fe(OH)3浊液的过程中,观察到的实验现象是_______ 。

(1)填写二维图缺失的类别①
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:①Cl2 ②Fe ③NaOH ④AgNO3。从物质类别上看,FeCl3属于
(3)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:

(5)Fe2O3与物质①反应的化学方程式为
(6)FeCl2溶液→Fe(OH)3浊液的过程中,观察到的实验现象是
您最近一年使用:0次
2022-09-03更新
|
257次组卷
|
3卷引用:青海省青海师范大学附属实验中学2022-2023学年高一上学期12月月考化学试题
解题方法
10 . 钠、铝、铁是三种重要的金属。
(1)将一小块金属钠投入水中,反应的离子方程式为___________ ;钠能与冷水剧烈反应而铁不能,证明金属活动性:钠___________ 铁(填“>”或“<”)。
(2)实验室常用Al2(SO4)3与氨水反应制备氢氧化铝,反应的离子方程式为___________
(3)某补铁剂(有效成分为FeSO4)因长期放置被氧化而失效,为检验其氧化产物(Fe3+),同学们取上述样品制成溶液进行如下实验。
①甲同学取少许溶液,加入___________ ,出现血红色溶液,证明氧化产物为Fe3+。
②乙同学另取少许溶液,加入淀粉-KI溶液,溶液变为___________ 色,证明氧化产物为Fe3+,该反应的离子方程式为___________ (已知:淀粉遇I2变蓝)。
(1)将一小块金属钠投入水中,反应的离子方程式为
(2)实验室常用Al2(SO4)3与氨水反应制备氢氧化铝,反应的离子方程式为
(3)某补铁剂(有效成分为FeSO4)因长期放置被氧化而失效,为检验其氧化产物(Fe3+),同学们取上述样品制成溶液进行如下实验。
①甲同学取少许溶液,加入
②乙同学另取少许溶液,加入淀粉-KI溶液,溶液变为
您最近一年使用:0次



