1 . 某化学兴趣小组为探究 溶液与
溶液与 溶液之间的反应,进行如下实验:
溶液之间的反应,进行如下实验:

下列说法中正确的是
 溶液与
溶液与 溶液之间的反应,进行如下实验:
溶液之间的反应,进行如下实验:
下列说法中正确的是
A.实验①溶液变色,证明 与 与 的反应为可逆反应 的反应为可逆反应 |
| B.实验②、③中氧化还原反应的平衡移动方向相反 |
C.取实验②所得溶液加入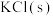 ,溶液红色变浅 ,溶液红色变浅 |
D.黄褐色溶液经实验③后水溶液中的 增大 增大 |
您最近一年使用:0次
2023-02-19更新
|
205次组卷
|
3卷引用:实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)四川省绵阳市2022-2023学年高二上学期期末教学质量测试化学试题课时3影响化学平衡的因素随堂练习
名校
解题方法
2 . 某研究小组欲探究 能否与
能否与 溶液反应。
溶液反应。
【查阅资料】
i. 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。
ii. 遇
遇 可生成
可生成 ,
, 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。
【提出猜想】
(1)小组同学经过讨论后,认为 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:___________ 。
【设计实验】
(2)实验I:在试管中加入 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液_____ ,小组同学认为 和
和 溶液反应生成了
溶液反应生成了 。
。
(3)甲同学注意到盛放 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是______ 。
重新设计实验:
实验II:在试管中加入 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。
【获得结论】
(4)过氧化氢___________ (填“能”或者“不能”)氧化 。
。
【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。
(5)补全实验III的方案:在试管中加入 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入___________ ,产生___________ 。
【总结反思】
(6)小组同学经过讨论后,提出了 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中,___________ ,证明待测液含有 。
。
(7)从上述实验中可以得出结论,在物质性质的检验中,应注意___________ (至少写出两条)对实验结果的影响。
 能否与
能否与 溶液反应。
溶液反应。【查阅资料】
i.
 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。ii.
 遇
遇 可生成
可生成 ,
, 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。【提出猜想】
(1)小组同学经过讨论后,认为
 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:【设计实验】
(2)实验I:在试管中加入
 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液 和
和 溶液反应生成了
溶液反应生成了 。
。(3)甲同学注意到盛放
 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是重新设计实验:
实验II:在试管中加入
 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。【获得结论】
(4)过氧化氢
 。
。【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将
 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。(5)补全实验III的方案:在试管中加入
 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入【总结反思】
(6)小组同学经过讨论后,提出了
 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中, 。
。(7)从上述实验中可以得出结论,在物质性质的检验中,应注意
您最近一年使用:0次
2021-11-07更新
|
1003次组卷
|
4卷引用:第一节 铁及其化合物 第2课时 铁盐、亚铁盐
20-21高一上·浙江·期中
名校
解题方法
3 . 富脂食品密封保存往往需要在包装袋内装一小包脱氧剂(有效成分是还原铁粉),某小组为探究脱氧剂中铁粉是否变质,取少量样品溶于稀盐酸,再进行下列实验,下列有关实验现象和结论的说法正确的是
| A.若加盐酸时有气体产生,则证明脱氧剂未变质 |
| B.若滴加KSCN溶液,无明显变化,再滴加氯水显血红色,则证明脱氧剂未变质 |
| C.若滴加KSCN溶液,溶液显血红色,则证明脱氧剂已变质 |
| D.若加入铜粉充分反应后,溶液呈蓝色,则证明脱氧剂已完全变质 |
您最近一年使用:0次
2021-04-29更新
|
421次组卷
|
5卷引用:3.1.2 铁盐和亚铁盐-2021-2022学年高一化学课后培优练(人教版2019必修第一册)
(已下线)3.1.2 铁盐和亚铁盐-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00151】.(已下线)易错专题23 Fe2+和Fe3+的检验与转化-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)河南省信阳市2022-2023学年高一上学期1月期末考试化学试题河南省濮阳市第一高级中学2022-2023学年高一上学期期中考试化学试题
名校
4 . 铁是人体必需的微量元素,菠菜中铁元素通常以Fe2+形式存在,实验室测定菠菜中铁元素含量的流程如图:

回答下列问题:
(1)“操作1”的名称为____ ,用到的玻璃仪器为____ 。
(2)向操作1所得“溶液”中滴加1~2熵KSCN溶液,现象为____ ,证明溶液中存在Fe3+。
(3)“步骤1”加入HNO3溶液的目的是____ (用文字表述)。
(4)“步骤2”发生反应的化学方程式为____ ,根据数据计算每100g新鲜菠菜中常含铁元素的质量为____ mg。

回答下列问题:
(1)“操作1”的名称为
(2)向操作1所得“溶液”中滴加1~2熵KSCN溶液,现象为
(3)“步骤1”加入HNO3溶液的目的是
(4)“步骤2”发生反应的化学方程式为
您最近一年使用:0次
2022-09-02更新
|
484次组卷
|
3卷引用:研究与实践2 检验食品中的铁元素
21-22高一·全国·假期作业
名校
5 . 已知下述三个实验均能发生化学反应:
下列判断正确的是
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴氯水 | 将铜丝放入氯化铁溶液中 |
| A.实验①中铁钉只作还原剂 |
| B.实验②中Fe2+既显氧化性又显还原性 |
| C.实验③中发生的是置换反应 |
| D.上述实验证明氧化性:Fe3+>Cu2+>Fe2+ |
您最近一年使用:0次
2022-06-25更新
|
884次组卷
|
6卷引用:物质及其变化——课时6 氧化剂和还原剂
(已下线)物质及其变化——课时6 氧化剂和还原剂(已下线)第12讲 铁、亚铁盐和铁盐-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)(已下线)第06讲 氧化剂和还原剂 (讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )(已下线)第06讲 氧化剂和还原剂 (讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )陕西省三原县南郊中学2022-2023学年高一上学期第二次月考化学试题(已下线)【知识图鉴】单元讲练测必修第一册第一单元01讲核心
6 . 为探究 的性质,某学习小组进行了如下探究。
的性质,某学习小组进行了如下探究。
(1)向制得的 溶液中加入铁粉,其目的是
溶液中加入铁粉,其目的是_______ 。
(2)预测 既有氧化性又有还原性。你认为预测的依据是
既有氧化性又有还原性。你认为预测的依据是_______ 。
(3)进行实验探究。实验室提供了下列试剂: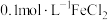 溶液、
溶液、 溶液、新制氯水、KSCN溶液、锌片、铜片。
溶液、新制氯水、KSCN溶液、锌片、铜片。
①向 溶液中滴入新制氯水,探究的是
溶液中滴入新制氯水,探究的是 的
的_______ 性(填“氧化”或“还原”),所发生反应的离子方程式为_______ 。
②在实验中,甲同学发现现象不太明显,老师分析可能是反应产物的含量太低,建议通过检验 反应产物的存在以获取证据。可选
反应产物的存在以获取证据。可选_______ 滴入甲同学所得的混合溶液中,并通过溶液出现_______ 的现象证明 具有还原性,能被氯水氧化。
具有还原性,能被氯水氧化。
③设计实验证明 具有氧化性:
具有氧化性:_______ 。
 的性质,某学习小组进行了如下探究。
的性质,某学习小组进行了如下探究。(1)向制得的
 溶液中加入铁粉,其目的是
溶液中加入铁粉,其目的是(2)预测
 既有氧化性又有还原性。你认为预测的依据是
既有氧化性又有还原性。你认为预测的依据是(3)进行实验探究。实验室提供了下列试剂:
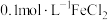 溶液、
溶液、 溶液、新制氯水、KSCN溶液、锌片、铜片。
溶液、新制氯水、KSCN溶液、锌片、铜片。①向
 溶液中滴入新制氯水,探究的是
溶液中滴入新制氯水,探究的是 的
的②在实验中,甲同学发现现象不太明显,老师分析可能是反应产物的含量太低,建议通过检验
 反应产物的存在以获取证据。可选
反应产物的存在以获取证据。可选 具有还原性,能被氯水氧化。
具有还原性,能被氯水氧化。③设计实验证明
 具有氧化性:
具有氧化性:
您最近一年使用:0次
2022-11-25更新
|
221次组卷
|
2卷引用:2019版鲁科化学必修第一册第3章第1节 铁的多样性课后习题
22-23高一上·全国·阶段练习
名校
7 . 铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
【查阅资料】Ⅰ.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
Ⅱ.KSCN中的硫元素为-2价。
Ⅲ.Fe(OH)3受热分解生成Fe2O3。
实验Ⅰ.检验该补铁剂中铁元素的价态。
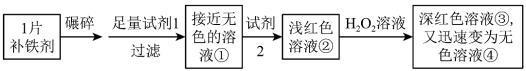
将补铁剂碾碎的目的是增大接触面积,使其充分溶解。
(1)试剂1是_______ ,试剂2是_______ 。
(2)加入试剂2后溶液变为浅红色,说明溶液①中含有_______ 。
(3)能证明溶液①中含有Fe2+的实验现象是_______ 。
(4)补全在上述条件下Fe2+与H2O2发生反应的离子方程式:_______ 。
_______H++_______Fe2++_______H2O2=_______ _______+_______ _______
(5)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是_______ 。
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是_______ 。
实验Ⅱ.测定该补铁剂中铁元素的含量。

(6)计算每片该补铁剂含铁元素的质量为_______ g。
(7)人体只能吸收Fe2+,医生建议在服用该补铁剂时,同时服用有较强还原性的维生素C,理由是_______ 。
【查阅资料】Ⅰ.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
Ⅱ.KSCN中的硫元素为-2价。
Ⅲ.Fe(OH)3受热分解生成Fe2O3。
实验Ⅰ.检验该补铁剂中铁元素的价态。

将补铁剂碾碎的目的是增大接触面积,使其充分溶解。
(1)试剂1是
(2)加入试剂2后溶液变为浅红色,说明溶液①中含有
(3)能证明溶液①中含有Fe2+的实验现象是
(4)补全在上述条件下Fe2+与H2O2发生反应的离子方程式:
_______H++_______Fe2++_______H2O2=_______ _______+_______ _______
(5)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是
实验Ⅱ.测定该补铁剂中铁元素的含量。

(6)计算每片该补铁剂含铁元素的质量为
(7)人体只能吸收Fe2+,医生建议在服用该补铁剂时,同时服用有较强还原性的维生素C,理由是
您最近一年使用:0次
2022-11-01更新
|
600次组卷
|
3卷引用:章末检测卷(三) 铁 金属材料
章末检测卷(三) 铁 金属材料(已下线)第二次月考测评卷-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)北京市海淀区第二十中学2022-2023学年高一上学期11月月考化学试题
8 . 下列实验操作能达到相应目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 证明加碘食盐中存在 | 向食盐水中加入 溶液,取该溶液滴在碘化钾淀粉试纸上 溶液,取该溶液滴在碘化钾淀粉试纸上 |
| B | 证明 溶液部分被氧化 溶液部分被氧化 | 向 溶液中滴加 溶液中滴加 溶液 溶液 |
| C | 证明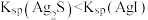 | 向 溶液中滴加 1 mL 溶液中滴加 1 mL  KI再滴加 1 mL KI再滴加 1 mL 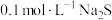 溶液 溶液 |
| D | 制备 胶体 胶体 | 将饱和 溶液滴入NaOH溶液 溶液滴入NaOH溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . 如图为铁的价——类二维图,下列说法正确的是


| A.a在纯氧中燃烧可生成b |
| B.通过化合反应或复分解反应均能直接得到f |
C.固体b溶于氢碘酸的离子方程式为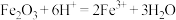 |
D.向e的溶液中滴加 溶液,溶液变红可证明e的溶液完全变质 溶液,溶液变红可证明e的溶液完全变质 |
您最近一年使用:0次
2021-10-27更新
|
408次组卷
|
3卷引用:3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)
(已下线)3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)河北省省级联测2021-2022学年高三上学期第三次联考化学试卷题新疆巴音郭楞蒙古自治州第二中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
10 . 某兴趣小组利用下列试剂:铁粉、锌粉、0.1mol/LFeCl2溶液、KSCN溶液、双氧水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(1)用所给试剂写出体现Fe2+具有还原性的反应的离子反应方程式:___________ 。
(2)设计实验方案,完成下列表格。
(3)该兴趣小组未说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为___________ 。
(4)电子工业中用过量的FeCl3溶液溶解电路板,产生的废液中含FeCl3、CuCl2和FeCl2.由该废液回收铜并得到净水剂(FeCl3·6H2O)的步骤如下:
Ⅰ. 废液中加入过量铁粉,过滤;
Ⅱ. 向Ⅰ的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
Ⅲ. 合并Ⅰ和Ⅱ中的滤液,通入足量氯气;
Ⅳ ……,得到FeCl3·6H2O晶体。
①试剂A是___________ ;
②取少量步骤Ⅲ所得的溶液于试管中,能够证明通入氯气足量的是___________ ;
a.检验Cl2的存在 b.检验Fe3+的存在 c.检验Fe2+的不存在
(1)用所给试剂写出体现Fe2+具有还原性的反应的离子反应方程式:
(2)设计实验方案,完成下列表格。
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe3+的化学性质 | 取少量0.1mol/LFeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液变成 |
| 结论:Fe3+具有 | ||
(4)电子工业中用过量的FeCl3溶液溶解电路板,产生的废液中含FeCl3、CuCl2和FeCl2.由该废液回收铜并得到净水剂(FeCl3·6H2O)的步骤如下:
Ⅰ. 废液中加入过量铁粉,过滤;
Ⅱ. 向Ⅰ的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
Ⅲ. 合并Ⅰ和Ⅱ中的滤液,通入足量氯气;
Ⅳ ……,得到FeCl3·6H2O晶体。
①试剂A是
②取少量步骤Ⅲ所得的溶液于试管中,能够证明通入氯气足量的是
a.检验Cl2的存在 b.检验Fe3+的存在 c.检验Fe2+的不存在
您最近一年使用:0次
2021-12-13更新
|
178次组卷
|
2卷引用:第3课时 铁及其化合物之间的转化关系



