名校
解题方法
1 . 下列实验操作、现象与结论相匹配的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向红热的铁粉与水蒸气反应后的固体中加入稀硫酸酸化,再滴入几滴 溶液 溶液 | 溶液未变红 | 铁粉与水蒸气未反应 |
| B | 常温下,分别测定浓度均为 的 的 溶液和 溶液和 溶液的 溶液的 |  均等于7 均等于7 | 常温下, 的 的 溶液和 溶液和 溶液中水的电离程度相等 溶液中水的电离程度相等 |
| C | 常温下,将 苯与 苯与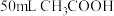 混合 混合 | 所得混合溶液的体积为 | 混合过程中削弱了 分子间的氢键,且苯与 分子间的氢键,且苯与 分子间的作用弱于氢键 分子间的作用弱于氢键 |
| D | 向 溶液中滴加浓氨水至过量 溶液中滴加浓氨水至过量 | 先产生蓝色沉淀,后逐渐溶解 |  是两性氢氧化物 是两性氢氧化物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-31更新
|
1683次组卷
|
4卷引用:湖北省十一校2023届高三第二次联考化学试题
湖北省十一校2023届高三第二次联考化学试题(已下线)第09练 微型实验设计与评价 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江西省宜春市宜丰中学创新部2023-2024学年高三上学期期中考试化学试题
名校
解题方法
2 . 硫脲[ ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙( )与
)与 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
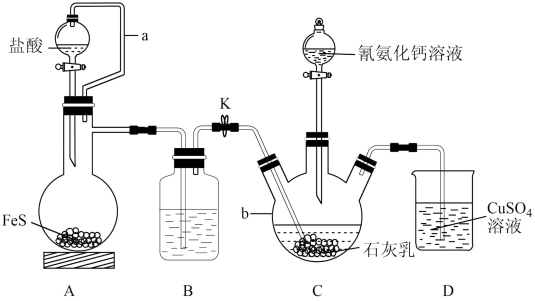
回答下列问题:
(1) 的电子式为
的电子式为_______ 。仪器b的名称是_______ 。
(2)装置A中a的作用是_______ ,A中发生反应的化学方程式为_______ 。
(3)装置B中盛放的试剂是_______ ,其作用是_______ 。
(4)装置C中生成硫脲的总反应为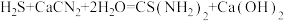 ,若反应分两步进行,写出第二步生成硫脲的化学方程式:
,若反应分两步进行,写出第二步生成硫脲的化学方程式:_______ 。
(5)装置D中可能出现的现象是_______ 。
(6)硫氰化铵( )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是_______ (写出操作步骤和实验现象)。
 ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙( )与
)与 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
回答下列问题:
(1)
 的电子式为
的电子式为(2)装置A中a的作用是
(3)装置B中盛放的试剂是
(4)装置C中生成硫脲的总反应为
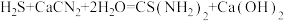 ,若反应分两步进行,写出第二步生成硫脲的化学方程式:
,若反应分两步进行,写出第二步生成硫脲的化学方程式:(5)装置D中可能出现的现象是
(6)硫氰化铵(
 )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
您最近一年使用:0次
2022-04-16更新
|
441次组卷
|
3卷引用:湖北省九师联盟2022届高三 三模考试化学试题
名校
解题方法
3 . 草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如下:
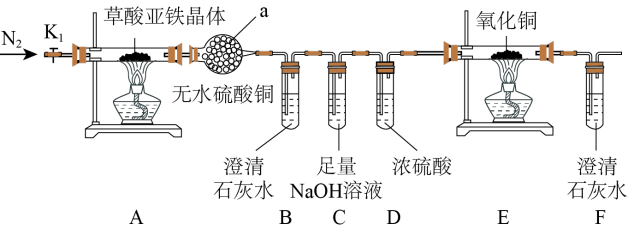
(1)仪器a的名称是______ 。
(2)从绿色化学考虑,该套装置存在的明显缺陷是_________ 。
(3)实验前先通入一段时间N2,其目的为__________ 。
(4)实验证明了气体产物中含有CO,依据的实验现象为_______ 。
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是____ 。
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:
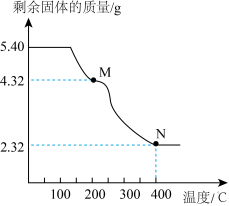
①上图中M点对应物质的化学式为_________ 。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:_______ 。

(1)仪器a的名称是
(2)从绿色化学考虑,该套装置存在的明显缺陷是
(3)实验前先通入一段时间N2,其目的为
(4)实验证明了气体产物中含有CO,依据的实验现象为
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:

①上图中M点对应物质的化学式为
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:
您最近一年使用:0次
2020-03-15更新
|
1056次组卷
|
7卷引用:湖北省黄冈中学2020届高三化学测试
名校
解题方法
4 . 某小组为探究K3[Fe(C2O4)3·3H2O(三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验。下列有关叙述错误的是
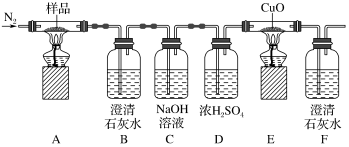

| A.通入氮气的目的有;隔绝空气、使反应产生的气体全部进入后续装置 |
| B.实验中观察到装置F中澄清石灰水变浑浊,装置E中固体变为红色,由此可判断热分解产物中一定含有CO2和CO |
| C.为防止倒吸,停止实验时应进行的操作是:先熄灭装置A、E的酒精灯,冷却后停止通入氮气 |
D.样品完全分解后,取少许装置A中残留物于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,可证明残留物中含有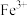 |
您最近一年使用:0次
2020-01-12更新
|
1481次组卷
|
8卷引用:【省级联考】湖北省2020年第五届高考测评活动高三元月调考(一模)理综化学试题
【省级联考】湖北省2020年第五届高考测评活动高三元月调考(一模)理综化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(二)山东省日照一中2020届高三新高考3月份自测化学试题山东省潍坊昌乐县第二中学2020届高三下学期3月阶段测试化学试题北京市第一七一中学 2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】绍兴qw78福建省厦门双十中学2022-2023学年高一上学期第二次月考化学试题福建省三明第一中学2023-2024学年高一上学期12月月考化学试题
5 . 工业上以软锰矿(主要成分为MnO2,另含有少量FeCO3、Al2O3、SiO2)为原料制取金属锰的工艺流程如下:
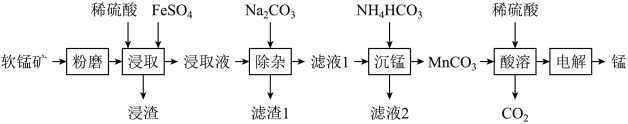
(1)软锰矿“粉磨”的目的是___________ 。
(2)“浸渣”的主要成分是___________ 。
(3)经检测“浸取液”中无Fe2+,“浸取"时MnO2发生反应的离子方程式为___________ 。
(4)在“沉锰”操作中,不能用Na2CO3代替 NH4HCO3,其原因是___________ 。
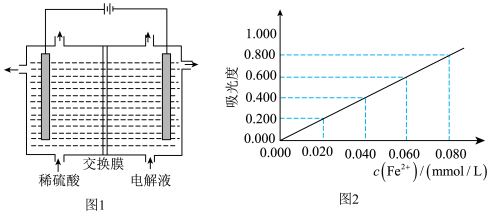
(5)将“酸溶”后的溶液作为电解液,用下图1装置电解应采用___________ 离子交换膜(填“阴”或“阳”),阳极的电极反应式为___________ 。
(6)为充分利用“滤渣1”,需测定滤渣中Al元素的含量,设计以下方案。
①将mg滤渣处理成amL溶液;
②取少量①中溶液用EDTA滴定测得溶液中Fe3+、Al3+的浓度之和为 b mmol/L;
③另取少量①中溶液将Fe3+用盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl-)还原Fe2+,离子方程式为___________ ;
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如上图2所示)。该样品中Al元素的质量分数为___________ (用含字母的表达式表示)。

(1)软锰矿“粉磨”的目的是
(2)“浸渣”的主要成分是
(3)经检测“浸取液”中无Fe2+,“浸取"时MnO2发生反应的离子方程式为
(4)在“沉锰”操作中,不能用Na2CO3代替 NH4HCO3,其原因是
(5)将“酸溶”后的溶液作为电解液,用下图1装置电解应采用

(6)为充分利用“滤渣1”,需测定滤渣中Al元素的含量,设计以下方案。
①将mg滤渣处理成amL溶液;
②取少量①中溶液用EDTA滴定测得溶液中Fe3+、Al3+的浓度之和为 b mmol/L;
③另取少量①中溶液将Fe3+用盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl-)还原Fe2+,离子方程式为
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如上图2所示)。该样品中Al元素的质量分数为
您最近一年使用:0次
解题方法
6 . 铁元素在溶液中主要以Fe2+、Fe3+、Fe(SCN)3、FeO (紫红色)等形式存在。回答下列问题:
(紫红色)等形式存在。回答下列问题:
(1)向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.01 mol/L KSCN溶液,现象是___________ ,再滴加0.01 mol/L NaOH溶液3 ~5滴,现象是________________________ 。
(2)Fe2+与Ag+在溶液中可相互转化。室温时,初始浓度为0.1 mol/LFe(NO3)2溶液中c(Fe3+)随c(Ag+)的变化如下左图所示:
①用离子方程式表示Fe(NO3)2溶液中的转化反应_________________________________________ 。
②根据A点数据,计算该转化反应的平衡常数为____________________ 。
③利用如上右图所示的装置,证明上述反应的可逆性。闭合电键K,立即观察到的明显现象是______ 。石墨为电池的_____ 极,通过列式计算说明原因_______________________________ 。
(3)印刷电路板是由高分子材料和铜箔复合而成,制印刷电路时,用FeCl3溶液作为“腐蚀液”,现从腐蚀后的溶液中分离出铁和铜,其方法是:先加H2O2,目的是_________________________ ,再加碱调节pH为_________ 时,铁刚好沉淀完全;继续加碱至pH为4.5时,铜开始沉淀。
已知:
(4)K2FeO4具有强氧化性。在K2FeO4溶液中加入过量稀硫酸,观察到有无色无味气体产生,还可观察到的现象是_____________________________ ;用K2FeO4处理含NH3废水,既可以把NH3氧化为N2防止水体富营养化,又能生成一种净水剂,该反应的离子方程式为______________________________ 。
 (紫红色)等形式存在。回答下列问题:
(紫红色)等形式存在。回答下列问题:(1)向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.01 mol/L KSCN溶液,现象是
(2)Fe2+与Ag+在溶液中可相互转化。室温时,初始浓度为0.1 mol/LFe(NO3)2溶液中c(Fe3+)随c(Ag+)的变化如下左图所示:
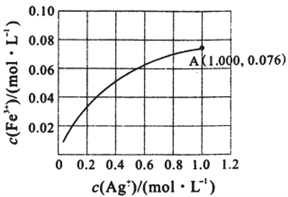
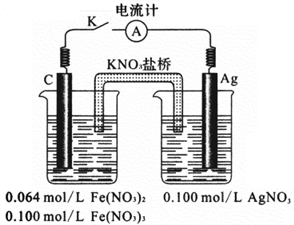
①用离子方程式表示Fe(NO3)2溶液中的转化反应
②根据A点数据,计算该转化反应的平衡常数为
③利用如上右图所示的装置,证明上述反应的可逆性。闭合电键K,立即观察到的明显现象是
(3)印刷电路板是由高分子材料和铜箔复合而成,制印刷电路时,用FeCl3溶液作为“腐蚀液”,现从腐蚀后的溶液中分离出铁和铜,其方法是:先加H2O2,目的是
已知:
化合物 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-20 | 10-17 | 10-39 |
您最近一年使用:0次
2017-04-16更新
|
231次组卷
|
2卷引用:2017届湖北省武汉市高三高中毕业生四月调研测试化学试卷



