名校
1 . 自古至今,铁及其化合物在人类生产生活中的使用发挥了巨大的作用。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是__________ (填化学式)。
(2)工业上,可利用硫酸亚铁溶液和氧气在催化剂条件下制作铁黄(FeOOH),一种不溶于水的黄色固体,写出该反应的离子方程式:______________________________ 。
(3)从某工业废渣wg(主要含二氧化硅、氧化铁、氧化镁)中提取氧化铁的工艺流程如图(部分操作和条件略):

已知:二氧化硅不溶于硫酸。
①滤渣的主要成分为__________ (填化学式)。
②写出步骤Ⅴ的化学方程式:______________________________ 。
③请写出验证硫酸亚铁溶液中是否存在 的实验方法:
的实验方法:______________________________ 。
④若提取过程中铁元素的损耗忽略不计,最终获得ng的氧化铁。则废渣中铁元素的质量分数为__________ 。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是
(2)工业上,可利用硫酸亚铁溶液和氧气在催化剂条件下制作铁黄(FeOOH),一种不溶于水的黄色固体,写出该反应的离子方程式:
(3)从某工业废渣wg(主要含二氧化硅、氧化铁、氧化镁)中提取氧化铁的工艺流程如图(部分操作和条件略):

已知:二氧化硅不溶于硫酸。
①滤渣的主要成分为
②写出步骤Ⅴ的化学方程式:
③请写出验证硫酸亚铁溶液中是否存在
 的实验方法:
的实验方法:④若提取过程中铁元素的损耗忽略不计,最终获得ng的氧化铁。则废渣中铁元素的质量分数为
您最近一年使用:0次
名校
2 . 工业上,处理低品位黄铜矿[二硫化亚铁铜( )含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(
)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾( )和胆矾(
)和胆矾( ),相关流程如下图。
),相关流程如下图。
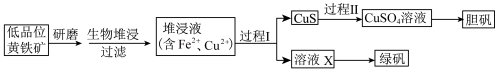
资料:①生物堆浸使用的氧化亚铁硫杆菌(T。f细菌)在pH1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如下表。
(1)生物堆浸前,需先将矿石进行研磨,目的是___________ 。
(2)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为: 。第二阶段反应为
。第二阶段反应为 继续被氧化转变成
继续被氧化转变成 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(3)生物堆浸过程中,应控制溶液的pH在___________ 范围内。
(4) 在过程Ⅰ中被还原为
在过程Ⅰ中被还原为 。
。
①若过程Ⅰ中只加入一种试剂,在下列常见还原剂中可选择___________ 。
a. b.
b. c.
c. d.Cu
d.Cu
② 做还原剂时,通常被氧化为
做还原剂时,通常被氧化为 。过程Ⅰ中若加入
。过程Ⅰ中若加入 固体,则发生反应的离子方程式有
固体,则发生反应的离子方程式有___________ 、___________ (忽略该过程中所有涉及配合物的反应)。
③为判断堆浸液中 是否被完全还原,可取少量溶液X,向其中加入
是否被完全还原,可取少量溶液X,向其中加入___________ (填试剂的化学式),观察溶液颜色变化。
(5)向过程Ⅰ所得固体中加入___________ (填试剂的化学式),过滤,可得CuS固体。然后加 和稀硫酸,CuS
和稀硫酸,CuS完全溶解 ,用离子方程式表示 的作用是
的作用是___________ 。
 )含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(
)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾( )和胆矾(
)和胆矾( ),相关流程如下图。
),相关流程如下图。
资料:①生物堆浸使用的氧化亚铁硫杆菌(T。f细菌)在pH1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如下表。
 |  |  | |
| 开始沉淀时的pH | 1.5 | 4.2 | 6.3 |
| 完全沉淀时的pH | 2.8 | 6.7 | 8.3 |
(1)生物堆浸前,需先将矿石进行研磨,目的是
(2)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为:
 。第二阶段反应为
。第二阶段反应为 继续被氧化转变成
继续被氧化转变成 ,反应的离子方程式为
,反应的离子方程式为(3)生物堆浸过程中,应控制溶液的pH在
(4)
 在过程Ⅰ中被还原为
在过程Ⅰ中被还原为 。
。①若过程Ⅰ中只加入一种试剂,在下列常见还原剂中可选择
a.
 b.
b. c.
c. d.Cu
d.Cu②
 做还原剂时,通常被氧化为
做还原剂时,通常被氧化为 。过程Ⅰ中若加入
。过程Ⅰ中若加入 固体,则发生反应的离子方程式有
固体,则发生反应的离子方程式有③为判断堆浸液中
 是否被完全还原,可取少量溶液X,向其中加入
是否被完全还原,可取少量溶液X,向其中加入(5)向过程Ⅰ所得固体中加入
 和稀硫酸,CuS
和稀硫酸,CuS 的作用是
的作用是
您最近一年使用:0次
名校
解题方法
3 . 甘氨酸亚铁[ (H2NCH2COO)2Fe]是一种补血剂,工业上用赤铁矿(含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:
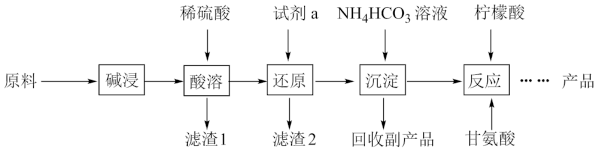
已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。
回答下列问题:
(1)“碱浸”去除的元素是_________ , “滤渣1”是_________ (填化学式)
(2)“'还原”时的还原产物是_________ 。
(3)“沉淀”的离子方程式_________ ,“副产品”是_________ (写名称)
(4)柠檬酸的作用防止Fe2+氧化,“反应”的化学方程式为_________ 。
(5)FeSO4·7H2O也是一种常用的补血剂, 在空气中易变质,检验其是否变质的试剂是_________ ,某同学通过如下实验测定该补血剂中Fe2+的含量:
①配制:用分析天平称取1. 4000gFeSO4·7H2O样品,再用煮沸并冷却的蒸馏水配制100mL溶液。配制时还需要的定量仪器是_________ 。
②滴定:用酸化的KMnO4溶液滴定
用移液管移取25. 00mLFeSO4溶液于锥形瓶中,用0. 0100mol·L-1的KMnO4,溶液滴定,平行滴定3次,KMnO4溶液的平均用量为24. 00mL,则样品Fe2+的含量为________ % (保留2位小数) 。

已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。
回答下列问题:
(1)“碱浸”去除的元素是
(2)“'还原”时的还原产物是
(3)“沉淀”的离子方程式
(4)柠檬酸的作用防止Fe2+氧化,“反应”的化学方程式为
(5)FeSO4·7H2O也是一种常用的补血剂, 在空气中易变质,检验其是否变质的试剂是
①配制:用分析天平称取1. 4000gFeSO4·7H2O样品,再用煮沸并冷却的蒸馏水配制100mL溶液。配制时还需要的定量仪器是
②滴定:用酸化的KMnO4溶液滴定
用移液管移取25. 00mLFeSO4溶液于锥形瓶中,用0. 0100mol·L-1的KMnO4,溶液滴定,平行滴定3次,KMnO4溶液的平均用量为24. 00mL,则样品Fe2+的含量为
您最近一年使用:0次
2022-08-08更新
|
993次组卷
|
7卷引用:内蒙古自治区霍林郭勒市第一中学2022-203学年高三上学期9月月考化学试题
内蒙古自治区霍林郭勒市第一中学2022-203学年高三上学期9月月考化学试题四川省资中县球溪高级中学2022-2023学年高三上学期10月月考化学试题宁夏回族自治区中卫市中宁县第一中学2022-2023学年高三上学期10月月考化学试题四川省达州市2021-2022学年高三上学期第一次诊断考试理科综合化学试题四川省达州市普通高中2022届高三第一次诊断性测试理综化学试题(已下线)专题讲座(八) 无机化工流程题的解题策略(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)易错点06 铁及其化合物-备战2023年高考化学考试易错题
名校
解题方法
4 . 已知:Cu2O+H2SO4 = Cu+CuSO4 +H2O 。某红色粉末样品可能含有 Fe2O3 和 Cu2O 中的一种或两种,为探究其组成,取少量样品加入过量稀硫酸。下列有关说法正确的是
| A.若固体全部溶解,则发生的离子反应只有:Fe2O3+6H+=2Fe3+ +3H2O |
| B.若固体部分溶解,则样品中一定含有 Cu2O,一定不含有 Fe2O3 |
| C.若固体全部溶解,再滴加 KSCN 溶液,溶液不变红色,则样品中 n(Fe2O3):n(Cu2O)为 2:1 |
| D.另取 ag 样品在空气中充分加热至质量不再变化,称其质量为 b g(b>a),则混合物中 Cu2O 的质量分数为 9(b-a)/a |
您最近一年使用:0次
2020-02-17更新
|
1832次组卷
|
14卷引用:内蒙古包钢第一中学2022-2023学年高三上学期11月月考化学试题
内蒙古包钢第一中学2022-2023学年高三上学期11月月考化学试题辽宁省实验中学东戴河校区2021届高三上学期第一次月考化学试题辽宁省沈阳辽宁省实验中学2021届高三上学期月考化学试题湖南省长沙市长郡中学2021届高三上学期第5次月考化学试题安徽省合肥市(五中、七中、十中)2021-2022学年高三上学期联考化学试题浙江省温州市2019-2020学年高一上学期期末教学质量统一检测化学试题(已下线)【新东方】2020-91(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00146】(已下线)专题讲座(一) 阿伏加德罗常数的突破(练) — 2022年高考化学一轮复习讲练测(新教材新高考)浙江省吴兴高级中学2021-2022学年高一下学期返校学情检测化学试题甘肃省庆阳市2022-2023学年高一上学期期末考试化学试题湖南省湘潭市2022-2023学年高一上学期1月期末考试化学试题河南省新乡市2022-2023学年高一上学期选科调研第二次测试化学试题河南省新乡市第一中学2022-2023学年高一上学期12月期中考试化学试题
13-14高三·浙江温州·开学考试
名校
5 . 部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是

下列说法正确的是
| A.滤液A中的阳离子为Fe2+、Fe3+、H+ | B.样品中CuO的质量为4.0 g |
| C.V=448 | D.原样品中Fe元素的质量分数为41% |
您最近一年使用:0次
2016-11-26更新
|
388次组卷
|
3卷引用:2017届内蒙古赤峰市宁城县高三上统一考试化学试卷
名校
解题方法
6 . 硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
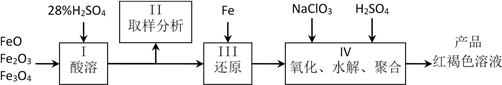
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有____________ 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是____________ 。
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是____________________ ,弊是________________________ 。聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。
(4)测定时所需的试剂____________ 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定____________ 和____________ 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作____________ (按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是
(4)测定时所需的试剂
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定
(6)选出测定过程中所需的基本操作
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
您最近一年使用:0次



