名校
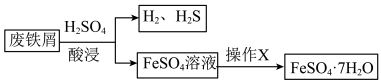
1 . 综合利用废弃物,对资源利用和环境保护具有现实意义。以废铁屑(含少量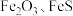 等杂质)为原料,制备硫酸亚铁晶体(
等杂质)为原料,制备硫酸亚铁晶体( ),流程示意图如下。
),流程示意图如下。
(1)酸浸过程中, 的作用是
的作用是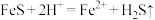 、
、 、
、___________ (用离子方程式表示)。
(2)酸浸时间对所得溶液的成分影响如下表所示。
① 时检验,溶液变红,写出离子方程式
时检验,溶液变红,写出离子方程式___________
② 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因___________ 。
③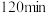 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因___________ 。
(3)已知: 受热易失水。操作X为:
受热易失水。操作X为: ___________ 。
(4)测定所得硫酸亚铁晶体中 的含量,步骤如下:
的含量,步骤如下:
Ⅰ.称取 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。
Ⅱ.取出 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入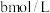 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液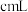 。
。
①依题意完善Ⅱ中 氧化
氧化 的离子方程式
的离子方程式________

 ___________
___________
 ___________
___________
②计算硫酸亚铁晶体样品中 的质量分数
的质量分数___________ 。
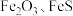 等杂质)为原料,制备硫酸亚铁晶体(
等杂质)为原料,制备硫酸亚铁晶体( ),流程示意图如下。
),流程示意图如下。
(1)酸浸过程中,
 的作用是
的作用是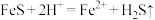 、
、 、
、(2)酸浸时间对所得溶液的成分影响如下表所示。
| 酸浸时间 |  |  |  |
用 溶液检验 溶液检验 | 变红 | 未变红 | 变红 |
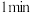 时检验,溶液变红,写出离子方程式
时检验,溶液变红,写出离子方程式②
 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因③
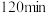 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因(3)已知:
 受热易失水。操作X为:
受热易失水。操作X为: (4)测定所得硫酸亚铁晶体中
 的含量,步骤如下:
的含量,步骤如下:Ⅰ.称取
 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。Ⅱ.取出
 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入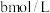 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液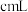 。
。①依题意完善Ⅱ中
 氧化
氧化 的离子方程式
的离子方程式
 ___________
___________
 ___________
___________②计算硫酸亚铁晶体样品中
 的质量分数
的质量分数
您最近一年使用:0次
2024-03-27更新
|
218次组卷
|
4卷引用:江西省丰城中学2023-2024学年高一下学期开学化学试题
名校
解题方法
2 . 探究题以废铁屑(含少量Fe2O3、FeS等杂质)为原料,制备硫酸亚铁晶体(FeSO4·7H2O),流程示意图如下。
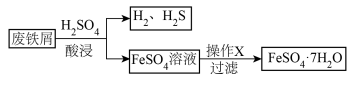
已知: 晶体受热易失水。
晶体受热易失水。
(1)酸浸过程中,H2SO4的作用是FeS+2H+=Fe2++H2S↑、Fe+2H+=Fe2++H2↑、_______ (用离子方程式表示)。
(2)酸浸时间对所得溶液的成分影响如下表所示。
① 时检验,溶液变红,说明所得溶液中含有
时检验,溶液变红,说明所得溶液中含有_______ 。
② 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因_______ 。
③ 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因_______ 。
④操作X是_______ 。
(3)测定所得硫酸亚铁晶体中 的含量,步骤如下:
的含量,步骤如下:
Ⅰ.称取ag硫酸亚铁晶体样品,配制成 溶液。
溶液。
Ⅱ.取出 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液cmL。
溶液cmL。
计算硫酸亚铁晶体样品中 的质量分数
的质量分数_______ 。

已知:
 晶体受热易失水。
晶体受热易失水。(1)酸浸过程中,H2SO4的作用是FeS+2H+=Fe2++H2S↑、Fe+2H+=Fe2++H2↑、
(2)酸浸时间对所得溶液的成分影响如下表所示。
| 酸浸时间 |  |  | 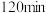 |
| 用KSCN溶液检验 | 变红 | 未变红 | 变红 |
①
 时检验,溶液变红,说明所得溶液中含有
时检验,溶液变红,说明所得溶液中含有②
 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因③
 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因④操作X是
(3)测定所得硫酸亚铁晶体中
 的含量,步骤如下:
的含量,步骤如下:Ⅰ.称取ag硫酸亚铁晶体样品,配制成
 溶液。
溶液。Ⅱ.取出
 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液cmL。
溶液cmL。计算硫酸亚铁晶体样品中
 的质量分数
的质量分数
您最近一年使用:0次
3 . 铁及其化合物在生产、生活中有重要作用。回答下列问题:
I.硫酸亚铁晶体 在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
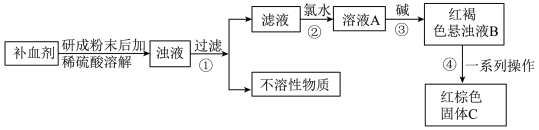
(1)检验经步骤①得到的滤液中是否含有 的方法为
的方法为______ 。
(2)步骤②加入氯水发生反应的离子方程式是______ 。
(3)步骤③产生的红褐色物质成分是______ (写化学式)。
(4)步骤④中一系列操作为______ 、洗涤、干燥、灼烧。
(5)若所取补血剂质量为 ,最终得到红棕色固体
,最终得到红棕色固体 的质量为
的质量为 ,则补血剂中硫酸亚铁晶体的质量分数为
,则补血剂中硫酸亚铁晶体的质量分数为______ (用含 的代数式表示,不考虑实验中铁元素的损失)。
的代数式表示,不考虑实验中铁元素的损失)。
II.高铁酸钾 是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:

(6)过程①制取 ,理论上需要
,理论上需要 的物质的量为
的物质的量为______ 。步骤②中反应能够发生的原因是______ 。实验室用 饱和溶液制备
饱和溶液制备 胶体的方法是:取
胶体的方法是:取 小烧杯,加入
小烧杯,加入 蒸馏水,将蒸馏水加热至沸腾
蒸馏水,将蒸馏水加热至沸腾______ (将操作补充完整)。
I.硫酸亚铁晶体
 在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
(1)检验经步骤①得到的滤液中是否含有
 的方法为
的方法为(2)步骤②加入氯水发生反应的离子方程式是
(3)步骤③产生的红褐色物质成分是
(4)步骤④中一系列操作为
(5)若所取补血剂质量为
 ,最终得到红棕色固体
,最终得到红棕色固体 的质量为
的质量为 ,则补血剂中硫酸亚铁晶体的质量分数为
,则补血剂中硫酸亚铁晶体的质量分数为 的代数式表示,不考虑实验中铁元素的损失)。
的代数式表示,不考虑实验中铁元素的损失)。II.高铁酸钾
 是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
(6)过程①制取
 ,理论上需要
,理论上需要 的物质的量为
的物质的量为 饱和溶液制备
饱和溶液制备 胶体的方法是:取
胶体的方法是:取 小烧杯,加入
小烧杯,加入 蒸馏水,将蒸馏水加热至沸腾
蒸馏水,将蒸馏水加热至沸腾
您最近一年使用:0次
名校
解题方法
4 . 周南中学化学研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并回答下列问题:
探究一:设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。

(1)硬质玻璃管B中发生反应的化学方程式为___________ 。
(2)反应前A中投放碎瓷片的目的是___________ 。
(3)装置E中的现象是___________ 。
探究二:设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分。
(4)待硬质玻管B冷却后,取少许其中的固体物质溶于___________ 后(写物质名称),将所得溶液分成两份。一份滴加几滴 溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分为
溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分为___________ (填序号)。
①一定有 ②一定有
②一定有 ③只有
③只有 ④只有
④只有
另一份用胶头滴管加入___________ (填试剂和现象),可以证明溶液中存在 。
。
探究三:设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。

(5)计算反应后B装置中铁元素的质量分数为___________ 。
探究一:设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。

(1)硬质玻璃管B中发生反应的化学方程式为
(2)反应前A中投放碎瓷片的目的是
(3)装置E中的现象是
探究二:设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分。
(4)待硬质玻管B冷却后,取少许其中的固体物质溶于
 溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分为
溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分为①一定有
 ②一定有
②一定有 ③只有
③只有 ④只有
④只有
另一份用胶头滴管加入
 。
。探究三:设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。

(5)计算反应后B装置中铁元素的质量分数为
您最近一年使用:0次
名校
5 . 已知 2FeCl3+Fe=3FeCl2。在 FeCl3 溶液中加入一定量的 Fe,当反应进行到氯化铁和氯化亚铁的质量分数相等时,求此刻已参加反应的氯化铁和剩余的氯化铁的质量比_______ 。(相对分子质量 FeCl3:162.5 FeCl2:127 )
您最近一年使用:0次
名校
6 . KSCN是实验室常用的化学试剂。
(1)探究KCl浓度对Fe3+与SCN-显色反应的影响
将25mL0.005mol•L-1FeCl3与25mL0.01mol•L-1KSCN溶液混合得红色溶液,各取3mL溶液分别加KCl晶体进行透光实验,结果如图所示。
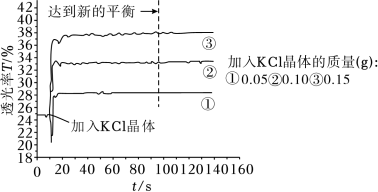
已知:i.溶液颜色越浅,透光率(T)越高;
ii.FeCl3溶液中存在Fe3++4Cl- [FeCl4]-(黄色)。
[FeCl4]-(黄色)。
①采用FeCl3稀溶液是为了避免_______ (填离子符号)的颜色对实验干扰。
②由实验结果分析,随着KCl浓度增大,Fe(SCN)3的浓度_______ (填“增大”“减小”或“不变”),从平衡移动的角度分析可能的原因_______ 。
(2)探究KSCN在铜含量测定过程中的作用
步骤如下:取1.0g铜盐样品溶于稀盐酸配成250mL溶液,取10.00mL加入过量KI充分反应,用0.0100mol•L-1的Na2S2O3标准液滴定至终点。
已知:i.2Cu2++4I-=2CuI↓+I2;2S2O +I2=S4O
+I2=S4O +2I-;
+2I-;
ii.I2+I- I
I ,CuI沉淀强烈吸附I
,CuI沉淀强烈吸附I ;
;
iii.Ksp(CuI)=1.0×10-12;Ksp(CuSCN)=4.8×10-15
①以淀粉为指示剂,滴定终点的颜色变化为_______ ;根据信息预测最终测定的结果将_______ (填“偏大”“偏小”或“无影响”)。
②通过实验探究,在滴定过程中加入KSCN可使测定结果更准确,写出发生反应的离子方程式_______ ;到达滴定终点时消耗标准液20.00mL,样品中铜元素质量分数为_______ ,滴定后仍存在少量CuI沉淀,测得溶液中c(I-)=0.2mol•L-1,则c(SCN-)=_______ 。
(1)探究KCl浓度对Fe3+与SCN-显色反应的影响
将25mL0.005mol•L-1FeCl3与25mL0.01mol•L-1KSCN溶液混合得红色溶液,各取3mL溶液分别加KCl晶体进行透光实验,结果如图所示。

已知:i.溶液颜色越浅,透光率(T)越高;
ii.FeCl3溶液中存在Fe3++4Cl-
 [FeCl4]-(黄色)。
[FeCl4]-(黄色)。①采用FeCl3稀溶液是为了避免
②由实验结果分析,随着KCl浓度增大,Fe(SCN)3的浓度
(2)探究KSCN在铜含量测定过程中的作用
步骤如下:取1.0g铜盐样品溶于稀盐酸配成250mL溶液,取10.00mL加入过量KI充分反应,用0.0100mol•L-1的Na2S2O3标准液滴定至终点。
已知:i.2Cu2++4I-=2CuI↓+I2;2S2O
 +I2=S4O
+I2=S4O +2I-;
+2I-;ii.I2+I-
 I
I ,CuI沉淀强烈吸附I
,CuI沉淀强烈吸附I ;
;iii.Ksp(CuI)=1.0×10-12;Ksp(CuSCN)=4.8×10-15
①以淀粉为指示剂,滴定终点的颜色变化为
②通过实验探究,在滴定过程中加入KSCN可使测定结果更准确,写出发生反应的离子方程式
您最近一年使用:0次
2024-04-05更新
|
53次组卷
|
3卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题
名校
7 . 铁是人体必需的微量元素之一。黑木耳中的含铁量较高,为检验和测定干黑木耳样品中的铁元素,设计实验如下。回答下列问题:
Ⅰ.铁元素的检验

(1)“操作”是指________ ;上述流程中需要用到的仪器有托盘天平、烧杯、玻璃棒、酒精灯、漏斗,还有下图中的________ (填写仪器名称)。

(2)检验待测液中是否含有 、
、
Ⅱ.铁元素含量的测定
利用 标准溶液测定干黑木耳样品中铁元素的含量
标准溶液测定干黑木耳样品中铁元素的含量
步骤Ⅰ:取 待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤Ⅱ:向步骤Ⅰ所得的溶液中加入适量稀 溶液,用
溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 。
。
(3)步骤Ⅰ加入过量铜粉的目的是_________________________________ 。
(4)步骤Ⅱ滴加 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为_____________________ 。
(5)用 标准溶液滴定至终点的标志是:
标准溶液滴定至终点的标志是:___________ 。
(6)黑木耳中铁的含量为________ mg/100g(即每100g黑木耳中含铁元素质量)。
(7)若步骤Ⅰ过滤后未洗涤将使测定结果________ (填“偏大”或“偏小”或“无影响”)。
Ⅰ.铁元素的检验

(1)“操作”是指

(2)检验待测液中是否含有
 、
、
| 检验试剂 | 现象 | 结论 |
| KSCN溶液 | 溶液变为红色 | 滤液中含有 |
| ① | ② | 滤液中含有 |
Ⅱ.铁元素含量的测定
利用
 标准溶液测定干黑木耳样品中铁元素的含量
标准溶液测定干黑木耳样品中铁元素的含量步骤Ⅰ:取
 待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。步骤Ⅱ:向步骤Ⅰ所得的溶液中加入适量稀
 溶液,用
溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液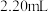 。
。(3)步骤Ⅰ加入过量铜粉的目的是
(4)步骤Ⅱ滴加
 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为(5)用
 标准溶液滴定至终点的标志是:
标准溶液滴定至终点的标志是:(6)黑木耳中铁的含量为
(7)若步骤Ⅰ过滤后未洗涤将使测定结果
您最近一年使用:0次
2024-04-03更新
|
148次组卷
|
2卷引用:天津市宁河区芦台第一中学2024届高三下学期适应性模拟训练(3月)化学试题
名校
解题方法
8 . 用硫铁矿烧渣(主要成分为Fe2O3和少量SiO2)为原料可以制得绿矾(FeSO4·7H2O)。
I.用密度为1.84g·cm-3、质量分数为98%浓硫酸配制240mL4.8mol/L的硫酸溶液
(1)需用量筒量取浓硫酸的体积为________ mL。
(2)配制时,除量筒、烧杯和玻璃棒外,还需要用的玻璃仪器是________ (填仪器名称)。
(3)配制时,一般可分为以下几个步骤:①量取②计算③稀释④摇匀⑤转移⑥洗涤⑦定容⑧装瓶,贴标签。操作正确顺序为________ (填代号)。
(4)配制时,下列操作会引起结果偏高的是________ 。
①未洗涤烧杯、玻璃棒
②容量瓶不干燥,含有少量蒸馏水
③超过刻度线,吸出一部分水
④定容时俯视刻度线
⑤摇匀后液面下降,再补充水
⑥未冷却至室温就加水定容至刻度线
II.绿矾的制备流程图如图所示
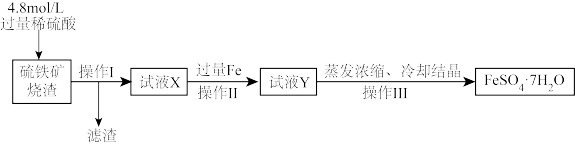
(5)滤渣的主要化学成分是________ (填化学式)。
(6)向溶液X中加入过量的铁粉,发生的主要反应的离子方程式为________ 。
(7)绿矾长期放置于空气中会变质,原因是______ 。将绿矾溶于水后,加入_______ (填试剂名称),若______ (描述现象),则说明已变质。
I.用密度为1.84g·cm-3、质量分数为98%浓硫酸配制240mL4.8mol/L的硫酸溶液
(1)需用量筒量取浓硫酸的体积为
(2)配制时,除量筒、烧杯和玻璃棒外,还需要用的玻璃仪器是
(3)配制时,一般可分为以下几个步骤:①量取②计算③稀释④摇匀⑤转移⑥洗涤⑦定容⑧装瓶,贴标签。操作正确顺序为
(4)配制时,下列操作会引起结果偏高的是
①未洗涤烧杯、玻璃棒
②容量瓶不干燥,含有少量蒸馏水
③超过刻度线,吸出一部分水
④定容时俯视刻度线
⑤摇匀后液面下降,再补充水
⑥未冷却至室温就加水定容至刻度线
II.绿矾的制备流程图如图所示

(5)滤渣的主要化学成分是
(6)向溶液X中加入过量的铁粉,发生的主要反应的离子方程式为
(7)绿矾长期放置于空气中会变质,原因是
您最近一年使用:0次
名校
解题方法
9 . 明矾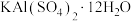 在日常生活中用途非常广泛。用废铝灰(含Al、
在日常生活中用途非常广泛。用废铝灰(含Al、 、Fe、
、Fe、 、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
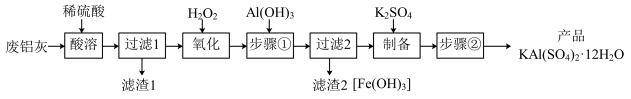
已知: 开始沉淀到沉淀完全时溶液的pH为1.9~3.7;
开始沉淀到沉淀完全时溶液的pH为1.9~3.7; 开始沉淀到完全沉淀时溶液的pH为5.5~8.5。
开始沉淀到完全沉淀时溶液的pH为5.5~8.5。
(1)“酸溶”时, 溶解的离子方程式为
溶解的离子方程式为_____ 。
(2)“氧化”时,发生反应的离子方程式为_____ 。
(3)“步骤①”调节pH约为3.7的目的是_____ ;检验“过滤2”滤液中是否含 可用试剂
可用试剂_____ 。
(4)“步骤②”包含的操作有_____ 、_____ 、过滤、洗涤及干燥。
(5)已知废铝灰中铝元素的含量为a%,则mkg废铝灰理论上可制得明矾_____ kg。
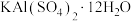 在日常生活中用途非常广泛。用废铝灰(含Al、
在日常生活中用途非常广泛。用废铝灰(含Al、 、Fe、
、Fe、 、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
、FeO等)为原料制取明矾的工艺流程如下图。回答下列问题:
已知:
 开始沉淀到沉淀完全时溶液的pH为1.9~3.7;
开始沉淀到沉淀完全时溶液的pH为1.9~3.7; 开始沉淀到完全沉淀时溶液的pH为5.5~8.5。
开始沉淀到完全沉淀时溶液的pH为5.5~8.5。(1)“酸溶”时,
 溶解的离子方程式为
溶解的离子方程式为(2)“氧化”时,发生反应的离子方程式为
(3)“步骤①”调节pH约为3.7的目的是
 可用试剂
可用试剂(4)“步骤②”包含的操作有
(5)已知废铝灰中铝元素的含量为a%,则mkg废铝灰理论上可制得明矾
您最近一年使用:0次
名校
解题方法
10 . 某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
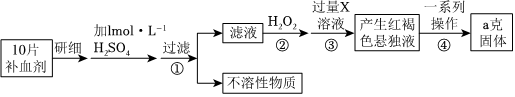
注:④中的一系列操作包括:过滤→洗涤→灼烧
请回答下列问题:
(1)用18.4mol•L-1的浓硫酸,配制100mL1mol•L-1的硫酸溶液,所需浓硫酸的体积为______ mL(计算结果精确到小数点后一位)。
(2)在下列配制过程示意图中,有错误的是______ (填写序号)。

(3)下列说法正确的______ 。
(4)验证步骤(2)反应后的溶液中是否含Fe2+,下列检验试剂选用正确的是______ 。
A.用氯水、KSCN溶液检验是否有Fe2+
B.用酸性KMnO4溶液检验是否有Fe2+
C.用NaOH溶液检验是否有Fe2+
(5)步骤(2)加入过量H2O2发生反应的离子方程式为:______ 。

注:④中的一系列操作包括:过滤→洗涤→灼烧
请回答下列问题:
(1)用18.4mol•L-1的浓硫酸,配制100mL1mol•L-1的硫酸溶液,所需浓硫酸的体积为
(2)在下列配制过程示意图中,有错误的是

(3)下列说法正确的
| A.洗涤烧杯和玻璃棒2至3次,并将洗涤液移入容量㼛以减少误差 |
| B.某同学将浓硫酸稀秚后未冷却至定温便将溶液转移至容量瓶,所配溶液浓度会偏低 |
| C.定容时仰视观察,所配溶液浓度会偏低 |
| D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可 |
(4)验证步骤(2)反应后的溶液中是否含Fe2+,下列检验试剂选用正确的是
A.用氯水、KSCN溶液检验是否有Fe2+
B.用酸性KMnO4溶液检验是否有Fe2+
C.用NaOH溶液检验是否有Fe2+
(5)步骤(2)加入过量H2O2发生反应的离子方程式为:
您最近一年使用:0次
2024-03-16更新
|
93次组卷
|
2卷引用:河南省信阳高级中学2023-2024学年高一下学期开学化学试题



