名校
1 . 化学小组探究 与
与 是否存在反应,实验过程如下图所示。
是否存在反应,实验过程如下图所示。
 与
与 是否存在反应,实验过程如下图所示。
是否存在反应,实验过程如下图所示。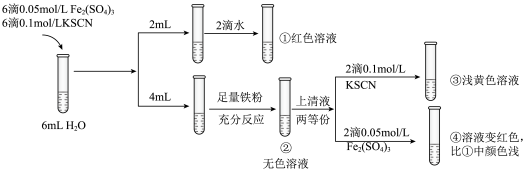
A.②中溶液无色是因为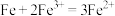 ,导致平衡 ,导致平衡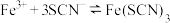 逆向移动 逆向移动 |
B.③中溶液略显黄色,可能是因为②→③过程中 被空气氧化 被空气氧化 |
C.④中溶液颜色比①浅,说明 与 与 反应导致 反应导致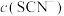 减小 减小 |
D.将向①中加入的2滴水改为2滴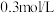  溶液,两次实验后的溶液颜色相同 溶液,两次实验后的溶液颜色相同 |
您最近一年使用:0次
2024-06-06更新
|
135次组卷
|
2卷引用:北京市第二中学2023-2024学年高三下学期三模化学试题
解题方法
2 . 下列过程与氧化还原反应有关的是
A.用 去除废水中的 去除废水中的 | B.用 净水 净水 |
C.用 对自来水消毒 对自来水消毒 | D.由海水制取蒸馏水 |
您最近一年使用:0次
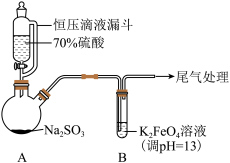
3 . 某实验小组探究SO2与K2FeO4的反应,实验如下。
资料:i.K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
ii.Fe3+可以与C2O 形成[Fe(C2O4)3]3-;
形成[Fe(C2O4)3]3-;
(1)A中产生SO2的化学方程式为___________ 。
(2)暗红褐色沉淀X可能含Fe3+、OH-、SO 、SO
、SO ,检验如下:
,检验如下:
实验二:向X中加入足量盐酸,沉淀溶解。取少量溶液,滴加KSCN溶液后变红。证明溶液中存在___________ 。另取少量溶液滴加BaCl2溶液,产生白色沉淀,但不能确认含有SO ,原因是
,原因是___________ 。
实验三:向X中加入H2C2O4溶液,沉淀溶解。继续滴加BaCl2溶液,产生白色沉淀,过滤后,向沉淀中加入盐酸,白色沉淀溶解。确认X中不含SO 。
。
实验三中用H2C2O4溶液溶解沉淀的目的是:___________ 。
实验四:向X中加入足量盐酸,沉淀溶解。加入几滴碘水(含淀粉),蓝色立即褪去。静置,一段时间后蓝色复现,振荡,不褪色。
结合离子方程式解释沉淀溶解后的现象:___________ 。
(3)查阅资料:a.Fe3+、SO 、H2O(或OH﹣)会形成配合物HOFeOSO2。
、H2O(或OH﹣)会形成配合物HOFeOSO2。 和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
①向溶液Y中滴加2滴KSCN溶液,未见红色;再加几滴6mol·L-1盐酸,溶液变红。溶液Y中存在Fe(Ⅲ),但直接滴加KSCN溶液未见红色的原因是___________ 。
②取出部分实验一中的橙色溶液,久置不褪色。结合资料a中过程ii分析实验一中溶液最终“几乎无色”的原因:___________ 。
总结:SO2与K2FeO4发生了氧化还原反应和复分解反应,并且遵循化学反应速率和限度规律。
资料:i.K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
ii.Fe3+可以与C2O
 形成[Fe(C2O4)3]3-;
形成[Fe(C2O4)3]3-;| 装置 | 操作及现象 |
| 实验一:向B中通入SO2,产生暗红褐色沉淀X和溶液Y(略显红色);继续通入SO2一段时间后,溶液呈红色,继而变为橙色,最终沉淀消失,溶液几乎无色。 |
(1)A中产生SO2的化学方程式为
(2)暗红褐色沉淀X可能含Fe3+、OH-、SO
 、SO
、SO ,检验如下:
,检验如下:实验二:向X中加入足量盐酸,沉淀溶解。取少量溶液,滴加KSCN溶液后变红。证明溶液中存在
 ,原因是
,原因是实验三:向X中加入H2C2O4溶液,沉淀溶解。继续滴加BaCl2溶液,产生白色沉淀,过滤后,向沉淀中加入盐酸,白色沉淀溶解。确认X中不含SO
 。
。实验三中用H2C2O4溶液溶解沉淀的目的是:
实验四:向X中加入足量盐酸,沉淀溶解。加入几滴碘水(含淀粉),蓝色立即褪去。静置,一段时间后蓝色复现,振荡,不褪色。
结合离子方程式解释沉淀溶解后的现象:
(3)查阅资料:a.Fe3+、SO
 、H2O(或OH﹣)会形成配合物HOFeOSO2。
、H2O(或OH﹣)会形成配合物HOFeOSO2。
 和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
①向溶液Y中滴加2滴KSCN溶液,未见红色;再加几滴6mol·L-1盐酸,溶液变红。溶液Y中存在Fe(Ⅲ),但直接滴加KSCN溶液未见红色的原因是
②取出部分实验一中的橙色溶液,久置不褪色。结合资料a中过程ii分析实验一中溶液最终“几乎无色”的原因:
总结:SO2与K2FeO4发生了氧化还原反应和复分解反应,并且遵循化学反应速率和限度规律。
您最近一年使用:0次
名校
解题方法
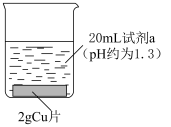
4 . 还原铁粉与水蒸气的反应装置如图所示。取少量反应后的固体加入稀硫酸使其完全溶解得溶液a;另取少量反应后的固体加入稀硝酸使其完全溶解,得溶液b.下列说法正确的是
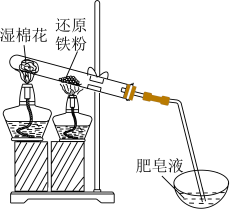
A.铁与水蒸气反应: |
B.肥皂液中产生气泡,不能证明铁与水蒸气反应生成 |
C.向溶液a中滴加 溶液,出现蓝色沉淀,说明铁粉未完全反应 溶液,出现蓝色沉淀,说明铁粉未完全反应 |
D.向溶液b中滴加 溶液,溶液变红,证实了固体中含有 溶液,溶液变红,证实了固体中含有 |
您最近一年使用:0次
2024-04-10更新
|
1055次组卷
|
6卷引用:北京市西城区2024届高三统一测试(一模)化学试题
北京市西城区2024届高三统一测试(一模)化学试题(已下线)化学(北京卷03)-2024年高考押题预测卷2024届河南省焦作市博爱县第一中学高三下学期三模化学试题(已下线)2024年东北三省四校高三下学期第四次模拟考试化学试卷东北三省三校2023-2024学年高三四模化学试卷 (已下线)题型6 元素及其化合物 化学实验基础(25题)-2024年高考化学常考点必杀300题(新高考通用)
5 . 下列依据实验现象得到的结论正确的是
| 选项 | 实验 | 实验现象 | 结论 |
| A | 将稀硫酸加入铁粉中,再滴加 溶液 溶液 | 溶液呈红色 | 稀硫酸将 氧化为 氧化为 |
 | 将铜粉加入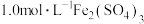 溶液中 溶液中 | 溶液变蓝 | 金属铁比铜活泼 |
| C | 加热盛有少量 固体的试管,并在试管口放置湿润的红色石蕊试纸 固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 |  显碱性 显碱性 |
| D | 向两支盛有 相同浓度的银氨溶液的试管中分别加入2滴相同浓度的 相同浓度的银氨溶液的试管中分别加入2滴相同浓度的 和 和 溶液 溶液 | 一支试管中产生黄色沉淀,另一支中无明显现象 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
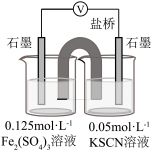
6 . 某研究小组探究Fe3+盐溶液与Cu的反应,进行了如下实验。
资料:i.CuCl、CuSCN是难溶于水的白色固体;
ii.Fe2+ + NO⇌[Fe(NO)]2+ (棕色)。
(1)用化学用语解释Fe3+盐溶液显酸性的原因___________ 。
(2)实验I中发生反应的离子方程式为___________ 。
(3)小组同学取2 mL实验I中反应2天后的溶液于试管中,加入2滴1 mol·L-1 KSCN溶液,观察到溶液迅速变红,产生大量白色沉淀。
甲同学猜想Fe2+可能在该条件下被Cu2+氧化了。
①用离子方程式表示甲同学的猜想___________ 。
②甲同学通过实验证实了其猜想,实验方案是___________ 。
(4)对比实验I和实验Ⅱ,小组同学推测Cl-可以催化Fe3+与Cu反应。其理由是___________ 。
(5)实验Ⅱ中产生大量红褐色沉淀的原因是___________ 。
(6)实验Ⅲ所得溶液的颜色不是蓝色,小组同学猜测反应中生成了[Fe(NO)]2+,设计并实施了以下实验,验证了其猜想。
试剂X是___________ 。
综合以上实验,Fe3+盐溶液与Cu反应的多样性与阴离子种类、生成物存在形式等有关。
| 实验装置 | 序号 | 试剂a | 实验现象 |
| I | 0.25 mol·L-1Fe2(SO4)3溶液 | 溶液逐渐变为蓝色。2天后,Cu片有较大量剩余,溶液仍为蓝色 |
| Ⅱ | 0.5 mol·L-1FeCl3溶液 | 溶液逐渐变为蓝绿色,铜片表面覆盖有白色固体(经检验为CuCl)。2天后,白色固体消失,Cu片无剩余,溶液中产生大量红褐色沉淀 | |
| Ⅲ | 0.5 mol·L-1 Fe(NO3)3溶液 | 溶液逐渐变为绿色,实验过程中未见气泡产生。 2天后,Cu片少量剩余,溶液中产生大量红褐色沉淀 |
ii.Fe2+ + NO⇌[Fe(NO)]2+ (棕色)。
(1)用化学用语解释Fe3+盐溶液显酸性的原因
(2)实验I中发生反应的离子方程式为
(3)小组同学取2 mL实验I中反应2天后的溶液于试管中,加入2滴1 mol·L-1 KSCN溶液,观察到溶液迅速变红,产生大量白色沉淀。
甲同学猜想Fe2+可能在该条件下被Cu2+氧化了。
①用离子方程式表示甲同学的猜想
②甲同学通过实验证实了其猜想,实验方案是
(4)对比实验I和实验Ⅱ,小组同学推测Cl-可以催化Fe3+与Cu反应。其理由是
(5)实验Ⅱ中产生大量红褐色沉淀的原因是
(6)实验Ⅲ所得溶液的颜色不是蓝色,小组同学猜测反应中生成了[Fe(NO)]2+,设计并实施了以下实验,验证了其猜想。
| 步骤 | 实验操作 | 实验现象 |
| ① | 向盛有2 g金属Cu片的烧杯中加入试剂X | 2天后溶液颜色无明显变化,铜片表面有细小气泡附着 |
| ② | 继续加入少量FeSO4固体 | 溶液迅速变为浅棕色 |
综合以上实验,Fe3+盐溶液与Cu反应的多样性与阴离子种类、生成物存在形式等有关。
您最近一年使用:0次
2024-04-01更新
|
323次组卷
|
3卷引用:北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题
名校
解题方法
7 . 室温下,下列实验探究方案能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加KSCN溶液,观察溶液颜色变化 | 食品脱氧剂样品中有无+3价铁 |
| B | 用pH计测量等浓度的醋酸、盐酸的pH,比较溶液pH大小 |  是弱电解质 是弱电解质 |
| C | 向浓HNO3中插入红热的炭,观察生成气体的颜色 | 炭可与浓HNO3反应生成NO2 |
| D | 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至碱性,再加少量碘水,观察溶液颜色变化 | 淀粉溶液在稀硫酸和加热条件下是否水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-27更新
|
1207次组卷
|
2卷引用:北京市中国人民大学附属中学2023届高三三模化学试题
名校
解题方法
8 . 某小组研究SCN-分别与Cu2+和Fe3+的反应:
下列说法不正确的是
| 编号 | 1 | 2 | 3 |
| 实验 |
|
|
|
| 现象 | 溶液变为黄绿色,产生白色沉淀(白色沉淀为CuSCN) | 溶液变红,向反应后的溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀,且沉淀量逐渐增多 | 接通电路后,电压表指针不偏转。一段时间后,取出左侧烧杯中少量溶液,滴加K3[Fe(CN)6]溶液,没有观察到蓝色沉淀 |
| A.实验1中发生了氧化还原反应,KSCN为还原剂 |
| B.实验2中“溶液变红”是Fe3+与SCN-结合形成了配合物 |
| C.若将实验3中Fe2(SO4)3溶液替换为0.25 mol/LCuSO4溶液,接通电路后,可推测出电压表指针会发生偏转 |
| D.综合实验1~3,微粒的氧化性与还原产物的价态和状态有关 |
您最近一年使用:0次
2023-03-24更新
|
836次组卷
|
6卷引用:北京市丰台区2022-2023学年高三下学期第一次模拟练习化学试题
9 . 根据下列实验现象能得出相应结论的是
| 实验 | 现象 | 结论 | |
| A. | 向2 mL 0.1 mol·L 的 的 溶液中加足量铁粉,振荡,加1滴KSCN 溶液中加足量铁粉,振荡,加1滴KSCN | 溶液黄色逐渐消失,加KSCN溶液颜色不变 | KSCN过少,因此溶液颜色不变 |
| B. | 将乙烯通入溴的四氯化碳溶液 | 溶液变为无色 | 生成的1,2-二溴乙烷无色、可溶于四氯化碳 |
| C. | 氨水中滴加酚酞溶液 | 溶液变红 |  是弱碱 是弱碱 |
| D. | 将金属钠在燃烧匙中点燃,迅速伸入集满 的集气瓶 的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |  既不做氧化剂也不做还原剂 既不做氧化剂也不做还原剂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10 . 工业上湿法冶炼金属锌,通常先将含锌矿石焙烧。锌焙烧矿再加稀硫酸浸出,所得浸出液中含Zn2+和Fe2+、Fe3+等杂质。铁元素的存在对后续电解锌有害。从锌浸出液中沉铁的方法有多种,其中将铁以针铁矿(FeOOH)形式沉淀,铁渣易过滤。其工艺流程如下:

已知:i.滤渣1的主要成分是硫单质;
ii.滤渣2中铁元素的存在形态为FeOOH;
iii.溶液中Fe3+浓度小于1g/L,才能顺利析出FeOOH晶体。溶液pH较大时,Fe3+水解主要生成氢氧化铁胶体。
(1)酸浸:
能加快锌焙烧矿浸出速率的措施有_______ 。
A.加热 B.粉碎锌焙烧矿 C.降低稀硫酸的浓度
(2)还原:
①为了便于沉铁时调控溶液中Fe3+浓度,向锌浸出液中加入过量ZnS精矿先将Fe3+还原为Fe2+,该反应的离子方程式:_______ (已知室温时,Ksp(ZnS)=2.5×10-22)
②检验滤液1中是否含Fe3+的方法是_______ 。
(3)沉铁:
溶液pH对铁去除率的影响实验结果如下图所示:

①从图中数据来看,沉铁的最佳pH为_______ 。
②结合图中数据,解释pH偏小或偏大都不利于沉铁的原因是_______ 。
(4)除氟:
通常锌浸出液中还有一定量的氟离子,氟离子浓度过高也会影响电解锌。FeOOH对F-有吸附作用。若将流程中ZnO更换为CaO,可进一步显著提高F-去除率。若要求滤液2中氟离子含量在38mg/L以下,则滤液2中所含Ca2+的浓度至少为_______ mol/L。(已知室温时, )
)

已知:i.滤渣1的主要成分是硫单质;
ii.滤渣2中铁元素的存在形态为FeOOH;
iii.溶液中Fe3+浓度小于1g/L,才能顺利析出FeOOH晶体。溶液pH较大时,Fe3+水解主要生成氢氧化铁胶体。
(1)酸浸:
能加快锌焙烧矿浸出速率的措施有
A.加热 B.粉碎锌焙烧矿 C.降低稀硫酸的浓度
(2)还原:
①为了便于沉铁时调控溶液中Fe3+浓度,向锌浸出液中加入过量ZnS精矿先将Fe3+还原为Fe2+,该反应的离子方程式:
②检验滤液1中是否含Fe3+的方法是
(3)沉铁:
溶液pH对铁去除率的影响实验结果如下图所示:

①从图中数据来看,沉铁的最佳pH为
②结合图中数据,解释pH偏小或偏大都不利于沉铁的原因是
(4)除氟:
通常锌浸出液中还有一定量的氟离子,氟离子浓度过高也会影响电解锌。FeOOH对F-有吸附作用。若将流程中ZnO更换为CaO,可进一步显著提高F-去除率。若要求滤液2中氟离子含量在38mg/L以下,则滤液2中所含Ca2+的浓度至少为
 )
)
您最近一年使用:0次
2023-01-11更新
|
288次组卷
|
2卷引用:北京市通州区2022-2023学年高三上学期摸底考试化学试卷