名校
解题方法
1 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(2)在实验室中,FeCl3可以用铁粉与_______ 反应制备,保存FeCl2溶液会加入少量铁屑,其原理是_______ (用化学方程式表示)。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①甲同学取少量待测溶液﹐滴入_______ (写出试剂名称),溶液呈红色,证明溶液中含有Fe3+。
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是_______ 。(用离子方程式和必要的文字进行解释)已知:氧化性KMnO4>Cl2
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为_______ 。
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
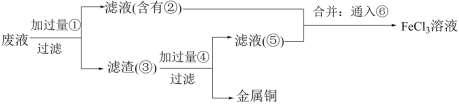
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:_______ 。用H2O2代替⑥也能实现实验目的。请写出加入H2O2的离子方程式:_______ 。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)在实验室中,FeCl3可以用铁粉与
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
①甲同学取少量待测溶液﹐滴入
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
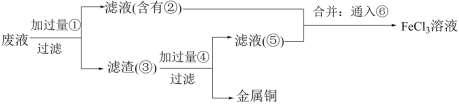
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:
您最近一年使用:0次
2022-04-05更新
|
407次组卷
|
2卷引用:四川省成都市龙泉驿区教育科学研究院2021-2022学年高二下学期期中考试化学试卷
2 . 某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
(1)已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。________________ ;该反应中氧化剂是_____ ;若有0.75mol电子转移,则被还原的氧化剂粒子数为_______ 。(用NA表示)
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是______ (填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性: 维生素C > Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________ 。
| 药品 | NaNO2 (亚硝酸钠) |
| 性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是
A.NaNO2被还原 B.维生素C具有还原性
C.还原性: 维生素C > Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:
您最近一年使用:0次
2018-01-31更新
|
533次组卷
|
6卷引用:四川省成都市2017-2018学年高一上期期末调研考试化学试题
名校
3 . 硫酸亚铁是一种重要的工业原料,同时也可以用于制造补血药物,但其具有毒性,故严禁在食品中滥用硫酸亚铁,请回答下列问题:
I.
(1)下列说法中正确的是___________(填字母)。
II.某同学为探究富含硫酸亚铁且保存时间较长的糕点情况,设计了如下实验方案:

(2)试剂1的名称是___________ ,FeSO4固体应___________ 保存。
(3)加入新制氯水后,溶液红色加深的原因是___________ (用离子方程式表示)。
(4)该同学实验中加入过量新制氯水,放置一段时间后,深红色褪去,现对褪色原因进行探究(已知SCN-有还原性)。
①【提出假设】假设1:溶液中的+3价铁被氧化为更高的价态。
假设2:___________ 。
②【设计方案】为了对假设2进行验证,简述你的设计方案:___________ 。
(5)将铜片放入0.1mol/LFeCl3溶液中浸泡,一段时间,溶液中c(Fe3+):c(Fe2+)=2:3,则此时Cu2+与Fe3+的物质的量之比为_______ 。再过一段时间,取出铜片称量铜片减轻了3.2g,在浸泡液中加入足量的铁粉使之充分反应,过滤并干燥固体,固体质量比加入的铁粉质量减少了2.4g,参与反应的铁粉的质量是_______ g。
I.
(1)下列说法中正确的是___________(填字母)。
| A.可以使用纯碱作糕点膨化剂 |
| B.大量服用FeSO4导致人体中毒可能与其还原性有关 |
| C.向FeSO4溶液中加入铜粉可析出铁单质 |
| D.向FeSO4溶液中加入少许铁粉,其目的是防止Fe2+被还原 |
II.某同学为探究富含硫酸亚铁且保存时间较长的糕点情况,设计了如下实验方案:

(2)试剂1的名称是
(3)加入新制氯水后,溶液红色加深的原因是
(4)该同学实验中加入过量新制氯水,放置一段时间后,深红色褪去,现对褪色原因进行探究(已知SCN-有还原性)。
①【提出假设】假设1:溶液中的+3价铁被氧化为更高的价态。
假设2:
②【设计方案】为了对假设2进行验证,简述你的设计方案:
(5)将铜片放入0.1mol/LFeCl3溶液中浸泡,一段时间,溶液中c(Fe3+):c(Fe2+)=2:3,则此时Cu2+与Fe3+的物质的量之比为
您最近一年使用:0次
解题方法
4 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式_______ 。
(2)公元8世纪左右,我国炼丹士开始将硫酸亚铁加热到500℃左右,生成氧化铁和硫的氧化物,反应的化学方程式是_______ 。此法是最早生产硫酸的关键反应,当时若有m kg硫酸亚铁可生成_______ kg50%的硫酸(填写计算表达式)。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。高铁酸钠生产方法之一是电解法,其原理为aFe+bNaOH+cH2O dNa2FeO4+eH2;该反应中若a=1,则e=
dNa2FeO4+eH2;该反应中若a=1,则e=_______ 。
(4)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①在碱性条件下,湿法生产高铁酸钾的离子反应方程式是_______ 。
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为_______ mol。
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式
(2)公元8世纪左右,我国炼丹士开始将硫酸亚铁加热到500℃左右,生成氧化铁和硫的氧化物,反应的化学方程式是
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。高铁酸钠生产方法之一是电解法,其原理为aFe+bNaOH+cH2O
 dNa2FeO4+eH2;该反应中若a=1,则e=
dNa2FeO4+eH2;该反应中若a=1,则e=(4)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①在碱性条件下,湿法生产高铁酸钾的离子反应方程式是
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为
您最近一年使用:0次
名校
5 . (1)已知:用毛笔蘸取少量30%的FeCl3溶液在铜片上写一个“Cu”,放置片刻后用少量蒸馏水冲洗铜片后,在铜片上会出现凹凸的“Cu”,写出该反应的离子方程式:___________ 。
(2)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,其反应可表示为:Fe(OH)3+ClO-+OH-= +Cl-+□请将该方程补充并配平,并在方程式上面用“双线桥”标出电子转移的方向与数目
+Cl-+□请将该方程补充并配平,并在方程式上面用“双线桥”标出电子转移的方向与数目________ 。
(3)某同学在做Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的一次实验中,用过量的稀硝酸(其密度为1.05 g/mL,HNO3的质量分数为12%)跟一定量的铁片反应,产生了标准状况下0.56 L的一氧化氮,该稀硝酸的物质的量浓度为___________ ,被还原的HNO3的物质的量为___________ ,转移电子的数目为___________ 。
(2)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,其反应可表示为:Fe(OH)3+ClO-+OH-=
 +Cl-+□请将该方程补充并配平,并在方程式上面用“双线桥”标出电子转移的方向与数目
+Cl-+□请将该方程补充并配平,并在方程式上面用“双线桥”标出电子转移的方向与数目(3)某同学在做Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的一次实验中,用过量的稀硝酸(其密度为1.05 g/mL,HNO3的质量分数为12%)跟一定量的铁片反应,产生了标准状况下0.56 L的一氧化氮,该稀硝酸的物质的量浓度为
您最近一年使用:0次
名校
6 . “价类”二维图是学习元素及其化合物的重要工具,如图所示是铁及其化合物的“价类”二维图。
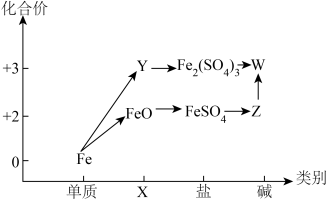
(1)X、Y分别代表_______ 、_______ ;Z在空气中转化为W的化学方程式为_______ 。
(2)某小组研究 性质,预测
性质,预测 能与
能与_______ 发生氧化还原反应(填序号)。
①NaOH溶液②氯水③稀盐酸④酸性 溶液⑤镁⑥碳酸钠
溶液⑤镁⑥碳酸钠
(3)往FeBr2溶液中通入一定量氯气,已知n(FeBr2)∶n(Cl2)=1,写出该反应的离子方程式_______ 。
(4)为检验食品中的铁元素,可将菠菜剪碎、研磨、溶解、_______ ,然后将少许滤液加入试管中,加入少量稀硝酸(稀硝酸具有氧化性),再滴加几滴KSCN溶液,振荡,若观察到_______ 现象,说明试验样品中含有铁元素。
(5)高铁酸钠是一种能杀菌、脱色、除臭的新型高效水处理剂。工业上可用 氧化
氧化 的方法制备
的方法制备 ,其原理为
,其原理为 ,用双线桥法表示该反应的电子转移方向和数目
,用双线桥法表示该反应的电子转移方向和数目_______ 。

(1)X、Y分别代表
(2)某小组研究
 性质,预测
性质,预测 能与
能与①NaOH溶液②氯水③稀盐酸④酸性
 溶液⑤镁⑥碳酸钠
溶液⑤镁⑥碳酸钠(3)往FeBr2溶液中通入一定量氯气,已知n(FeBr2)∶n(Cl2)=1,写出该反应的离子方程式
(4)为检验食品中的铁元素,可将菠菜剪碎、研磨、溶解、
(5)高铁酸钠是一种能杀菌、脱色、除臭的新型高效水处理剂。工业上可用
 氧化
氧化 的方法制备
的方法制备 ,其原理为
,其原理为 ,用双线桥法表示该反应的电子转移方向和数目
,用双线桥法表示该反应的电子转移方向和数目
您最近一年使用:0次
名校
7 . 高铁酸钠( )具有很强的氧化性,是一种优良的多功能水处理剂,工业上制备高铁酸钠有两种方法,主要反应原理如下:
)具有很强的氧化性,是一种优良的多功能水处理剂,工业上制备高铁酸钠有两种方法,主要反应原理如下:
①湿法制备:___________ ___________
___________ ___________
___________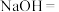 ___________
___________ ___________
___________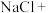 ___________
___________ (未配平)
(未配平)
②干法制备: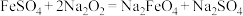
(1) 中Fe元素的化合价为
中Fe元素的化合价为___________ ,其在水溶液中的电离方程式为___________ 。
(2) 的电子式为
的电子式为___________ ,其与 反应的化学方程式为
反应的化学方程式为___________ 。
(3)配平反应①,并用“双线桥”标出中电子转移的方向和数目___________ 。该反应每生成1 mol  ,转移的电子数为
,转移的电子数为___________ 。
___________ ___________
___________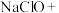 ___________
___________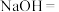 ___________
___________ ___________
___________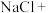 ___________
___________
(4)由反应②可知氧化性:
___________  (选填“<”或“>”)。
(选填“<”或“>”)。
(5) 在水中可被还原为
在水中可被还原为 ,其还原产物常用试剂
,其还原产物常用试剂___________ 检验。 可作为优良水处理剂的原因是
可作为优良水处理剂的原因是___________ 。
 )具有很强的氧化性,是一种优良的多功能水处理剂,工业上制备高铁酸钠有两种方法,主要反应原理如下:
)具有很强的氧化性,是一种优良的多功能水处理剂,工业上制备高铁酸钠有两种方法,主要反应原理如下:①湿法制备:___________
 ___________
___________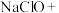 ___________
___________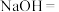 ___________
___________ ___________
___________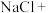 ___________
___________ (未配平)
(未配平)②干法制备:
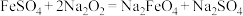
(1)
 中Fe元素的化合价为
中Fe元素的化合价为(2)
 的电子式为
的电子式为 反应的化学方程式为
反应的化学方程式为(3)配平反应①,并用“双线桥”标出中电子转移的方向和数目
 ,转移的电子数为
,转移的电子数为___________
 ___________
___________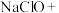 ___________
___________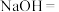 ___________
___________ ___________
___________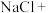 ___________
___________
(4)由反应②可知氧化性:

 (选填“<”或“>”)。
(选填“<”或“>”)。(5)
 在水中可被还原为
在水中可被还原为 ,其还原产物常用试剂
,其还原产物常用试剂 可作为优良水处理剂的原因是
可作为优良水处理剂的原因是
您最近一年使用:0次
2024-02-07更新
|
128次组卷
|
2卷引用:四川省 绵阳市东辰学校2023-2024学年高一上学期化学期末复习综合模拟试题1
名校
解题方法
8 . 化学是一门实用性很强的科学,请根据题意填空:
(1)铝合金和碳纤维复合材料是飞机、火箭的常用材料,这主要利用了它们具有的共同性能是密度___________ (填“大”或“小”),铝的在地壳中的含量比铁___________ (填“多”或“少”)。
(2)铝制餐具不宜长时间存放酸性、碱性食物,说明Al2O3属于___________ 氧化物,写出氧化铝与NaOH溶液反应的离子反应方程式___________ 。
(3)面粉发酵时会产生有机酸(用HA表示其化学式),影响口感。我们可以加入膨松剂(主要含NaHCO3),那么蒸出来的馒头蓬松柔软,且口感好。若加入过量的膨松剂,请写出相关反应的化学方程式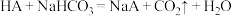 ,
,___________ ,由以上反应可知,酸性HA___________ H2CO3。
(4)电子工业用FeCl3溶液制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________ ,某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:首先取少量待测溶液﹐滴入___________ (填写试剂的名称)溶液呈红色,则溶液中含有的Fe3+,另取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、洗涤、干燥,称量沉淀质量为43.05g,则待测液中Cl-的物质的量浓度为___________ 。
(1)铝合金和碳纤维复合材料是飞机、火箭的常用材料,这主要利用了它们具有的共同性能是密度
(2)铝制餐具不宜长时间存放酸性、碱性食物,说明Al2O3属于
(3)面粉发酵时会产生有机酸(用HA表示其化学式),影响口感。我们可以加入膨松剂(主要含NaHCO3),那么蒸出来的馒头蓬松柔软,且口感好。若加入过量的膨松剂,请写出相关反应的化学方程式
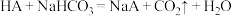 ,
,(4)电子工业用FeCl3溶液制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
您最近一年使用:0次
9 . 现有下列物质:① ②氢氧化铁胶体 ③氯气 ④铁粉 ⑤熔融
②氢氧化铁胶体 ③氯气 ④铁粉 ⑤熔融 ⑥NaOH溶液 ⑦HCl
⑥NaOH溶液 ⑦HCl
(1)上述能导电的电解质为_______ (填序号),其电离方程式为_______ 。
(2)①为_______ (“酸性”、“碱性”或“两性”)氧化物,其与⑥反应的离子方程式为_______ 。
(3)区分②和⑥的方法为_______ ,向②中通入⑦直至过量的现象为_______ 。
(4)一定量的④在③中燃烧的化学方程式为_______ ,向燃烧后的固体中加入足量的水,充分搅拌后有固体残留,则溶液中_______ (填“有”或“无”) ,能用于证明该结论的试剂为
,能用于证明该结论的试剂为_______ 。
 ②氢氧化铁胶体 ③氯气 ④铁粉 ⑤熔融
②氢氧化铁胶体 ③氯气 ④铁粉 ⑤熔融 ⑥NaOH溶液 ⑦HCl
⑥NaOH溶液 ⑦HCl(1)上述能导电的电解质为
(2)①为
(3)区分②和⑥的方法为
(4)一定量的④在③中燃烧的化学方程式为
 ,能用于证明该结论的试剂为
,能用于证明该结论的试剂为
您最近一年使用:0次
解题方法
10 . 铁及其化合物在生产、生活中有着广泛的应用。
(1)钢(一种铁碳合金)是用量最大、用途最广的合金。钢的硬度比纯铁_______ (填“大” 或“小”)。
(2)高铁酸钾(K2FeO4)是一种新型高效、无毒的多功能水处理剂,K2FeO4中Fe的化合价为_______ 。
(3)若一定量的普通铁粉和水蒸气在高温下反应生成44.8 LH2(标准状况),则转移电子的物质的量为_______ mol。
(4)FeSO4可作补血剂,用于治疗缺铁性贫血症。用FeSO4溶液制备Fe(OH)2的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的目的是_______ 。
(5)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,该反应的离子方程式为_______ ,检验反应后的溶液中是否还有三价铁离子的试剂是_______ 。
(6)聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,含少量碳及二氧化硅)为原料制备的流程如下:
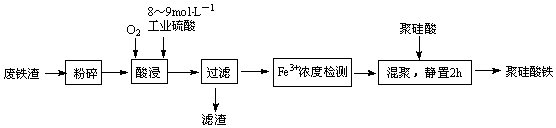
①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为_______ 。
②酸浸时,通入O2的目的是_______ 。
③“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+,再用酸性K2Cr2O7,标准溶液测定Fe2+的量(Cr2O 被还原为Cr3+),则SnCl2、Fe2+和Cr3+三者中还原性最强的是
被还原为Cr3+),则SnCl2、Fe2+和Cr3+三者中还原性最强的是_______ 。
(1)钢(一种铁碳合金)是用量最大、用途最广的合金。钢的硬度比纯铁
(2)高铁酸钾(K2FeO4)是一种新型高效、无毒的多功能水处理剂,K2FeO4中Fe的化合价为
(3)若一定量的普通铁粉和水蒸气在高温下反应生成44.8 LH2(标准状况),则转移电子的物质的量为
(4)FeSO4可作补血剂,用于治疗缺铁性贫血症。用FeSO4溶液制备Fe(OH)2的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的目的是
(5)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,该反应的离子方程式为
(6)聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,含少量碳及二氧化硅)为原料制备的流程如下:

①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为
②酸浸时,通入O2的目的是
③“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+,再用酸性K2Cr2O7,标准溶液测定Fe2+的量(Cr2O
 被还原为Cr3+),则SnCl2、Fe2+和Cr3+三者中还原性最强的是
被还原为Cr3+),则SnCl2、Fe2+和Cr3+三者中还原性最强的是
您最近一年使用:0次
2021-02-08更新
|
245次组卷
|
2卷引用:四川省内江市2020-2021学年高一上学期期末检测化学试题



