1 . Ⅰ.中国“奋斗号”载人潜水器在马里亚纳海沟成功坐底深度10909米,挑战了全球海洋最深处。国产新型钛合金、能源供给锂电池等功不可没。磷酸亚铁锂(LiFePO4)可作为锂电池的正极材料,请回答下列问题:
(1)潜水器外壳使用的钛合金
| A.耐高压 | B.耐腐蚀 | C.硬度小 | D.密度小 |
(2)磷酸亚铁锂(LiFePO4)中Fe的化合价为
(3)铁元素的相关信息如图所示,其相对原子质量是

(4)有关铁的性质,说法正确的是________。
| A.在空气中,加热Fe(OH)2可得FeO |
| B.一定条件下,Fe 能与水蒸气反应生成H2 |
| C.常温下,Fe与浓硫酸能反应生成SO2 |
| D.实验室用FeCl3溶液与NaOH溶液反应制备Fe(OH)3胶体 |
(5)古代中国四大发明之一的司南是由天然的磁石制成的,其主要成分是________。
| A.Fe | B.FeO | C.Fe2O3 | D.Fe3O4 |
(6)要检验Fe3+,可选用的试剂是________。
| A.KSCN 溶液 | B.KMnO4溶液 | C.稀硝酸 | D.BaCl2溶液 |
Ⅱ.钠是生活中常见的金属元素,其多种化合物因其特殊性质在生活中都有广泛应用,例如,NaHCO3可用作食品膨松剂、Na2O2可用作供氧剂等。
(7)NaHCO3可用作膨松剂,原因是
(8)下列电离方程式正确的是________。
| A.NaOH = Na+ + O2-+ H+ | B.H2O = H+ + OH- |
C.HClO ClO-+ H+ ClO-+ H+ | D.CH3COONH4 CH3COO-+ NH4+ CH3COO-+ NH4+ |
(9)钠与滴加酚酞的水反应时
| A.钠浮在水面上 | B.钠熔成小球 | C.钠静止在水面上 | D.溶液变为红色 |
(10)Na2O2可作载人潜水器供氧剂,下列关于Na2O2说法正确的是________。
| A.只有离子键 | B.可在常温下由Na与O2反应制得 |
| C.Na2O2与H2O发生化合反应 | D.Na2O2与CO2反应有O2生成 |
您最近一年使用:0次
名校
解题方法
2 . 为探究 溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制:50 mL 1.0 mol⋅L-1的 溶液,测其pH约为0.7,即
溶液,测其pH约为0.7,即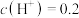 mol⋅L-1。用离子方程式解释
mol⋅L-1。用离子方程式解释 溶液呈酸性的原因:
溶液呈酸性的原因:___________ 。
(2)小组同学利用上述 溶液探究其与足量锌粉的反应。实验操作及现象如表:
溶液探究其与足量锌粉的反应。实验操作及现象如表:
已知:Zn的性质与Al相似,能发生反应:
①红褐色沉淀是:___________ (填化学式),结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:___________ 。
②反应后溶液为浅绿色,写出相关反应的离子方程式:___________ 。
③分离出黑色固体,经下列实验证实了其中含有的主要物质。
ⅰ.黑色固体可以被磁铁吸引;
ⅱ.向黑色固体中加入足量的NaOH溶液,产生气泡;
ⅲ.将ⅱ中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
ⅳ.向ⅲ反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是___________ 。
b.小组同学认为上述实验无法确定黑色固体中是否含有 ,理由是
,理由是___________ 。
(3)为进一步探究上述1.0 mol⋅L-1 溶液中
溶液中 和
和 氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
小组同学得出结论:在1.0 mol⋅L-1  溶液中,
溶液中, 的氧化性比
的氧化性比 更强。
更强。
 溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
溶液中的离子平衡和离子反应,某小组同学进行了如下实验。(1)配制:50 mL 1.0 mol⋅L-1的
 溶液,测其pH约为0.7,即
溶液,测其pH约为0.7,即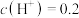 mol⋅L-1。用离子方程式解释
mol⋅L-1。用离子方程式解释 溶液呈酸性的原因:
溶液呈酸性的原因:(2)小组同学利用上述
 溶液探究其与足量锌粉的反应。实验操作及现象如表:
溶液探究其与足量锌粉的反应。实验操作及现象如表:| 操作 | 现象 |
向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 mol·L 的 的 溶液,搅拌 溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
| 收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |

①红褐色沉淀是:
②反应后溶液为浅绿色,写出相关反应的离子方程式:
③分离出黑色固体,经下列实验证实了其中含有的主要物质。
ⅰ.黑色固体可以被磁铁吸引;
ⅱ.向黑色固体中加入足量的NaOH溶液,产生气泡;
ⅲ.将ⅱ中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
ⅳ.向ⅲ反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是
b.小组同学认为上述实验无法确定黑色固体中是否含有
 ,理由是
,理由是(3)为进一步探究上述1.0 mol⋅L-1
 溶液中
溶液中 和
和 氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
氧化性的相对强弱,继续实验并观察到反应开始时现象如表:| 操作 | 现象 |
将5 mL 1.0 mol⋅L-1的 溶液与0.65 g锌粉混合 溶液与0.65 g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
| 将 | 溶液中立即产生大量气泡 |
 溶液中,
溶液中, 的氧化性比
的氧化性比 更强。
更强。
您最近一年使用:0次
名校
3 . 完成下列问题
(1)检验NH 的实验方法
的实验方法___________ ;
(2)检验FeCl2、FeCl3混合溶液中的Fe2+的实验方法___________ ;
(3)解释生石灰和浓氨水反应能放出NH3的原因___________ ;
(4)SO2通入品红溶液中,一段时间后加热的现象及原因___________ 。
(1)检验NH
 的实验方法
的实验方法(2)检验FeCl2、FeCl3混合溶液中的Fe2+的实验方法
(3)解释生石灰和浓氨水反应能放出NH3的原因
(4)SO2通入品红溶液中,一段时间后加热的现象及原因
您最近一年使用:0次
23-24高二上·全国·课时练习
解题方法
4 . 对于反应FeCl3+3KSCN Fe(SCN)3+3KCl,加入KCl固体平衡是否移动
Fe(SCN)3+3KCl,加入KCl固体平衡是否移动________ ?为什么________ ?
 Fe(SCN)3+3KCl,加入KCl固体平衡是否移动
Fe(SCN)3+3KCl,加入KCl固体平衡是否移动
您最近一年使用:0次
5 . 四氧化三铁(Fe3O4)俗称磁性氧化铁,在工业上应用广泛,可作催化剂、磁记录材料等。Fe3O4的一种制备方法如下:
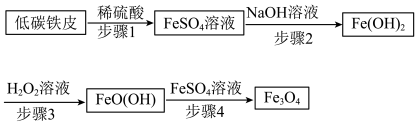
(1)低碳铁皮与稀硫酸反应时,会形成许多微小原电池。
①形成原电池时,Fe作___________ 。
A.正极 B.负极
②反应过程中,溶液的pH___________ 。
A.变大 B.变小 C.不变
(2)检验步骤1得到的FeSO4溶液中是否存在 ,可选用的试剂是___________。
,可选用的试剂是___________。
(3)实验室测定FeSO4溶液的浓度,常用K2Cr2O7标准溶液进行滴定。现称量2.940gK2Cr2O7(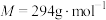 )固体,配制成
)固体,配制成 K2Cr2O7标准溶液。
K2Cr2O7标准溶液。
①称量时,需用到的仪器有___________ 。
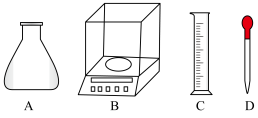
②根据计算,选用的容量瓶规格应为___________ 。
A.100mL B.250mL C.500mL D.1000mL
(4)步骤2用下图所示装置制备 。制备时,先打开止水夹,通入N2一段时间;再关闭止水夹,继续通入N2一段时间。
。制备时,先打开止水夹,通入N2一段时间;再关闭止水夹,继续通入N2一段时间。
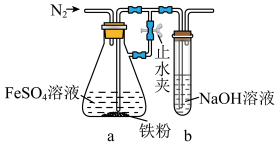
止水夹关闭前后,通入N2的作用分别为___________ 、___________ 。
(5)步骤3的反应原理为: 。反应中每消耗34gH2O2,转移的电子数为
。反应中每消耗34gH2O2,转移的电子数为___________ 。
(6)步骤4在不同时刻得到的Fe3O4粒径大小如下图所示。
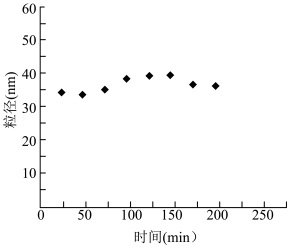
①实验过程中,Fe3O4不易形成沉淀,结合上图分析原因___________ 。
②写出一种可使Fe3O4较快形成沉淀的方法___________ 。

(1)低碳铁皮与稀硫酸反应时,会形成许多微小原电池。
①形成原电池时,Fe作
A.正极 B.负极
②反应过程中,溶液的pH
A.变大 B.变小 C.不变
(2)检验步骤1得到的FeSO4溶液中是否存在
 ,可选用的试剂是___________。
,可选用的试剂是___________。| A.KSCN溶液 | B.KMnO4溶液 | C.稀硝酸 | D.BaCl2溶液 |
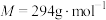 )固体,配制成
)固体,配制成 K2Cr2O7标准溶液。
K2Cr2O7标准溶液。①称量时,需用到的仪器有

②根据计算,选用的容量瓶规格应为
A.100mL B.250mL C.500mL D.1000mL
(4)步骤2用下图所示装置制备
 。制备时,先打开止水夹,通入N2一段时间;再关闭止水夹,继续通入N2一段时间。
。制备时,先打开止水夹,通入N2一段时间;再关闭止水夹,继续通入N2一段时间。
止水夹关闭前后,通入N2的作用分别为
(5)步骤3的反应原理为:
 。反应中每消耗34gH2O2,转移的电子数为
。反应中每消耗34gH2O2,转移的电子数为(6)步骤4在不同时刻得到的Fe3O4粒径大小如下图所示。

①实验过程中,Fe3O4不易形成沉淀,结合上图分析原因
②写出一种可使Fe3O4较快形成沉淀的方法
您最近一年使用:0次
6 . “氢分子沐足机”养生骗局:2022年央视曾曝光一起:“氢分子沐足机”养生骗局。商家称该机器能帮助身体排毒,并生成氢气抗衰老。将机器接通电源,观察到有气泡生成,机器底部不断产生红色的“毒素”沉淀。为了探究该机器的原理,某科学实验小组进行了探究:
(1)该科学小组采用原子发射光谱法确定了气体为氢气。以下现象与原子发射光谱原理相同的是___________。
A.焰色试验 B.白光透过光栅时产生不同颜色的光 C.滴定管液面处蓝线粗细不同
(2)该科学小组采用了X射线射法确定所谓“毒素”其实是 。有关X射线衍射法,下列说法不正确的是___________。
。有关X射线衍射法,下列说法不正确的是___________。
(3)该科学小组还利用化学方法辅助鉴定毒素成分以确定毒素确为 。取少量“毒素”样品,加入稀盐酸溶解,和
。取少量“毒素”样品,加入稀盐酸溶解,和 溶液,出现血红色,证明毒素样品中含
溶液,出现血红色,证明毒素样品中含 ,请写出溶液变为血红色的离子反应方程式
,请写出溶液变为血红色的离子反应方程式___________ 。
(4)除 溶液外,还可以使用亚铁氰化钾
溶液外,还可以使用亚铁氰化钾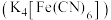 溶液鉴别
溶液鉴别 ,现象为生成蓝色沉淀
,现象为生成蓝色沉淀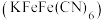 。
。 可由向
可由向 溶液中加入
溶液中加入 溶液制得。该反应开始时生成白色沉淀
溶液制得。该反应开始时生成白色沉淀 ,后白色沉淀溶解并析出晶体
,后白色沉淀溶解并析出晶体 ,请写出白色沉淀溶解析出晶体的离子方程式
,请写出白色沉淀溶解析出晶体的离子方程式___________ 。
(5) 是一种配位化合物,其配位数及配离子的空间构型为___________。
是一种配位化合物,其配位数及配离子的空间构型为___________。
(6)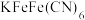 判断化合物中第一个
判断化合物中第一个 的化合价___________。
的化合价___________。
(7) 中,除了配位键外还存在
中,除了配位键外还存在___________ 键和___________ 键。
(8)若向题(3)中血红色溶液中加入 溶液,会观察到血红色褪去,生成
溶液,会观察到血红色褪去,生成 。请从配位键的强弱与离子反应发生条件角度说明为何该反应可以发生。
。请从配位键的强弱与离子反应发生条件角度说明为何该反应可以发生。___________
(9)经检测,该装置其实是一个电解装置,使用时,先向水中加入一勺食盐。请根据毒素成分及生成氢气,阴极材料选择惰性电极,阳极材料可选择___________ 。
(10)该装置的阳极反应为___________ 。
(11) 没有参与反应,请分析
没有参与反应,请分析 在整个装置中起到的作用
在整个装置中起到的作用___________ 。
(12)沐足机在使用过程中,铁质把手容易生锈。请提出一条缓解把手生锈的建议___________ 。
(13)该沐足机在维修时,内部电路正负极接反了,会造成严重的安全隐患,请结合方程式和文字描述可能出现的隐患___________ 。

(1)该科学小组采用原子发射光谱法确定了气体为氢气。以下现象与原子发射光谱原理相同的是___________。
A.焰色试验 B.白光透过光栅时产生不同颜色的光 C.滴定管液面处蓝线粗细不同
(2)该科学小组采用了X射线射法确定所谓“毒素”其实是
 。有关X射线衍射法,下列说法不正确的是___________。
。有关X射线衍射法,下列说法不正确的是___________。| A.X射线衍射法可以确定晶胞大小和形状 | B.X射线衍射法可以确定晶胞中的原子种类 |
| C.X射线衍射法可以确定晶胞中原子的位置排列 | D.X射线衍射法可能会损伤样品 |
 。取少量“毒素”样品,加入稀盐酸溶解,和
。取少量“毒素”样品,加入稀盐酸溶解,和 溶液,出现血红色,证明毒素样品中含
溶液,出现血红色,证明毒素样品中含 ,请写出溶液变为血红色的离子反应方程式
,请写出溶液变为血红色的离子反应方程式(4)除
 溶液外,还可以使用亚铁氰化钾
溶液外,还可以使用亚铁氰化钾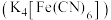 溶液鉴别
溶液鉴别 ,现象为生成蓝色沉淀
,现象为生成蓝色沉淀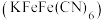 。
。 可由向
可由向 溶液中加入
溶液中加入 溶液制得。该反应开始时生成白色沉淀
溶液制得。该反应开始时生成白色沉淀 ,后白色沉淀溶解并析出晶体
,后白色沉淀溶解并析出晶体 ,请写出白色沉淀溶解析出晶体的离子方程式
,请写出白色沉淀溶解析出晶体的离子方程式(5)
 是一种配位化合物,其配位数及配离子的空间构型为___________。
是一种配位化合物,其配位数及配离子的空间构型为___________。| A.2,直线形 | B.3,平面三角形 | C.4,四面体形 | D.6,八面体形 |
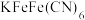 判断化合物中第一个
判断化合物中第一个 的化合价___________。
的化合价___________。| A.0价 | B. | C. | D. |
 中,除了配位键外还存在
中,除了配位键外还存在(8)若向题(3)中血红色溶液中加入
 溶液,会观察到血红色褪去,生成
溶液,会观察到血红色褪去,生成 。请从配位键的强弱与离子反应发生条件角度说明为何该反应可以发生。
。请从配位键的强弱与离子反应发生条件角度说明为何该反应可以发生。(9)经检测,该装置其实是一个电解装置,使用时,先向水中加入一勺食盐。请根据毒素成分及生成氢气,阴极材料选择惰性电极,阳极材料可选择
(10)该装置的阳极反应为
(11)
 没有参与反应,请分析
没有参与反应,请分析 在整个装置中起到的作用
在整个装置中起到的作用(12)沐足机在使用过程中,铁质把手容易生锈。请提出一条缓解把手生锈的建议
(13)该沐足机在维修时,内部电路正负极接反了,会造成严重的安全隐患,请结合方程式和文字描述可能出现的隐患

您最近一年使用:0次
名校
7 . 完成下列小题
(1)某氯化铁溶液中含有少量氯化亚铁杂质,除去氯化亚铁杂质应选用的试剂是_____
(2)根据反应 设计成原电池,下列说法正确的是_____
设计成原电池,下列说法正确的是_____
(3)实验室配置 溶液时,往往要在溶液中加入一定量的铁粉,其目的是
溶液时,往往要在溶液中加入一定量的铁粉,其目的是_____ , 溶液常常被用于溶解印刷电路板上的金属铜,其反应的离子方式为
溶液常常被用于溶解印刷电路板上的金属铜,其反应的离子方式为_____ 。
(4)设计实验检验某溶液中含有 而不含
而不含 ,实验方案为
,实验方案为_____ 。
(1)某氯化铁溶液中含有少量氯化亚铁杂质,除去氯化亚铁杂质应选用的试剂是_____
| A.氯水 | B.铁粉 | C.稀硝酸 | D.酸性高锰酸钾 |
 设计成原电池,下列说法正确的是_____
设计成原电池,下列说法正确的是_____| A.铁作正极、铜作负极、稀硫酸作电解质溶液 |
| B.铁作负极、铜作正极、硫酸铜溶液作电解质溶液 |
| C.电子通过稀硫酸从铁电极流向铜电极 |
| D.阳离子向正极方向定向移动 |
 溶液时,往往要在溶液中加入一定量的铁粉,其目的是
溶液时,往往要在溶液中加入一定量的铁粉,其目的是 溶液常常被用于溶解印刷电路板上的金属铜,其反应的离子方式为
溶液常常被用于溶解印刷电路板上的金属铜,其反应的离子方式为(4)设计实验检验某溶液中含有
 而不含
而不含 ,实验方案为
,实验方案为
您最近一年使用:0次
解题方法
8 . 如图所示是铁及其化合物的价类二维图。回答下列问题:_____ ,生铁在潮湿空气中主要发生_____ (填“析氢”或“吸氧”)腐蚀。
(2)工业上用赤铁矿(Fe2O3)冶炼Fe常用的方法是_____ (填标号)。
a.电解法 b.热还原法 c.热分解法 d.物理方法
(3)检验FeCl3和FeCl2混合溶液中Fe2+的操作是_____ ;除去FeCl2溶液中的少量FeCl3加入的最佳试剂为_____ 。
(4)Z在空气中很容易变成Y,该反应的化学方程式为_____ 。
(5)FeCl3和KI在水溶液中转化的离子反应有:2Fe3++2I- 2Fe2++I2,为了探究该反应存在一定的限度,某化学兴趣小组取10mL0.5mol·L-1的KI溶液于试管中,再加入10mL0.2mol·L-1的FeCl3溶液,振荡,使试管中的物质充分反应一段时间。为了达到实验目的,还需要再向试管中加入下列试剂中的_____(填标号)。
2Fe2++I2,为了探究该反应存在一定的限度,某化学兴趣小组取10mL0.5mol·L-1的KI溶液于试管中,再加入10mL0.2mol·L-1的FeCl3溶液,振荡,使试管中的物质充分反应一段时间。为了达到实验目的,还需要再向试管中加入下列试剂中的_____(填标号)。

(2)工业上用赤铁矿(Fe2O3)冶炼Fe常用的方法是
a.电解法 b.热还原法 c.热分解法 d.物理方法
(3)检验FeCl3和FeCl2混合溶液中Fe2+的操作是
(4)Z在空气中很容易变成Y,该反应的化学方程式为
(5)FeCl3和KI在水溶液中转化的离子反应有:2Fe3++2I-
 2Fe2++I2,为了探究该反应存在一定的限度,某化学兴趣小组取10mL0.5mol·L-1的KI溶液于试管中,再加入10mL0.2mol·L-1的FeCl3溶液,振荡,使试管中的物质充分反应一段时间。为了达到实验目的,还需要再向试管中加入下列试剂中的_____(填标号)。
2Fe2++I2,为了探究该反应存在一定的限度,某化学兴趣小组取10mL0.5mol·L-1的KI溶液于试管中,再加入10mL0.2mol·L-1的FeCl3溶液,振荡,使试管中的物质充分反应一段时间。为了达到实验目的,还需要再向试管中加入下列试剂中的_____(填标号)。| A.淀粉溶液 | B.KSCN溶液 |
| C.硝酸银溶液 | D.酸性高锰酸钾溶液 |
您最近一年使用:0次
9 . 中国“奋斗号”载人潜水器在马里亚纳海沟成功坐底深度10909米,挑战了全球海洋最深处。国产新型钛合金、能源供给锂电池等功不可没。磷酸亚铁锂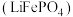 可作为锂电池的正极材料,请回答下列问题:
可作为锂电池的正极材料,请回答下列问题:
(1)潜水器外壳使用的钛合金不可能具有的性质是______(单选).
(2)锂电池工作时,将化学能转化为______ 。
(3)锂位于元素周期表中第______ 周期______ 族;磷酸亚铁锂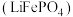 中
中 的化合价为
的化合价为______ .
(4)铁的原子结构示意图为 .由此可知,铁的原子序数为
.由此可知,铁的原子序数为______ ;x为______ ;铁元素是______ (双选).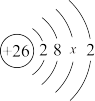 A.主族元素 B.副族元素 C.短周期元素 D.长周期元素
A.主族元素 B.副族元素 C.短周期元素 D.长周期元素
(5)古代中国四大发明之一的司南是由天然的磁石制成的,其主要成分是______(单选).
(6)能与 反应,且可证明
反应,且可证明 具有氧化性的是______(双选).
具有氧化性的是______(双选).
(7)除去氯化亚铁溶液中的氯化铁,需加入______ ,发生的离子反应为______ ,要检验废液中是否还存在 ,实验方案是
,实验方案是____________ 。
(8) 可作载人潜水器供氧剂,下列关于
可作载人潜水器供氧剂,下列关于 说法正确的是______(单选)。
说法正确的是______(单选)。
钛因为具有神奇的性能越来越引起人们的关注.常温下钛不与非金属、强酸反应。目前大规模生产钛的方法是,第一步将金红石(含 )、炭粉混合,在高温条件下通入
)、炭粉混合,在高温条件下通入 制得
制得 :
: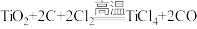 ①;第二步在氩气的气氛中,用过量的镁在加热条件下与
①;第二步在氩气的气氛中,用过量的镁在加热条件下与 反应制得金属钛:
反应制得金属钛: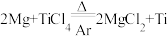 ②。
②。
(9)反应①的还原剂为______ ,反应消耗了标准状况下 氯气,则反应①转移的电子数为
氯气,则反应①转移的电子数为___ 。
(10)简述从反应②所得产物中获取金属钛的步骤:______________ 。
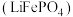 可作为锂电池的正极材料,请回答下列问题:
可作为锂电池的正极材料,请回答下列问题:(1)潜水器外壳使用的钛合金不可能具有的性质是______(单选).
| A.耐高压 | B.耐腐蚀 | C.硬度小 | D.密度小 |
(3)锂位于元素周期表中第
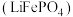 中
中 的化合价为
的化合价为(4)铁的原子结构示意图为
 .由此可知,铁的原子序数为
.由此可知,铁的原子序数为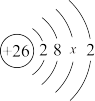 A.主族元素 B.副族元素 C.短周期元素 D.长周期元素
A.主族元素 B.副族元素 C.短周期元素 D.长周期元素(5)古代中国四大发明之一的司南是由天然的磁石制成的,其主要成分是______(单选).
A. | B. | C. | D. |
 反应,且可证明
反应,且可证明 具有氧化性的是______(双选).
具有氧化性的是______(双选).A. | B. | C. | D. |
 ,实验方案是
,实验方案是(8)
 可作载人潜水器供氧剂,下列关于
可作载人潜水器供氧剂,下列关于 说法正确的是______(单选)。
说法正确的是______(单选)。| A.只有离子键 | B.可在常温下由 与 与 反应制得 反应制得 |
C.与 发生化合反应 发生化合反应 | D.与 反应有 反应有 生成 生成 |
钛因为具有神奇的性能越来越引起人们的关注.常温下钛不与非金属、强酸反应。目前大规模生产钛的方法是,第一步将金红石(含
 )、炭粉混合,在高温条件下通入
)、炭粉混合,在高温条件下通入 制得
制得 :
: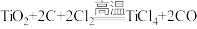 ①;第二步在氩气的气氛中,用过量的镁在加热条件下与
①;第二步在氩气的气氛中,用过量的镁在加热条件下与 反应制得金属钛:
反应制得金属钛: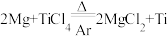 ②。
②。(9)反应①的还原剂为
 氯气,则反应①转移的电子数为
氯气,则反应①转移的电子数为(10)简述从反应②所得产物中获取金属钛的步骤:
您最近一年使用:0次
10 . 去除水体中砷的技术主要有物理吸附法及化学氧化法。
(1)物理吸附法
用活性面料负载纳米二氧化钛吸附水中的砷,纳米二氧化钛投加量对活性炭去除砷效果如图1所示:

①纳米二氧化钛投加量为___________ 时,砷的吸附量可达最大。随着纳米二氧化钛投加量继续增大,砷的吸附量反而减小,可能的原因是___________ 。
②未加二氧化钛时就有一定的吸附砷的能力,可能的原因是___________ 。
(2)化学氧化法
该方法须将废水中的As(Ⅲ)用空气或铁离子氧化为As(Ⅴ),然后再去除,为了探究As(Ⅲ)被哪种氧化剂氧化,设计如下实验:取含As(Ⅲ)废水,在pH分别为1~10条件下反应1h后,过滤,测定滤液中三价铁和二价铁的含量,得出不同pH下三价铁和二价铁的浓度随pH变化如图2所示:
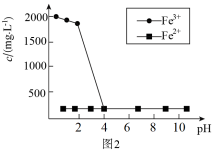
①pH在3~4时 浓度变化的主要原因为
浓度变化的主要原因为___________ 。
②由实验可知废水中的As(Ⅲ)主要被___________ 氧化为As(Ⅴ),理由为___________ 。
(1)物理吸附法
用活性面料负载纳米二氧化钛吸附水中的砷,纳米二氧化钛投加量对活性炭去除砷效果如图1所示:

①纳米二氧化钛投加量为
②未加二氧化钛时就有一定的吸附砷的能力,可能的原因是
(2)化学氧化法
该方法须将废水中的As(Ⅲ)用空气或铁离子氧化为As(Ⅴ),然后再去除,为了探究As(Ⅲ)被哪种氧化剂氧化,设计如下实验:取含As(Ⅲ)废水,在pH分别为1~10条件下反应1h后,过滤,测定滤液中三价铁和二价铁的含量,得出不同pH下三价铁和二价铁的浓度随pH变化如图2所示:

①pH在3~4时
 浓度变化的主要原因为
浓度变化的主要原因为②由实验可知废水中的As(Ⅲ)主要被
您最近一年使用:0次



