解题方法
1 . 铁及其化合物与生产、生活关系密切
(1)生铁(以赤铁矿为例)是通过高炉冶炼而得,用化学方程式表示其原理为__________
(2)在钢铁厂的生产中,炽热的铁水注入模具之前,必须对模具进行充分的干燥处理,不得留有水,原因是__________ (用化学方程式表示)
(3)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
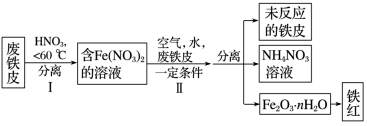
①步骤Ⅰ若要检验是否有Fe3+生成,方法是__________
②步骤Ⅱ中发生反应: ,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,能体现“绿色化学”思想的是
,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,能体现“绿色化学”思想的是__________ (任写一项)。
(4) Fe2O3可制取新型、高效水处理剂高铁酸钾K2FeO4
______ Fe2O3+______NaClO+______KOH ______ K2FeO4(高铁酸钾)+ _____NaCl+_____H2O
______ K2FeO4(高铁酸钾)+ _____NaCl+_____H2O
①K2FeO4中铁元素的化合价__________ ;配平上述反应__________ 。此过程中氧化剂是__________ (填化学式)。
②高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中反应生成氢氧化铁胶体。高铁酸钾作为水处理剂的作用是__________ 、__________ 。
(1)生铁(以赤铁矿为例)是通过高炉冶炼而得,用化学方程式表示其原理为
(2)在钢铁厂的生产中,炽热的铁水注入模具之前,必须对模具进行充分的干燥处理,不得留有水,原因是
(3)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤Ⅰ若要检验是否有Fe3+生成,方法是
②步骤Ⅱ中发生反应:
 ,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,能体现“绿色化学”思想的是
,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,能体现“绿色化学”思想的是(4) Fe2O3可制取新型、高效水处理剂高铁酸钾K2FeO4
______ Fe2O3+______NaClO+______KOH
 ______ K2FeO4(高铁酸钾)+ _____NaCl+_____H2O
______ K2FeO4(高铁酸钾)+ _____NaCl+_____H2O①K2FeO4中铁元素的化合价
②高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中反应生成氢氧化铁胶体。高铁酸钾作为水处理剂的作用是
您最近一年使用:0次
解题方法
2 . 写出一种Fe2+、Fe3+的检验办法:___________ 。
您最近一年使用:0次
解题方法
3 . 酒足饭饱之后,你和白风先回了白风的家一趟。
毕竟今天是白风约你出来玩,去他家自然也就理所当然了。
“哇,你这是在家里造了个小实验室?”面对你的赞叹,白风不好意思地挠挠头:“这哪是个实验室呀,只能算是小作坊啦~”
白风打算给你表演几个魔术,顺带考验一下你:
(1)他先是用一种类似于碘伏颜色的液体给自己的胳膊“消毒”,之后用一旁浸泡在液体中的铁刀在自己的胳膊上划了一刀!很快刚才划过的地方就被“血”染红了。下一刻,白风只是念了几句咒语,然后用抹布一擦,刚才的“伤口”便“愈合”了。“虽然但是,我肯定不会去真的划伤自己啦~”白风指了指自己消毒的液体:“这里面含有一种常见的离子:___________ ,而我刚才那把刀其实浸泡在了___________ (填化学式)中,所以他们两个发生络合反应,血的红色就出来啦~然后我一擦就没有惹~”。
(2)接下来,白风先将自己买的无水乙醇加入坩埚中,然后点燃,火焰立刻升腾而起。接下来,白风拉上窗帘,关闭了屋内的灯,打开了自己买的低压钠灯。火焰的黄色立马显现了出来。正当你还在奇怪白风这是在干什么的时候,他却微微一笑:“来了哦,注意观察~”,只见他手中的药勺取了一勺白色固体。当固体落入火中时,原本通体黄色的火焰外侧忽然变成了黑色!“给你个提示:我们学过了焰色实验,也学过了发射光谱和吸收光谱,你来猜猜我到底往火里加入了什么?”白风朝你眨了眨眼:“这种物质在绝大多数家庭中很常见哦~”,你当然猜到白风说的是什么了:___________ 。(填化学式)
(3)“下面来做个酷炫的~”白风端来了一盘“水”,然后递给了你一根玻璃棒:“这盘‘水’其实是醋酸钠的溶液,只不过我在制作这盘溶液的时候用的是热水,现在已经凉了。”在白风的指示下,你好奇地用玻璃棒点了一下盘子中的“水”。令人惊讶的事情发生了:从你刚才点的地方开始,这盘“水”居然“结冰”了!“给你个提示:你刚才的玻璃棒被我用来搅拌了一下醋酸钠固体~”。你能猜到这个魔术的原理吗?___________ 。
(4)“最后一个哦,你应该还记得黑面包实验吧~”白风直接朝着浓硫酸中加入了几勺蔗糖,不一会儿,这杯浓硫酸便是被“黑面包”填满了。“你还记得他的细节吗?”反应的化学方程式:___________ 。如果将面包放在火上一直烤,最后剩下的应该是___________ 。(填化学符号)
毕竟今天是白风约你出来玩,去他家自然也就理所当然了。
“哇,你这是在家里造了个小实验室?”面对你的赞叹,白风不好意思地挠挠头:“这哪是个实验室呀,只能算是小作坊啦~”
白风打算给你表演几个魔术,顺带考验一下你:
(1)他先是用一种类似于碘伏颜色的液体给自己的胳膊“消毒”,之后用一旁浸泡在液体中的铁刀在自己的胳膊上划了一刀!很快刚才划过的地方就被“血”染红了。下一刻,白风只是念了几句咒语,然后用抹布一擦,刚才的“伤口”便“愈合”了。“虽然但是,我肯定不会去真的划伤自己啦~”白风指了指自己消毒的液体:“这里面含有一种常见的离子:
(2)接下来,白风先将自己买的无水乙醇加入坩埚中,然后点燃,火焰立刻升腾而起。接下来,白风拉上窗帘,关闭了屋内的灯,打开了自己买的低压钠灯。火焰的黄色立马显现了出来。正当你还在奇怪白风这是在干什么的时候,他却微微一笑:“来了哦,注意观察~”,只见他手中的药勺取了一勺白色固体。当固体落入火中时,原本通体黄色的火焰外侧忽然变成了黑色!“给你个提示:我们学过了焰色实验,也学过了发射光谱和吸收光谱,你来猜猜我到底往火里加入了什么?”白风朝你眨了眨眼:“这种物质在绝大多数家庭中很常见哦~”,你当然猜到白风说的是什么了:
(3)“下面来做个酷炫的~”白风端来了一盘“水”,然后递给了你一根玻璃棒:“这盘‘水’其实是醋酸钠的溶液,只不过我在制作这盘溶液的时候用的是热水,现在已经凉了。”在白风的指示下,你好奇地用玻璃棒点了一下盘子中的“水”。令人惊讶的事情发生了:从你刚才点的地方开始,这盘“水”居然“结冰”了!“给你个提示:你刚才的玻璃棒被我用来搅拌了一下醋酸钠固体~”。你能猜到这个魔术的原理吗?
(4)“最后一个哦,你应该还记得黑面包实验吧~”白风直接朝着浓硫酸中加入了几勺蔗糖,不一会儿,这杯浓硫酸便是被“黑面包”填满了。“你还记得他的细节吗?”反应的化学方程式:
您最近一年使用:0次
名校
4 . 铁及其化合物是重要的化学物质,如天然磁石中含有较多的Fe3O4、三水合草酸合铁(Ⅲ)酸钾{K3[Fe(C2O4)3]·3H2O,呈绿色,可溶于水,难溶于乙醇,见光易分解}常用于化学光量计、绿矾(FeSO4·7H2O)是常用的还原剂。回答下列问题:
(1)电子工业中,常用氯化铁溶液腐蚀铜制造印刷电路板,该原理的离子方程式为_____ 。
(2)根据化合价及元素的性质,Na2S5可以改写为Na2S·4S、Fe3O4可以改写为FeO·Fe2O3,则Fe3Cl8可以改写为_____ 、Fe3I8可以改写为_____ 。
(3)可通过下列两个步骤制备三水合草酸合铁(Ⅲ)酸钾晶体。
步骤i:向盛有3.00g黄色晶体FeC2O4·2H2O的烧杯中,加入10.00mLK2C2O4溶液,加热至40℃左右,缓慢滴入过量的H2O2,一段时间后,出现红褐色沉淀。
步骤ii:加热至沸腾,分两次缓慢加入8.00~9.00mLH2C2O4溶液,至沉淀溶解,得到绿色溶液。加热浓缩、加入无水乙醇、结晶,抽滤干燥得7.860g三水合草酸合铁(III)酸钾晶体。
①步骤ⅰ中,生成三草酸合铁酸钾与另一种铁的化合物,该化合物为_____ (填化学式)。
②步骤ⅱ加入无水乙醇的目的是_____ 。
③实验小组完成实验后发现产率偏低,其主要原因可能是_____ 。
(4)8.34gFeSO4·7H2O(Mr=278)样品隔绝空气受热分解生成多种化合物过程的热重曲线(残留样品质量随温度变化的曲线)如图所示。
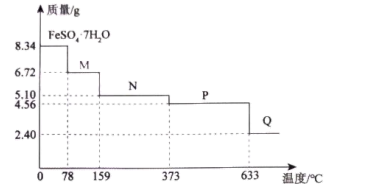
①温度为100℃时,固体物质M的化学式为_____ 。
②在隔绝空气的条件下,由P得到Q的化学方程式为_____ 。
(1)电子工业中,常用氯化铁溶液腐蚀铜制造印刷电路板,该原理的离子方程式为
(2)根据化合价及元素的性质,Na2S5可以改写为Na2S·4S、Fe3O4可以改写为FeO·Fe2O3,则Fe3Cl8可以改写为
(3)可通过下列两个步骤制备三水合草酸合铁(Ⅲ)酸钾晶体。
步骤i:向盛有3.00g黄色晶体FeC2O4·2H2O的烧杯中,加入10.00mLK2C2O4溶液,加热至40℃左右,缓慢滴入过量的H2O2,一段时间后,出现红褐色沉淀。
步骤ii:加热至沸腾,分两次缓慢加入8.00~9.00mLH2C2O4溶液,至沉淀溶解,得到绿色溶液。加热浓缩、加入无水乙醇、结晶,抽滤干燥得7.860g三水合草酸合铁(III)酸钾晶体。
①步骤ⅰ中,生成三草酸合铁酸钾与另一种铁的化合物,该化合物为
②步骤ⅱ加入无水乙醇的目的是
③实验小组完成实验后发现产率偏低,其主要原因可能是
(4)8.34gFeSO4·7H2O(Mr=278)样品隔绝空气受热分解生成多种化合物过程的热重曲线(残留样品质量随温度变化的曲线)如图所示。

①温度为100℃时,固体物质M的化学式为
②在隔绝空气的条件下,由P得到Q的化学方程式为
您最近一年使用:0次
解题方法
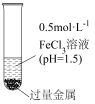
5 . 以 溶液为实验对象,研究物质之间反应的复杂多样性。实验如下:
溶液为实验对象,研究物质之间反应的复杂多样性。实验如下:
Ⅰ.金属与 溶液反应
溶液反应
(1)配制 溶液,需要
溶液,需要 将固体先溶于浓盐酸,再稀释至指定浓度,原因是
将固体先溶于浓盐酸,再稀释至指定浓度,原因是___________ 。
(2)根据实验ⅰ中的现象,推测红褐色液体为胶体,通过___________ 可以快速判断其是否为胶体。
(3) 溶液与Cu反应的离子方程式为
溶液与Cu反应的离子方程式为___________ ,实验ⅰ和ⅱ均先有气体生成,后有溶液颜色的变化,甲同学认为产生该现象的原因可能是此实验条件下氧化性: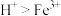 ,乙同学认为可以根据ⅲ判断氧化性:
,乙同学认为可以根据ⅲ判断氧化性: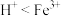 ,理由是
,理由是___________ 。
Ⅱ. 溶液与
溶液与 溶液反应:
溶液反应: ,产生蓝色沉淀,推测
,产生蓝色沉淀,推测 与
与 反应的离子方程式是
反应的离子方程式是___________ 。
(5)另取红棕色溶液少许,检测其为胶体,向其中继续滴加 溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是___________ 。
(6)结合(4)、(5),推测 溶液与
溶液与 溶液反应同时存在
溶液反应同时存在__________ 反应和___________ 反应。从下列选项选择:
A.复分解 B.双水解 C.置换 D.氧化还原
 溶液为实验对象,研究物质之间反应的复杂多样性。实验如下:
溶液为实验对象,研究物质之间反应的复杂多样性。实验如下:Ⅰ.金属与
 溶液反应
溶液反应| 装置 | 序号 | 金属 | 现象及产物检验 |
| ⅰ | 镁条 | 立即产生大量气体,溶液颜色变红棕色; 片刻后气泡减少,金属表面产生红褐色沉淀。 |
| ⅱ | 锌粒 | 开始时无明显气泡,半分钟后有气体产生,溶液颜色慢慢加深;一段时间后,金属表面产生红棕色沉淀 | |
| ⅲ | 铜粉 | 无气体产生,溶液逐渐变为蓝绿色; |
(1)配制
 溶液,需要
溶液,需要 将固体先溶于浓盐酸,再稀释至指定浓度,原因是
将固体先溶于浓盐酸,再稀释至指定浓度,原因是(2)根据实验ⅰ中的现象,推测红褐色液体为胶体,通过
(3)
 溶液与Cu反应的离子方程式为
溶液与Cu反应的离子方程式为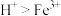 ,乙同学认为可以根据ⅲ判断氧化性:
,乙同学认为可以根据ⅲ判断氧化性: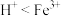 ,理由是
,理由是Ⅱ.
 溶液与
溶液与 溶液反应:
溶液反应: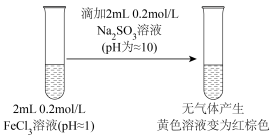
 ,产生蓝色沉淀,推测
,产生蓝色沉淀,推测 与
与 反应的离子方程式是
反应的离子方程式是(5)另取红棕色溶液少许,检测其为胶体,向其中继续滴加
 溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是(6)结合(4)、(5),推测
 溶液与
溶液与 溶液反应同时存在
溶液反应同时存在A.复分解 B.双水解 C.置换 D.氧化还原
您最近一年使用:0次
2023-12-06更新
|
203次组卷
|
2卷引用:广东省汕头市2023-2024学年高三上学期12月期中考试化学试题
6 . 某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol·L-1 FeCl2溶液,实验记录如下(a、b代表电压值,且a>b):
(1)用___________ 溶液(填化学式)检验出溶液中含Fe3+。
(2)由上述实验猜测,Fe3+生成可能的原因:①Fe2+在___________ 极放电,②___________ (用离子方程式表示)
(3)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。某同学又做了以下实验,记录如下:
①实验选择电解的溶液为pH=1浓度为___________ mol/L的___________ (填化学式)溶液。
②Ⅳ中检验Cl2的实验方法:___________ 。
③与Ⅱ对比,得出的结论:通过控制电压,证实了产生Fe3+的两种原因都成立;且低电压下,Fe2+优于Cl-放电,那么请把上表的电压数据补充完整:Ⅳ:___________ , Ⅴ:c>x≥b。
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)由上述实验猜测,Fe3+生成可能的原因:①Fe2+在
(3)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。某同学又做了以下实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | ___________ | 无明显变化 | 有Cl2 |
| Ⅴ | ___________ | 无明显变化 | 无Cl2 |
②Ⅳ中检验Cl2的实验方法:
③与Ⅱ对比,得出的结论:通过控制电压,证实了产生Fe3+的两种原因都成立;且低电压下,Fe2+优于Cl-放电,那么请把上表的电压数据补充完整:Ⅳ:
您最近一年使用:0次
2023-11-24更新
|
225次组卷
|
2卷引用:广东省汕头市2023-2024学年金山中学高三上学期10月阶段考试化学试卷
解题方法
7 . 铁及其化合物在生产、生活中有着重要作用。按要求回答下列问题。
(1)基态Fe原子的价层电子排布式为___________ ;铁元素在元素周期表中的位置是___________ ,属于___________ 区。
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:
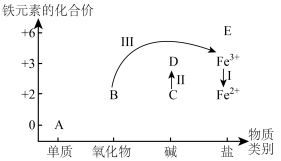
①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:___________ 。
②预测物质E中铁元素具有___________ (填“氧化性”或“还原性”)。
③写出反应Ⅱ的化学方程式:___________ 。
④实现反应Ⅲ的转化,可选择含N元素的试剂为___________ 。
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)
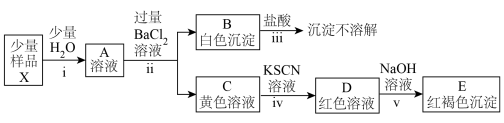
①由步骤ⅰ及其现象可推知铁盐X的物理性质:___________ 。
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为___________ 。
③C溶液呈黄色,不可能是因其体系中含有的___________ 、___________ 、___________ 、___________ (填离子符号)所致;
而可能是因其体系中含有的___________ 、___________ (填粒子的化学式)等所致。
④由步骤iv、v及其现象,体系中与 结合能力最强的离子是
结合能力最强的离子是___________ 。
(1)基态Fe原子的价层电子排布式为
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:

①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:
②预测物质E中铁元素具有
③写出反应Ⅱ的化学方程式:
④实现反应Ⅲ的转化,可选择含N元素的试剂为
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)

①由步骤ⅰ及其现象可推知铁盐X的物理性质:
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为
③C溶液呈黄色,不可能是因其体系中含有的
而可能是因其体系中含有的
④由步骤iv、v及其现象,体系中与
 结合能力最强的离子是
结合能力最强的离子是
您最近一年使用:0次
8 . 高铁酸钾(K2FeO4)是一种新型的污水处理剂。
(1)K2FeO4的制备:湿法制备高铁酸钾(K2FeO4)是以次氯酸钠和氯化铁为原料,在碱性溶液中反应生成高铁酸钠,然后加入氢氧化钾,将其转化成高铁酸钾。
①写出并配平生成高铁酸钠的反应的离子方程式:___________ 。
②若反应过程中转移了0.9mol电子,则还原产物的物质的量为___________ mol。
③低温下,向高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),由此可说明溶解度Na2FeO4___________ K2FeO4(填“>”、“<”或“=”)。
(2)K2FeO4的性质:
i.将K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应。
ii.将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
iii.将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比i快。
① K2FeO4溶于蒸馏水的化学反应方程式是___________ 。
② K2FeO4的氧化性与溶液pH的关系是___________ 。
(3)K2FeO4的应用。K2FeO4可用于生活垃圾渗透液的脱氮(将含氮物质转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如下:
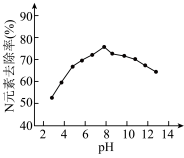
① K2FeO4脱氮的最佳pH是___________ 。
② 根据图推测,pH = 4时生活垃圾渗透液中含氮物质主要以___________ 形式存在。
③ pH大于8时,脱氮效果随pH的升高而减弱,分析可能的原因:___________ 。
(1)K2FeO4的制备:湿法制备高铁酸钾(K2FeO4)是以次氯酸钠和氯化铁为原料,在碱性溶液中反应生成高铁酸钠,然后加入氢氧化钾,将其转化成高铁酸钾。
①写出并配平生成高铁酸钠的反应的离子方程式:
②若反应过程中转移了0.9mol电子,则还原产物的物质的量为
③低温下,向高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),由此可说明溶解度Na2FeO4
(2)K2FeO4的性质:
i.将K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应。
ii.将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
iii.将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比i快。
① K2FeO4溶于蒸馏水的化学反应方程式是
② K2FeO4的氧化性与溶液pH的关系是
(3)K2FeO4的应用。K2FeO4可用于生活垃圾渗透液的脱氮(将含氮物质转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如下:

① K2FeO4脱氮的最佳pH是
② 根据图推测,pH = 4时生活垃圾渗透液中含氮物质主要以
③ pH大于8时,脱氮效果随pH的升高而减弱,分析可能的原因:
您最近一年使用:0次
名校
解题方法
9 . 按要求正确书写方程式:
(1)过氧化钠与水反应的化学方程式:________ 。
(2)泡沫灭火器灭火原理的离子方程式:________ 。
(3)铝单质与氢氧化钠溶液反应的离子方程式:________ 。
(4)将H2S气体通入FeCl3溶液中产生淡黄色沉淀的离子方程式:________ 。
(5)四氧化三铁溶于足量氢碘酸溶液的离子方程式:________ 。
(1)过氧化钠与水反应的化学方程式:
(2)泡沫灭火器灭火原理的离子方程式:
(3)铝单质与氢氧化钠溶液反应的离子方程式:
(4)将H2S气体通入FeCl3溶液中产生淡黄色沉淀的离子方程式:
(5)四氧化三铁溶于足量氢碘酸溶液的离子方程式:
您最近一年使用:0次
名校
解题方法
10 . 为探究FeCl3溶液和Na2SO3溶液混合后Fe3+发生怎样的化学反应,进行了如下实验(FeCl3和Na2SO3溶液浓度均为0.50mol·L-1)。
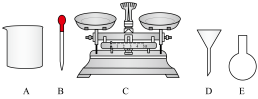
(1)由Na2SO3固体配制0.50mol·L-1Na2SO3溶液,需要的仪器除药匙、玻璃棒、容量瓶外,下列仪器中还需要___________ (填字母)。
(2)根据实验②的现象得出FeCl3溶液和Na2SO3溶液反应生成了___________ 。
(3)甲同学根据实验③中现象得出FeC13溶液和Na2SO3溶液发生了氧化还原反应,写出其相应的离子方程式:___________ 。
(4)乙同学认为实验③中现象不足以说明FeC13溶液和Na2SO3溶液发生了氧化还原反应,你认为该同学的理由是___________ ;请你帮助乙同学重新设计一个实验来证明FeCl3溶液和Na2SO3溶液发生了氧化还原反应:___________ (填操作及对应现象)。
(5)结论:该实验说明在该条件下Fe3+既发生了___________ 反应又发生了还原反应。
| 实验 | 操作与现象 |
| ① | 先向试管中加入10mLFeCl3溶液,再加入10mLNa2SO3溶液,振荡后发现试管中颜色由棕黄色变为红褐色(无气泡产生,也无沉淀生成)。 |
| ② | 用激光灯从侧面照射实验①得到的混合体系,观察到一条光亮的通路。 |
| ③ | 取实验①反应后的混合体系少许于试管中,先加入过量稀盐酸酸化后,再滴加氯化钡溶液,产生白色沉淀。 |
| ④ | 将实验①反应后的混合体系放置一小时后,溶液变为淡绿色。 |
(1)由Na2SO3固体配制0.50mol·L-1Na2SO3溶液,需要的仪器除药匙、玻璃棒、容量瓶外,下列仪器中还需要

(2)根据实验②的现象得出FeCl3溶液和Na2SO3溶液反应生成了
(3)甲同学根据实验③中现象得出FeC13溶液和Na2SO3溶液发生了氧化还原反应,写出其相应的离子方程式:
(4)乙同学认为实验③中现象不足以说明FeC13溶液和Na2SO3溶液发生了氧化还原反应,你认为该同学的理由是
(5)结论:该实验说明在该条件下Fe3+既发生了
您最近一年使用:0次