名校
解题方法
1 . 某磁黄铁矿的主要成分是FexS(S为=-2价),磁黄铁矿中既含有二价铁又含有三价铁。将一定量的该磁黄铁矿与盐酸完全反应(注:矿石中其他成分不与盐酸反应),生成1.6g硫单质、0.45molFeCl2和一定量H2S气体,且溶液中滴加KSCN溶液不变血红色。请计算并回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+(二价铁)与Fe3+(三价铁)的物质的量之比为_______ 。
(2)该磁黄铁矿FexS中,x=_______ 。
(1)该磁黄铁矿FexS中,Fe2+(二价铁)与Fe3+(三价铁)的物质的量之比为
(2)该磁黄铁矿FexS中,x=
您最近一年使用:0次
2 . 将21.6g生锈的铁粉(铁锈主要成分为Fe2O3·xH2O)放入200mL3.5mol/L的盐酸中,完全溶解后产生气体3.36L(标准状况),向反应后的溶液中滴入几滴KSCN溶液,溶液无明显现象,再向溶液中加入NaHCO3至溶液pH=7,又产生气体2.24L(标准状况)。已知:氧化性Fe3+>H+,回答下列问题:
(1)写出铁粉溶解过程中氧化还原反应的离子方程式:___________ 。
(2)反应产生的前后两种气体质量之比为___________ 。
(3)计算生锈铁粉中铁元素的质量分数(无计算过程不给分)___________ 。
(1)写出铁粉溶解过程中氧化还原反应的离子方程式:
(2)反应产生的前后两种气体质量之比为
(3)计算生锈铁粉中铁元素的质量分数(无计算过程不给分)
您最近一年使用:0次
2022-01-20更新
|
412次组卷
|
2卷引用:四川省绵阳市2021-2022学年高一上学期期末考试化学试题
3 . 确定Fe2O3和Cu混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别加入30.0 mL某浓度的稀硫酸中,充分反应后, 每组样品剩余固体的质量与原样品质量的关系如图所示。

(1)该混合物中,n(Fe2O3):n(Cu)=___________ 。
(2)稀硫酸的物质的量浓度为___________ 。

(1)该混合物中,n(Fe2O3):n(Cu)=
(2)稀硫酸的物质的量浓度为
您最近一年使用:0次
2021-05-29更新
|
964次组卷
|
5卷引用:浙江省宁波市九校2021-2022学年高一上学期期末联考化学试题
浙江省宁波市九校2021-2022学年高一上学期期末联考化学试题【省级联考】浙江省2020届普通高校招生选考科目化学模拟试题(六)(已下线)【浙江新东方】【2021.5.19】【SX】【高三下】【高中化学】【SX00147】(已下线)考向02 物质的量浓度及其相关计算-备战2022年高考化学一轮复习考点微专题浙江省舟山市舟山中学2022-2023学年高一上学期12月质量检测化学试题
名校
4 . 某磁黄铁矿的主要成分是FeXS(S为-2价), 磁黄铁矿中既含有二价铁又含有三价铁。将一定量的该磁黄铁矿与盐酸完全反应(注:矿石中其他成分不与盐酸反应,生成2.4g硫单质、 0.5molFeCl2和一定量H2S气体,且溶液中滴加KSCN溶液不变血红色。
回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+ (二价铁) 与Fe3+ (三价铁)的物质的量之比为__________ 。
(2)该磁黄铁矿FeXS中,x=_________ (保留 2位有效数字)
回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+ (二价铁) 与Fe3+ (三价铁)的物质的量之比为
(2)该磁黄铁矿FeXS中,x=
您最近一年使用:0次
2022-01-18更新
|
488次组卷
|
2卷引用:江西省赣州市2021-2022学年高一上学期期末考试化学试题
5 . 向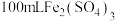 和
和 的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量如图所示。忽略溶液体积的变化。
的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量如图所示。忽略溶液体积的变化。
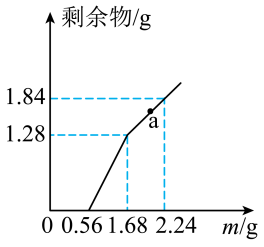
(1)原溶液中 和
和 的物质的量浓度之比为
的物质的量浓度之比为_________ 。
(2)a点时溶液中溶质的物质的量浓度为_________ 。
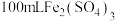 和
和 的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量如图所示。忽略溶液体积的变化。
的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量如图所示。忽略溶液体积的变化。
(1)原溶液中
 和
和 的物质的量浓度之比为
的物质的量浓度之比为(2)a点时溶液中溶质的物质的量浓度为
您最近一年使用:0次
6 . 现有CuO和Fe2O3组成的混合物若干克,向其中加入一定浓度的硫酸溶液50.0mL,恰好完全反应。向反应后的溶液中不断加入铁粉,加入铁粉的质量与充分反应后剩余固体的质量关系如图所示(A为拐点)。

请回答下列问题:
(1)反应至A点时,所加入铁粉的物质的量为___________ mol。
(2)硫酸溶液的物质的量浓度为___________ mol∙L−1。

请回答下列问题:
(1)反应至A点时,所加入铁粉的物质的量为
(2)硫酸溶液的物质的量浓度为
您最近一年使用:0次
解题方法
7 . 由铜和三氧化二铁组成的混合粉末共 ,加入到浓度为
,加入到浓度为 的硫酸中,使之充分反应。
的硫酸中,使之充分反应。
(1)若硫酸溶液过量,且测得反应后溶液中 和
和 的物质的量相等,则原混合物中铜的质量为
的物质的量相等,则原混合物中铜的质量为___________ g;
(2)若固体混合物恰好能全部溶解在硫酸中,且消耗的硫酸体积为 ,求V的最小值,并简要写出推理及计算过程。
,求V的最小值,并简要写出推理及计算过程。___________
 ,加入到浓度为
,加入到浓度为 的硫酸中,使之充分反应。
的硫酸中,使之充分反应。(1)若硫酸溶液过量,且测得反应后溶液中
 和
和 的物质的量相等,则原混合物中铜的质量为
的物质的量相等,则原混合物中铜的质量为(2)若固体混合物恰好能全部溶解在硫酸中,且消耗的硫酸体积为
 ,求V的最小值,并简要写出推理及计算过程。
,求V的最小值,并简要写出推理及计算过程。
您最近一年使用:0次
名校
解题方法
8 . 向100 mL FeCl3和CuCl2的混合溶液中加入铁粉,其固体质量的变化如图所示,假设溶液体积不变,求:

(1)原混合溶液中FeCl3的物质的量___________
(2)c点溶液中FeCl2的物质的量浓度___________

(1)原混合溶液中FeCl3的物质的量
(2)c点溶液中FeCl2的物质的量浓度
您最近一年使用:0次
解题方法
9 . 黄铁矿主要成分是二硫化亚铁。某化学实验小组取1.0g黄铁矿样品在空气中充分灼烧时发生反应4FeS2+11O2 2Fe2O3+8SO2(假设杂质不参加反应),生成的SO2气体恰好被50mLFe2(SO4)3溶液完全吸收,在所得溶液中加入足量BaCl2溶液充分反应后,过滤、洗涤、干燥得13.98g固体。回答下列问题:
2Fe2O3+8SO2(假设杂质不参加反应),生成的SO2气体恰好被50mLFe2(SO4)3溶液完全吸收,在所得溶液中加入足量BaCl2溶液充分反应后,过滤、洗涤、干燥得13.98g固体。回答下列问题:
(1)FeS2在空气中灼烧时,化合价升高的元素是__________ ,SO2与Fe2(SO4)3反应的化学方程式是_________________ 。
(2)原Fe2(SO4)3溶液的物质的量浓度为_______ ,黄铁矿中FeS2的质量分数为______ 。
(3)工业上煅烧10 t上述黄铁矿,产生的SO2经催化氧化制硫酸,理论上可制得98%的浓硫酸多少吨______ ?(列式计算)
 2Fe2O3+8SO2(假设杂质不参加反应),生成的SO2气体恰好被50mLFe2(SO4)3溶液完全吸收,在所得溶液中加入足量BaCl2溶液充分反应后,过滤、洗涤、干燥得13.98g固体。回答下列问题:
2Fe2O3+8SO2(假设杂质不参加反应),生成的SO2气体恰好被50mLFe2(SO4)3溶液完全吸收,在所得溶液中加入足量BaCl2溶液充分反应后,过滤、洗涤、干燥得13.98g固体。回答下列问题:(1)FeS2在空气中灼烧时,化合价升高的元素是
(2)原Fe2(SO4)3溶液的物质的量浓度为
(3)工业上煅烧10 t上述黄铁矿,产生的SO2经催化氧化制硫酸,理论上可制得98%的浓硫酸多少吨
您最近一年使用:0次
名校
10 . 称取一定量Fe2O3与Cu2O的混合粉末,用足量CO还原后,质量减轻8g。若原混合粉末用1L1mol∙L-1的稀H2SO4充分反应后,剩余固体质量为6.4g。已知:Cu2O+2H+=Cu+Cu2++H2O
(1)反应后硫酸的物质的量浓度为___ (设溶液体积不变)。
(2)原红色固体粉末中Fe2O3的物质的量为___ 。
(1)反应后硫酸的物质的量浓度为
(2)原红色固体粉末中Fe2O3的物质的量为
您最近一年使用:0次
2020-12-27更新
|
442次组卷
|
3卷引用:浙江省台州市2019—2020学年高一上学期期末质量评估考试化学试题



