名校
解题方法
1 . 计算(要有计算过程)
(1)常温常压下,用等质量的 、
、 、
、 三种气体分别吹出三个气球,求三个气球的体积之比为
三种气体分别吹出三个气球,求三个气球的体积之比为______ 。
(2)把 溶液和
溶液和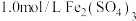 溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中
溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中 的物质的量浓度
的物质的量浓度___________ 。
(3)某种胃药的有效成分为碳酸钠,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①向一粒研碎后的药片(0.10g)中加入20.00ml蒸馏水;
②配置 稀盐酸和
稀盐酸和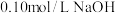 溶液;
溶液;
③加入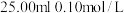 稀盐酸;
稀盐酸;
④用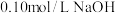 溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
某同学4次测定所消耗的NaOH溶液的体积如下:
根据这个同学的实验数据,计算这种药片中碳酸钙的质量分数_________ 。
(1)常温常压下,用等质量的
 、
、 、
、 三种气体分别吹出三个气球,求三个气球的体积之比为
三种气体分别吹出三个气球,求三个气球的体积之比为(2)把
 溶液和
溶液和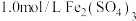 溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中
溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中 的物质的量浓度
的物质的量浓度(3)某种胃药的有效成分为碳酸钠,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①向一粒研碎后的药片(0.10g)中加入20.00ml蒸馏水;
②配置
 稀盐酸和
稀盐酸和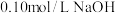 溶液;
溶液;③加入
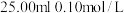 稀盐酸;
稀盐酸;④用
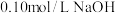 溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;某同学4次测定所消耗的NaOH溶液的体积如下:
| 测定次数 | 第一次 | 第二次 | 第三次 | 第四次 |
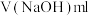 | 13.00 | 12.90 | 13.10 | 13.50 |
您最近一年使用:0次
解题方法
2 . 向铁和氧化铁的混合物中加入600mL 稀盐酸后恰好完全反应,所得溶液滴加硫氰化钾不显红色,并收集到672mL氢气(标准状况下测定)。回答下列问题:
稀盐酸后恰好完全反应,所得溶液滴加硫氰化钾不显红色,并收集到672mL氢气(标准状况下测定)。回答下列问题:
(1)反应后溶液中的溶质为_______ mol。
(2)原混合物中单质铁的质量为_______ g。
 稀盐酸后恰好完全反应,所得溶液滴加硫氰化钾不显红色,并收集到672mL氢气(标准状况下测定)。回答下列问题:
稀盐酸后恰好完全反应,所得溶液滴加硫氰化钾不显红色,并收集到672mL氢气(标准状况下测定)。回答下列问题:(1)反应后溶液中的溶质为
(2)原混合物中单质铁的质量为
您最近一年使用:0次
21-22高一·全国·假期作业
3 . 有一瓶用硫酸酸化的FeSO4溶液,置于空气中一段时间后,溶液中c(H+)=0.1mol·L-1。为测定其中Fe2+被氧化的百分率,进行如下操作:
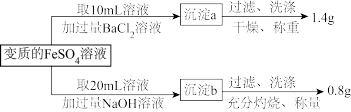
请计算(忽略Fe2+、Fe3+的水解):
(1)20mL变质的FeSO4溶液中,铁元素的总的物质的量为_______ ;
(2)原溶液中Fe2+被氧化的百分率_______ ;
(3)原溶液中硫酸的物质的量浓度为_______ 。

请计算(忽略Fe2+、Fe3+的水解):
(1)20mL变质的FeSO4溶液中,铁元素的总的物质的量为
(2)原溶液中Fe2+被氧化的百分率
(3)原溶液中硫酸的物质的量浓度为
您最近一年使用:0次
4 . 现有CuO和Fe2O3组成的混合物若干克,向其中加入一定浓度的硫酸溶液50.0mL,恰好完全反应。向反应后的溶液中不断加入铁粉,加入铁粉的质量与充分反应后剩余固体的质量关系如图所示(A为拐点)。

请回答下列问题:
(1)反应至A点时,所加入铁粉的物质的量为___________ mol。
(2)硫酸溶液的物质的量浓度为___________ mol∙L−1。

请回答下列问题:
(1)反应至A点时,所加入铁粉的物质的量为
(2)硫酸溶液的物质的量浓度为
您最近一年使用:0次
5 . 将21.6g生锈的铁粉(铁锈主要成分为Fe2O3·xH2O)放入200mL3.5mol/L的盐酸中,完全溶解后产生气体3.36L(标准状况),向反应后的溶液中滴入几滴KSCN溶液,溶液无明显现象,再向溶液中加入NaHCO3至溶液pH=7,又产生气体2.24L(标准状况)。已知:氧化性Fe3+>H+,回答下列问题:
(1)写出铁粉溶解过程中氧化还原反应的离子方程式:___________ 。
(2)反应产生的前后两种气体质量之比为___________ 。
(3)计算生锈铁粉中铁元素的质量分数(无计算过程不给分)___________ 。
(1)写出铁粉溶解过程中氧化还原反应的离子方程式:
(2)反应产生的前后两种气体质量之比为
(3)计算生锈铁粉中铁元素的质量分数(无计算过程不给分)
您最近一年使用:0次
2022-01-20更新
|
412次组卷
|
2卷引用:四川省绵阳市2021-2022学年高一上学期期末考试化学试题
名校
6 . 某磁黄铁矿的主要成分是FeXS(S为-2价), 磁黄铁矿中既含有二价铁又含有三价铁。将一定量的该磁黄铁矿与盐酸完全反应(注:矿石中其他成分不与盐酸反应,生成2.4g硫单质、 0.5molFeCl2和一定量H2S气体,且溶液中滴加KSCN溶液不变血红色。
回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+ (二价铁) 与Fe3+ (三价铁)的物质的量之比为__________ 。
(2)该磁黄铁矿FeXS中,x=_________ (保留 2位有效数字)
回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+ (二价铁) 与Fe3+ (三价铁)的物质的量之比为
(2)该磁黄铁矿FeXS中,x=
您最近一年使用:0次
2022-01-18更新
|
483次组卷
|
2卷引用:江西省赣州市2021-2022学年高一上学期期末考试化学试题
7 . 确定Fe2O3和Cu混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别加入30.0 mL某浓度的稀硫酸中,充分反应后, 每组样品剩余固体的质量与原样品质量的关系如图所示。

(1)该混合物中,n(Fe2O3):n(Cu)=___________ 。
(2)稀硫酸的物质的量浓度为___________ 。

(1)该混合物中,n(Fe2O3):n(Cu)=
(2)稀硫酸的物质的量浓度为
您最近一年使用:0次
2021-05-29更新
|
952次组卷
|
5卷引用:浙江省宁波市九校2021-2022学年高一上学期期末联考化学试题
浙江省宁波市九校2021-2022学年高一上学期期末联考化学试题浙江省舟山市舟山中学2022-2023学年高一上学期12月质量检测化学试题【省级联考】浙江省2020届普通高校招生选考科目化学模拟试题(六)(已下线)【浙江新东方】【2021.5.19】【SX】【高三下】【高中化学】【SX00147】(已下线)考向02 物质的量浓度及其相关计算-备战2022年高考化学一轮复习考点微专题
名校
8 . 称取一定量Fe2O3与Cu2O的混合粉末,用足量CO还原后,质量减轻8g。若原混合粉末用1L1mol∙L-1的稀H2SO4充分反应后,剩余固体质量为6.4g。已知:Cu2O+2H+=Cu+Cu2++H2O
(1)反应后硫酸的物质的量浓度为___ (设溶液体积不变)。
(2)原红色固体粉末中Fe2O3的物质的量为___ 。
(1)反应后硫酸的物质的量浓度为
(2)原红色固体粉末中Fe2O3的物质的量为
您最近一年使用:0次
2020-12-27更新
|
442次组卷
|
3卷引用:浙江省舟山中学2021-2022学年高三下学期开学考试(返校考)化学试题
名校
9 . 有一稀硫酸和硝酸铁的混合溶液,向其中加入铁粉,溶液中的Fe2+浓度如图所示(不考虑溶液体积的变化):
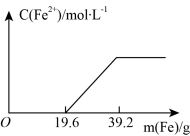
(1)溶液中H2SO4与Fe(NO3)3的物质的量之比为_________
(2)请写出详细的计算过程_________ 。

(1)溶液中H2SO4与Fe(NO3)3的物质的量之比为
(2)请写出详细的计算过程
您最近一年使用:0次
2020-05-07更新
|
464次组卷
|
2卷引用:浙江金华第一中学2021-2022学年高一下学期期中考试化学试题
真题
名校
10 . 称取4.00g氧化铜和氧化铁固体混合物,加入50.0mL2.00mol·L-1的硫酸充分溶解,往所得溶液中加入5.60g铁粉,充分反应后,得固体的质量为3.04g。请计算:
(1)加入铁粉充分反应后,溶液中溶质的物质的量_________________ 。
(2)固体混合物中氧化铜的质量_________________ 。
(1)加入铁粉充分反应后,溶液中溶质的物质的量
(2)固体混合物中氧化铜的质量
您最近一年使用:0次
2018-11-09更新
|
2375次组卷
|
11卷引用:浙江省杭州市西湖高级中学2021-2022学年高一下学期期中考试化学试题
浙江省杭州市西湖高级中学2021-2022学年高一下学期期中考试化学试题浙江省普通高校招生选考科目2018年4月考试化学试题浙江省台州市书生中学2018-2019学年高二下学期第一次月考化学试题浙江省金华市武义第三中学2019-2020学年高二上学期期中考试化学试题专题3.1 金属及其化合物(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 高考帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 高考帮(已下线)【浙江新东方】在线化学64高一下(已下线)【浙江新东方】高中化学20210513-030【2021】【高一下】(已下线)专题18.化学计算-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用)



