名校
1 . KSCN是实验室常用的化学试剂。
(1)探究KCl浓度对Fe3+与SCN-显色反应的影响
将25mL0.005mol•L-1FeCl3与25mL0.01mol•L-1KSCN溶液混合得红色溶液,各取3mL溶液分别加KCl晶体进行透光实验,结果如图所示。
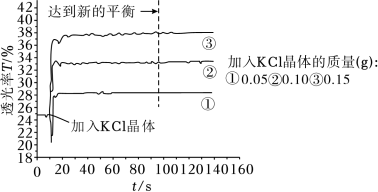
已知:i.溶液颜色越浅,透光率(T)越高;
ii.FeCl3溶液中存在Fe3++4Cl- [FeCl4]-(黄色)。
[FeCl4]-(黄色)。
①采用FeCl3稀溶液是为了避免_______ (填离子符号)的颜色对实验干扰。
②由实验结果分析,随着KCl浓度增大,Fe(SCN)3的浓度_______ (填“增大”“减小”或“不变”),从平衡移动的角度分析可能的原因_______ 。
(2)探究KSCN在铜含量测定过程中的作用
步骤如下:取1.0g铜盐样品溶于稀盐酸配成250mL溶液,取10.00mL加入过量KI充分反应,用0.0100mol•L-1的Na2S2O3标准液滴定至终点。
已知:i.2Cu2++4I-=2CuI↓+I2;2S2O +I2=S4O
+I2=S4O +2I-;
+2I-;
ii.I2+I- I
I ,CuI沉淀强烈吸附I
,CuI沉淀强烈吸附I ;
;
iii.Ksp(CuI)=1.0×10-12;Ksp(CuSCN)=4.8×10-15
①以淀粉为指示剂,滴定终点的颜色变化为_______ ;根据信息预测最终测定的结果将_______ (填“偏大”“偏小”或“无影响”)。
②通过实验探究,在滴定过程中加入KSCN可使测定结果更准确,写出发生反应的离子方程式_______ ;到达滴定终点时消耗标准液20.00mL,样品中铜元素质量分数为_______ ,滴定后仍存在少量CuI沉淀,测得溶液中c(I-)=0.2mol•L-1,则c(SCN-)=_______ 。
(1)探究KCl浓度对Fe3+与SCN-显色反应的影响
将25mL0.005mol•L-1FeCl3与25mL0.01mol•L-1KSCN溶液混合得红色溶液,各取3mL溶液分别加KCl晶体进行透光实验,结果如图所示。

已知:i.溶液颜色越浅,透光率(T)越高;
ii.FeCl3溶液中存在Fe3++4Cl-
 [FeCl4]-(黄色)。
[FeCl4]-(黄色)。①采用FeCl3稀溶液是为了避免
②由实验结果分析,随着KCl浓度增大,Fe(SCN)3的浓度
(2)探究KSCN在铜含量测定过程中的作用
步骤如下:取1.0g铜盐样品溶于稀盐酸配成250mL溶液,取10.00mL加入过量KI充分反应,用0.0100mol•L-1的Na2S2O3标准液滴定至终点。
已知:i.2Cu2++4I-=2CuI↓+I2;2S2O
 +I2=S4O
+I2=S4O +2I-;
+2I-;ii.I2+I-
 I
I ,CuI沉淀强烈吸附I
,CuI沉淀强烈吸附I ;
;iii.Ksp(CuI)=1.0×10-12;Ksp(CuSCN)=4.8×10-15
①以淀粉为指示剂,滴定终点的颜色变化为
②通过实验探究,在滴定过程中加入KSCN可使测定结果更准确,写出发生反应的离子方程式
您最近一年使用:0次
2024-04-05更新
|
61次组卷
|
3卷引用:山东省青岛第十五中学2023-2024学年高二下学期期初考试化学试卷
名校
解题方法
2 . I.铁及其化合物在工业生产中有着重要的用途,其“价—类”二维图如图。

(1)下列推断不合理的是______ 。
(2)用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是______ 。
a.若无固体存在,则溶液中一定有Fe3+
b.若有固体存在,则溶液中一定有Fe2+
c.若溶液中有Cu2+,则可能有固体存在
d.若溶液中有Fe3+,则可能有Cu析出
Ⅱ.现有含少量杂质的FeCl3•nH2O,为测定n值进行如下实验:
①称取ag样品配成250mL溶液,加入稍过量锌粒将Fe3+还原为Fe2+,过滤;取25.00mL所得滤液,恰好与VmLcmol/L的K2Cr2O7溶液完全反应;
(已知Cr2O +Fe2++H+→Cr3++Fe3++H2O未配平,杂质、Cl-、Zn2+不参与反应)。
+Fe2++H+→Cr3++Fe3++H2O未配平,杂质、Cl-、Zn2+不参与反应)。
②另取ag样品,在脱水剂SOCl2蒸汽作用下,加热至恒重,测得固体质量为bg。(SOCl2遇水极易反应生成气体,该过程中FeCl3未升华)。
(3)加入稍过量的锌粒后,检验溶液中是否存在Fe3+的试剂为_______ 。
(4)若将SO2通入氯化铁溶液,可以使溶液颜色变绿,写出反应的离子方程式:_______ 。
(5)n=_______ ,下列情况会导致n测量值偏小的是_______ (填标号)。
A.实验①中,称重后样品发生了潮解
B.实验①中配制溶液时,俯视刻度线定容
C.实验①中配制溶液时,未对所用过的烧杯和玻璃棒进行洗涤
D.实验②中样品与SOCl2反应时,失水不充分

(1)下列推断不合理的是
| A.FeCl2和FeCl3可通过化合反应相互转化 |
| B.Fe2+既可被氧化,也可被还原 |
| C.FeO在空气中受热,能迅速生成Fe2O3 |
| D.存在Fe3+→Fe2+→Fe(OH)2→Fe(OH)3→Fe3+的循环转化关系 |
(2)用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
a.若无固体存在,则溶液中一定有Fe3+
b.若有固体存在,则溶液中一定有Fe2+
c.若溶液中有Cu2+,则可能有固体存在
d.若溶液中有Fe3+,则可能有Cu析出
Ⅱ.现有含少量杂质的FeCl3•nH2O,为测定n值进行如下实验:
①称取ag样品配成250mL溶液,加入稍过量锌粒将Fe3+还原为Fe2+,过滤;取25.00mL所得滤液,恰好与VmLcmol/L的K2Cr2O7溶液完全反应;
(已知Cr2O
 +Fe2++H+→Cr3++Fe3++H2O未配平,杂质、Cl-、Zn2+不参与反应)。
+Fe2++H+→Cr3++Fe3++H2O未配平,杂质、Cl-、Zn2+不参与反应)。②另取ag样品,在脱水剂SOCl2蒸汽作用下,加热至恒重,测得固体质量为bg。(SOCl2遇水极易反应生成气体,该过程中FeCl3未升华)。
(3)加入稍过量的锌粒后,检验溶液中是否存在Fe3+的试剂为
(4)若将SO2通入氯化铁溶液,可以使溶液颜色变绿,写出反应的离子方程式:
(5)n=
A.实验①中,称重后样品发生了潮解
B.实验①中配制溶液时,俯视刻度线定容
C.实验①中配制溶液时,未对所用过的烧杯和玻璃棒进行洗涤
D.实验②中样品与SOCl2反应时,失水不充分
您最近一年使用:0次
解题方法
3 . 六水硫酸亚铁铵 俗称莫尔盐,易溶于水,是一种常见的补血剂。硫酸铵可用来制备莫尔盐。回答下列问题:
俗称莫尔盐,易溶于水,是一种常见的补血剂。硫酸铵可用来制备莫尔盐。回答下列问题:
(1)某研究小组利用含硫酸铜的工业废液制备硫酸铵,流程如下:
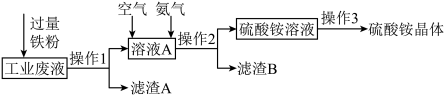
操作1的名称为___________ ;滤渣 的成分为
的成分为___________ (填化学式);操作3中蒸发时,需要的主要仪器除铁架台(带铁圈)、酒精灯外,还有___________ ,当蒸发浓缩___________ 至停止加热,冷却结晶。
(2)将物质的量之比为 的莫尔盐与
的莫尔盐与 在水溶液中反应,离子方程式为
在水溶液中反应,离子方程式为___________ 。
(3)现有放置7天的莫尔盐溶液,测得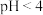 ,取
,取 该溶液,滴加5滴
该溶液,滴加5滴 溶液,发现变为浅红色,原因是
溶液,发现变为浅红色,原因是___________ ;另取 该溶液,加入
该溶液,加入 维生素
维生素 并溶解,测得
并溶解,测得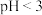 ,滴加5滴
,滴加5滴 溶液后,溶液不变红,同学甲得出结论:维生素C具有还原性。同学乙认为甲的结论不严谨,应补充对照实验,原因是
溶液后,溶液不变红,同学甲得出结论:维生素C具有还原性。同学乙认为甲的结论不严谨,应补充对照实验,原因是___________ 。
 俗称莫尔盐,易溶于水,是一种常见的补血剂。硫酸铵可用来制备莫尔盐。回答下列问题:
俗称莫尔盐,易溶于水,是一种常见的补血剂。硫酸铵可用来制备莫尔盐。回答下列问题:(1)某研究小组利用含硫酸铜的工业废液制备硫酸铵,流程如下:

操作1的名称为
 的成分为
的成分为(2)将物质的量之比为
 的莫尔盐与
的莫尔盐与 在水溶液中反应,离子方程式为
在水溶液中反应,离子方程式为(3)现有放置7天的莫尔盐溶液,测得
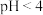 ,取
,取 该溶液,滴加5滴
该溶液,滴加5滴 溶液,发现变为浅红色,原因是
溶液,发现变为浅红色,原因是 该溶液,加入
该溶液,加入 维生素
维生素 并溶解,测得
并溶解,测得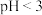 ,滴加5滴
,滴加5滴 溶液后,溶液不变红,同学甲得出结论:维生素C具有还原性。同学乙认为甲的结论不严谨,应补充对照实验,原因是
溶液后,溶液不变红,同学甲得出结论:维生素C具有还原性。同学乙认为甲的结论不严谨,应补充对照实验,原因是
您最近一年使用:0次
解题方法
4 . 低品位铜矿(主要含CuS、FeO)提铜是解决我国铜产量低这一问题的重要技术,利用低品位铜矿制备Cu2O的一种工艺流程如下图所示:

已知:Ⅰ.MnCO3难溶于水,CuS难溶于水及强酸。
Ⅱ.Cu2O是一种难溶于水的红色物质。
回答下列问题:
(1)“溶浸”包括以下操作:研磨、混合、加热并搅拌、冷却、______ 。“溶浸”中MnO2的作用是______ 。
(2)检验“溶浸”后所得溶液中是否含有 的试剂是
的试剂是______ 。
(3)“调pH”后判断 是否完全沉淀的操作是
是否完全沉淀的操作是______ 。
(4)“还原”中还原产物与氧化产物的物质的量之比为______ 。
(5)将Cu2O固体加入过量稀硫酸中,溶液变成蓝色,且仍有红色固体存在,发生反应的离子方程式为______ 。
(6)有人提出“将低品位铜矿灼烧后用酸溶解制得铜盐”的工艺流程,该流程不足之处有______ (写出一项即可)。

已知:Ⅰ.MnCO3难溶于水,CuS难溶于水及强酸。
Ⅱ.Cu2O是一种难溶于水的红色物质。
回答下列问题:
(1)“溶浸”包括以下操作:研磨、混合、加热并搅拌、冷却、
(2)检验“溶浸”后所得溶液中是否含有
 的试剂是
的试剂是(3)“调pH”后判断
 是否完全沉淀的操作是
是否完全沉淀的操作是(4)“还原”中还原产物与氧化产物的物质的量之比为
(5)将Cu2O固体加入过量稀硫酸中,溶液变成蓝色,且仍有红色固体存在,发生反应的离子方程式为
(6)有人提出“将低品位铜矿灼烧后用酸溶解制得铜盐”的工艺流程,该流程不足之处有
您最近一年使用:0次
名校
5 . 工业上用赤铁矿(主要成分为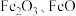 ,含
,含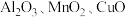 等杂质)制备绿矾
等杂质)制备绿矾 的流程如下:
的流程如下: 能与
能与 溶液反应生成可溶性盐
溶液反应生成可溶性盐 。
。
回答下列问题:
(1)试剂a为___________ 。
(2)试剂b需过量,其目的是___________ ;“滤渣”的成分是___________ 。
(3)“结晶”需隔绝空气,原因是___________ 。
(4)绿矾隔绝空气加强热可用于制备红色颜料铁红。取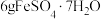 样品隔绝空气加热(杂质不反应),受热过程中样品质量随温度变化的曲线如图所示(已知固体
样品隔绝空气加热(杂质不反应),受热过程中样品质量随温度变化的曲线如图所示(已知固体 不含结晶水)。
不含结晶水)。 主要成分的化学式为
主要成分的化学式为___________ 。
②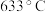 时,除生成铁红外,同时生成能使
时,除生成铁红外,同时生成能使 溶液变浑浊的气体和使品红溶液裉色的气体。该温度下反应的化学方程式为
溶液变浑浊的气体和使品红溶液裉色的气体。该温度下反应的化学方程式为___________ ;该样品中 的质量分数为
的质量分数为___________  (保留一位小数)。
(保留一位小数)。
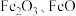 ,含
,含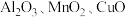 等杂质)制备绿矾
等杂质)制备绿矾 的流程如下:
的流程如下: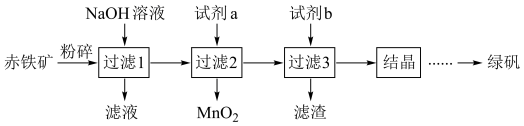
 能与
能与 溶液反应生成可溶性盐
溶液反应生成可溶性盐 。
。回答下列问题:
(1)试剂a为
(2)试剂b需过量,其目的是
(3)“结晶”需隔绝空气,原因是
(4)绿矾隔绝空气加强热可用于制备红色颜料铁红。取
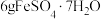 样品隔绝空气加热(杂质不反应),受热过程中样品质量随温度变化的曲线如图所示(已知固体
样品隔绝空气加热(杂质不反应),受热过程中样品质量随温度变化的曲线如图所示(已知固体 不含结晶水)。
不含结晶水)。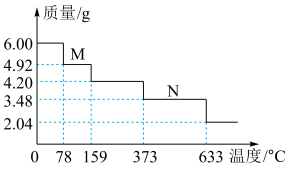
 主要成分的化学式为
主要成分的化学式为②
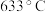 时,除生成铁红外,同时生成能使
时,除生成铁红外,同时生成能使 溶液变浑浊的气体和使品红溶液裉色的气体。该温度下反应的化学方程式为
溶液变浑浊的气体和使品红溶液裉色的气体。该温度下反应的化学方程式为 的质量分数为
的质量分数为 (保留一位小数)。
(保留一位小数)。
您最近一年使用:0次
2024-02-02更新
|
264次组卷
|
3卷引用:山东省潍坊市2023-2024学年高一上学期期末考试化学试题
解题方法
6 . 某化学兴趣小组为探究菠菜中铁元素的价态及含量,进行如下实验。回答下列问题:
I.定性检测菠菜中的铁元素

(1)研磨需要的仪器名称为___________ ,操作I的名称为___________ 。
(2)甲同学根据实验现象推测菠菜中不含铁元素。乙同学认为菠菜中铁元素可能以Fe2+形式存在,并对实验进行如下改进:

“溶液褪色”不能证明菠菜中含有Fe2+的原因是___________ ,若“现象I”为___________ ,则可证明菠菜中铁元素以Fe2+存在。
Ⅱ.定量测定菠菜中铁元素含量

(3)沉淀法:取 滤液Ⅱ,加入足量
滤液Ⅱ,加入足量 溶液,生成沉淀,静置一段时间,沉淀颜色逐渐加深,过滤、洗涤、灼烧、冷却、称量、计算。用化学方程式说明沉淀颜色加深的原因是
溶液,生成沉淀,静置一段时间,沉淀颜色逐渐加深,过滤、洗涤、灼烧、冷却、称量、计算。用化学方程式说明沉淀颜色加深的原因是___________ 。
(4)比色法:另取 滤液Ⅱ,加入足量稀硝酸,配制成
滤液Ⅱ,加入足量稀硝酸,配制成 溶液,使用分光光度计测得待测液中
溶液,使用分光光度计测得待测液中 吸光度位于图中
吸光度位于图中 点。
点。

稀 与
与 反应的离子方程式为
反应的离子方程式为_______ ;菠菜中铁元素的含量为________  。
。
I.定性检测菠菜中的铁元素

(1)研磨需要的仪器名称为
(2)甲同学根据实验现象推测菠菜中不含铁元素。乙同学认为菠菜中铁元素可能以Fe2+形式存在,并对实验进行如下改进:

“溶液褪色”不能证明菠菜中含有Fe2+的原因是
Ⅱ.定量测定菠菜中铁元素含量

(3)沉淀法:取
 滤液Ⅱ,加入足量
滤液Ⅱ,加入足量 溶液,生成沉淀,静置一段时间,沉淀颜色逐渐加深,过滤、洗涤、灼烧、冷却、称量、计算。用化学方程式说明沉淀颜色加深的原因是
溶液,生成沉淀,静置一段时间,沉淀颜色逐渐加深,过滤、洗涤、灼烧、冷却、称量、计算。用化学方程式说明沉淀颜色加深的原因是(4)比色法:另取
 滤液Ⅱ,加入足量稀硝酸,配制成
滤液Ⅱ,加入足量稀硝酸,配制成 溶液,使用分光光度计测得待测液中
溶液,使用分光光度计测得待测液中 吸光度位于图中
吸光度位于图中 点。
点。
稀
 与
与 反应的离子方程式为
反应的离子方程式为 。
。
您最近一年使用:0次
名校
7 . 氯化亚铜(CuCl)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产CuCl的工艺如图:
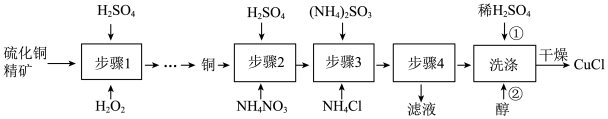
已知:CuCl难溶于醇和水,溶于 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。
(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是___________ 。
(2)步骤4进行的实验操作是___________ 。
(3)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是___________ 。用乙醇洗涤的目的是___________ 。
(4)产品纯度测定:称取CuCl产品ag于锥形瓶中,加入足量的酸性Fe2(SO4)3溶液使其充分溶解,然后用0.1000mol/LKMnO4标准溶液滴定Fe2+,消耗KMnO4溶液bmL(本实验中 的被还原为Mn2+,不与产品中杂质和Cl﹣反应)。
的被还原为Mn2+,不与产品中杂质和Cl﹣反应)。
①CuCl溶于Fe2(SO4)3溶液的离子方程式是___________ 。
②产品中CuCl的质量分数为___________ (列计算式即可)。

已知:CuCl难溶于醇和水,溶于
 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是
(2)步骤4进行的实验操作是
(3)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是
(4)产品纯度测定:称取CuCl产品ag于锥形瓶中,加入足量的酸性Fe2(SO4)3溶液使其充分溶解,然后用0.1000mol/LKMnO4标准溶液滴定Fe2+,消耗KMnO4溶液bmL(本实验中
 的被还原为Mn2+,不与产品中杂质和Cl﹣反应)。
的被还原为Mn2+,不与产品中杂质和Cl﹣反应)。①CuCl溶于Fe2(SO4)3溶液的离子方程式是
②产品中CuCl的质量分数为
您最近一年使用:0次
名校
解题方法
8 . 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取 晶体。(图中夹持及尾气处理装置均已略去)请回答下列问题:
晶体。(图中夹持及尾气处理装置均已略去)请回答下列问题:
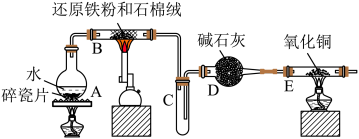
(1)装置 中发生反应的化学方程式是
中发生反应的化学方程式是___________ 。
(2) 中出现的现象是
中出现的现象是___________ 。
(3)该小组把 中反应后的产物加入足量的盐酸,用该溶液制取
中反应后的产物加入足量的盐酸,用该溶液制取 晶体。
晶体。
①欲检验溶液中含有 ,选用的试剂为
,选用的试剂为___________ ,现象是___________ 。
②该实验小组同学用上述试剂没有检测到 ,用离子方程式解释滤液中不存在
,用离子方程式解释滤液中不存在 可能的原因:
可能的原因:___________ 。
③将此滤液中 完全氧化为
完全氧化为 最好选择下列物质中的
最好选择下列物质中的___________ 。
A.酸性 溶液 B.
溶液 B. C.
C. D.
D.
④在③所得溶液浓缩结晶前需要用实验证明 已完全氧化,实验方法是
已完全氧化,实验方法是___________ 。
(4)取少量 于试管中,滴加
于试管中,滴加 溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:
溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:___________
______ ______
______ ______
______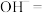 ______
______ ,该反应中
,该反应中 表现了
表现了___________ 性(填“氧化”或“还原”)。
 晶体。(图中夹持及尾气处理装置均已略去)请回答下列问题:
晶体。(图中夹持及尾气处理装置均已略去)请回答下列问题:
(1)装置
 中发生反应的化学方程式是
中发生反应的化学方程式是(2)
 中出现的现象是
中出现的现象是(3)该小组把
 中反应后的产物加入足量的盐酸,用该溶液制取
中反应后的产物加入足量的盐酸,用该溶液制取 晶体。
晶体。①欲检验溶液中含有
 ,选用的试剂为
,选用的试剂为②该实验小组同学用上述试剂没有检测到
 ,用离子方程式解释滤液中不存在
,用离子方程式解释滤液中不存在 可能的原因:
可能的原因:③将此滤液中
 完全氧化为
完全氧化为 最好选择下列物质中的
最好选择下列物质中的A.酸性
 溶液 B.
溶液 B. C.
C. D.
D.
④在③所得溶液浓缩结晶前需要用实验证明
 已完全氧化,实验方法是
已完全氧化,实验方法是(4)取少量
 于试管中,滴加
于试管中,滴加 溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:
溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:______
 ______
______ ______
______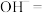 ______
______ ,该反应中
,该反应中 表现了
表现了
您最近一年使用:0次
名校
解题方法
9 . 硫酸亚铁是一种重要的工业原料,同时也可以用于制造补血药物,但其具有毒性,故严禁在食品中滥用硫酸亚铁,请回答下列问题:
I.
(1)下列说法中正确的是___________(填字母)。
Ⅱ.某同学为探究富含硫酸亚铁且保存时间较长的糕点情况,设计了如下实验方案:

(2)试剂1的名称是___________ 。
(3)加入新制氯水后,溶液红色加深的原因是___________ (用离子方程式表示)。
(4)该同学实验中加入过量新制氯水,放置一段时间后,深红色褪去,现对褪色原因进行探究(已知SCN-有还原性)。
①【提出假设】
假设1:溶液中的+3价铁被氧化为更高的价态。
假设2:___________ 。
②【设计方案】
为了对假设2进行验证,简述你的设计方案:___________ 。
(5)将铜片放入0.1mol/LFeCl3溶液中浸泡,一段时间,溶液中c(Fe3+):c(Fe2+)=2:3,则此时Cu2+与Fe3+的物质的量之比为___________ 。
I.
(1)下列说法中正确的是___________(填字母)。
| A.向FeSO4溶液中加入铜粉可以析出铁单质 |
| B.大量服用FeSO4导致人体中毒可能与其氧化性有关 |
| C.FeSO4可以使酸性KMnO4溶液褪色 |
| D.FeSO4需密封保存主要原因是硫酸亚铁有毒 |
Ⅱ.某同学为探究富含硫酸亚铁且保存时间较长的糕点情况,设计了如下实验方案:

(2)试剂1的名称是
(3)加入新制氯水后,溶液红色加深的原因是
(4)该同学实验中加入过量新制氯水,放置一段时间后,深红色褪去,现对褪色原因进行探究(已知SCN-有还原性)。
①【提出假设】
假设1:溶液中的+3价铁被氧化为更高的价态。
假设2:
②【设计方案】
为了对假设2进行验证,简述你的设计方案:
(5)将铜片放入0.1mol/LFeCl3溶液中浸泡,一段时间,溶液中c(Fe3+):c(Fe2+)=2:3,则此时Cu2+与Fe3+的物质的量之比为
您最近一年使用:0次
名校
10 . 铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
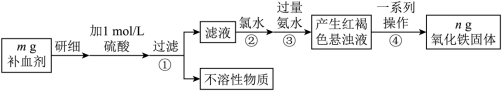
(1)实验中配制480 mL 1 mol/L的硫酸溶液,量取18.4 mol/L的浓硫酸_____ mL。
(2)步骤②加入过量氯水后发生反应的离子方程式为_______ 。
(3)步骤④中一系列操作步骤为______ 、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为_______ 。
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol/L的硫酸溶液,过滤。取滤液加________ 溶液(填写化学式),溶液变红说明该补血剂已部分变质。
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是___________。

(1)实验中配制480 mL 1 mol/L的硫酸溶液,量取18.4 mol/L的浓硫酸
(2)步骤②加入过量氯水后发生反应的离子方程式为
(3)步骤④中一系列操作步骤为
(4)若实验无损耗,则该补血剂含铁元素的质量分数为
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol/L的硫酸溶液,过滤。取滤液加
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是___________。
| A.氯水 | B.酸性KMnO4溶液 | C.铁粉 | D.FeCl3溶液 |
您最近一年使用:0次



