1 . 实验室用如下装置制取氯气,并进行氯气性质实验。回答下列问题:

已知:E中放置干燥红色布条,F中放置湿润红色布条。
(1)A中盛有浓盐酸,B中盛有 。加热时B中的化学方程式为
。加热时B中的化学方程式为___________ 。
(2)在实验室通过KMnO4与浓盐酸常温下反应也可制取氯气,据此推断KMnO4、Cl2、MnO2三种物质的氧化性由强到弱的顺序为___________ (用化学式表示)。
(3)D中盛放的试剂为___________ 。
(4)对比E和F中现象的差异可得出的结论是___________ 。
(5)实验后观察到G中溶液呈棕黄色,同学们猜测氧化产物可能有以下三种情况:
猜测1:只有Fe3+;
猜测2:只有I2;
猜测3:既有Fe3+又有I2。
于是取上述实验后G中的溶液进行如下实验:
①加入___________ 溶液,溶液未出现红色,证明猜测1和猜测3不正确;
②再加入___________ (填试剂和现象)证明猜测2正确。
由此得出离子的还原性Fe2+___________ I-(填“大于”,“等于”,“小于”)。
(6)H装置可用于模拟工业制造漂白粉的原理,实验后制得产品的有效成分是___________ (填化学式)。

已知:E中放置干燥红色布条,F中放置湿润红色布条。
(1)A中盛有浓盐酸,B中盛有
 。加热时B中的化学方程式为
。加热时B中的化学方程式为(2)在实验室通过KMnO4与浓盐酸常温下反应也可制取氯气,据此推断KMnO4、Cl2、MnO2三种物质的氧化性由强到弱的顺序为
(3)D中盛放的试剂为
(4)对比E和F中现象的差异可得出的结论是
(5)实验后观察到G中溶液呈棕黄色,同学们猜测氧化产物可能有以下三种情况:
猜测1:只有Fe3+;
猜测2:只有I2;
猜测3:既有Fe3+又有I2。
于是取上述实验后G中的溶液进行如下实验:
①加入
②再加入
由此得出离子的还原性Fe2+
(6)H装置可用于模拟工业制造漂白粉的原理,实验后制得产品的有效成分是
您最近一年使用:0次
2 . 电子工业中常用FeCl3溶液做“腐蚀液”,腐蚀覆铜板制作印刷电路板。为使“腐蚀液”能得到循环利用并回收铜的流程图如下:
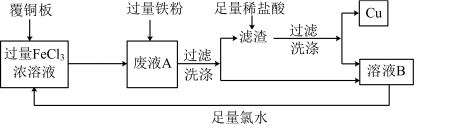
(1)写出FeCl3溶液与铜反应的离子方程式___________ 。
(2)滤渣的成分为___________ (填化学式)。
(3)加足量氯水后反应的离子方程式为___________ 。
(4)将少量溶液B滴入氢氧化钠溶液中,产生的现象是___________ 。
(5)能在酸性环境下将Fe2+氧化为Fe3+的氧化剂有KMnO4、KClO3、H2O2、Cl2等。已知下列四种氧化剂氧化Fe2+后对应的还原产物如下:
①判断等物质的量的四种氧化剂分别与足量的酸性FeSO4溶液反应,得到Fe3+最多的是___________ (填化学式)。
②写出KClO3溶液与酸性FeSO4溶液反应的离子方程式___________ 。
(6)取废液A加入12.6 g铁粉,充分反应后过滤、洗涤、干燥得滤渣 11.0 g,滤渣与足量盐酸反应后过滤、洗涤、干燥得到9.6 g Cu。合并两次的滤液和洗涤液得溶液B 500 mL,则溶液B中含FeCl2的物质的量浓度为___________ mol/L。

(1)写出FeCl3溶液与铜反应的离子方程式
(2)滤渣的成分为
(3)加足量氯水后反应的离子方程式为
(4)将少量溶液B滴入氢氧化钠溶液中,产生的现象是
(5)能在酸性环境下将Fe2+氧化为Fe3+的氧化剂有KMnO4、KClO3、H2O2、Cl2等。已知下列四种氧化剂氧化Fe2+后对应的还原产物如下:
| 氧化剂 | KMnO4 | KClO3 | H2O2 | Cl2 |
| 还原产物 | Mn2+ | Cl- | H2O | Cl- |
②写出KClO3溶液与酸性FeSO4溶液反应的离子方程式
(6)取废液A加入12.6 g铁粉,充分反应后过滤、洗涤、干燥得滤渣 11.0 g,滤渣与足量盐酸反应后过滤、洗涤、干燥得到9.6 g Cu。合并两次的滤液和洗涤液得溶液B 500 mL,则溶液B中含FeCl2的物质的量浓度为
您最近一年使用:0次
解题方法
3 . 高铁酸钾( )是一种高效、无毒的强氧化剂。在工业上,一种通过
)是一种高效、无毒的强氧化剂。在工业上,一种通过 溶液制备
溶液制备 的工艺流程如图所示。回答下列问题:
的工艺流程如图所示。回答下列问题:

(1) 中Fe元素的化合价为
中Fe元素的化合价为______ 价,NaOH的电子式为______ 。
(2)“氧化、沉淀”时,氧化剂和还原剂的物质的量之比为______ 。Fe2+在溶液中放置不稳定,易被氧化成Fe3+,用KSCN溶液检验溶液中的Fe3+是较好的方法,此法的离子方程式为______ 。
(3)通过“氧化”时发生的反应可知,在该条件下物质氧化性:
______ NaClO(填“>”或“<”)。
(4)“转化”时,发生反应的化学方程式为______ ,说明物质的溶解度
______ (填“>”或“<”) 。
。
 )是一种高效、无毒的强氧化剂。在工业上,一种通过
)是一种高效、无毒的强氧化剂。在工业上,一种通过 溶液制备
溶液制备 的工艺流程如图所示。回答下列问题:
的工艺流程如图所示。回答下列问题:
(1)
 中Fe元素的化合价为
中Fe元素的化合价为(2)“氧化、沉淀”时,氧化剂和还原剂的物质的量之比为
(3)通过“氧化”时发生的反应可知,在该条件下物质氧化性:

(4)“转化”时,发生反应的化学方程式为

 。
。
您最近一年使用:0次
名校
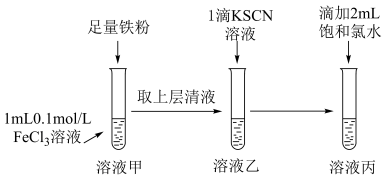
4 . 某兴趣小组,用如图所示实验方案探究 与
与 的相互转化,在控制其它试剂用量相同的条件下,改变KSCN溶液的用量,出现了异常现象。实验结果如下表所示。
的相互转化,在控制其它试剂用量相同的条件下,改变KSCN溶液的用量,出现了异常现象。实验结果如下表所示。
回答下列问题:
(1)试管1中发生反应的离子方程式为___________ 。
(2)编号①试管3中发生反应的离子方程式为___________ 和 。
。
(3)进一步探究编号②试管3中溶液褪色的原因,同学甲提出如下假设并设计了实验。
假设1:溶液褪色的原因是KSCN被转化。
假设2:溶液褪色的原因是___________ 。
同学乙查阅资料发现 可以被氧化成
可以被氧化成 ,请设计实验证明:
,请设计实验证明:
(4)编号③中未观察到溶液变红,可能的原因是___________ 。
 与
与 的相互转化,在控制其它试剂用量相同的条件下,改变KSCN溶液的用量,出现了异常现象。实验结果如下表所示。
的相互转化,在控制其它试剂用量相同的条件下,改变KSCN溶液的用量,出现了异常现象。实验结果如下表所示。
| 实验编号 |  /( /( ) ) | 试管1 | 试管2 | 试管3 |
| ① | 1 | 溶液由棕黄色变为浅绿色 | 无明显现象 | 溶液变为红色 |
| ② | 0.1 | 溶液变为红色,而后红色褪去 | ||
| ③ | 0.01 | 溶液变为棕黄色,未见红色 |
(1)试管1中发生反应的离子方程式为
(2)编号①试管3中发生反应的离子方程式为
 。
。(3)进一步探究编号②试管3中溶液褪色的原因,同学甲提出如下假设并设计了实验。
假设1:溶液褪色的原因是KSCN被转化。
假设2:溶液褪色的原因是
| 实验操作 | 实验现象 | 实验结论 |
| 取两份褪色后的溶液1mL于试管A、B中, | ||
| 往试管A中滴加 | 溶液恢复红色 | 假设1成立 |
| 往试管B中滴加 | 溶液未恢复红色 | 假设2不成立 |
 可以被氧化成
可以被氧化成 ,请设计实验证明:
,请设计实验证明:(4)编号③中未观察到溶液变红,可能的原因是
您最近一年使用:0次
2023-12-08更新
|
195次组卷
|
2卷引用:重庆市长寿区八校联考2023-2024学年高一上学期1月期末化学试题
名校
解题方法
5 . 铁是人类使用最早的金属之一。运用所学知识,回答下列问题:
(1)电子工业用 溶液腐蚀覆在绝缘板上的铜,制造印刷电路板,请写出
溶液腐蚀覆在绝缘板上的铜,制造印刷电路板,请写出 溶液与铜反应的化学方程式为
溶液与铜反应的化学方程式为_______ 。
(2)某研究性学习小组为测定 溶液腐蚀铜后所得溶液的组成,进行了如下实验:
溶液腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子有_______ 。
②溶液组成测定:取50.0mL待测溶液,加入足量的 溶液,得到14.35g白色沉淀,则溶液中
溶液,得到14.35g白色沉淀,则溶液中
_______  。
。
③验证该溶液中是否含有 ,正确的实验方法是
,正确的实验方法是_______ (填序号)。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有
C.取适量溶液先滴入双氧水再滴入KSCN溶液,若溶液显红色,证明原溶液中含有
D.取适量溶液,滴入 溶液,若产生蓝色沉淀,证明含有
溶液,若产生蓝色沉淀,证明含有
(3)工程师欲从制造印刷电路板的废液中回收铜,并获得 溶液,设计如下方案:
溶液,设计如下方案:
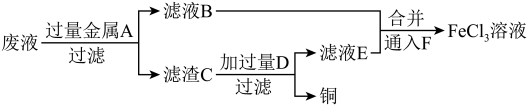
①滤渣C中物质的化学式为_______ 。
②加入过量D发生反应的离子方程式为_______ 。
③向滤液B和滤液E中通入F的目的是_______ ,该反应的离子方程式为_______ 。
④向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是_______ (填序号)。
A.有铜单质剩余但无铁单质剩余 B.有铁单质剩余但无铜单质剩余
C.铁、铜单质都有剩余 D.铁、铜单质都无剩余
(1)电子工业用
 溶液腐蚀覆在绝缘板上的铜,制造印刷电路板,请写出
溶液腐蚀覆在绝缘板上的铜,制造印刷电路板,请写出 溶液与铜反应的化学方程式为
溶液与铜反应的化学方程式为(2)某研究性学习小组为测定
 溶液腐蚀铜后所得溶液的组成,进行了如下实验:
溶液腐蚀铜后所得溶液的组成,进行了如下实验:①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子有
②溶液组成测定:取50.0mL待测溶液,加入足量的
 溶液,得到14.35g白色沉淀,则溶液中
溶液,得到14.35g白色沉淀,则溶液中
 。
。③验证该溶液中是否含有
 ,正确的实验方法是
,正确的实验方法是A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有

C.取适量溶液先滴入双氧水再滴入KSCN溶液,若溶液显红色,证明原溶液中含有

D.取适量溶液,滴入
 溶液,若产生蓝色沉淀,证明含有
溶液,若产生蓝色沉淀,证明含有
(3)工程师欲从制造印刷电路板的废液中回收铜,并获得
 溶液,设计如下方案:
溶液,设计如下方案:
①滤渣C中物质的化学式为
②加入过量D发生反应的离子方程式为
③向滤液B和滤液E中通入F的目的是
④向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.有铜单质剩余但无铁单质剩余 B.有铁单质剩余但无铜单质剩余
C.铁、铜单质都有剩余 D.铁、铜单质都无剩余
您最近一年使用:0次
名校
6 . 铁红( )可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含
)可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含 和少量
和少量 )制取铁红,所设计的流程如下:
)制取铁红,所设计的流程如下:
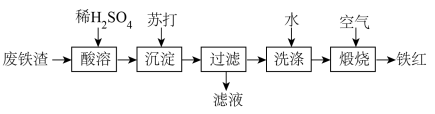
请回答下列问题:
(1)苏打的化学式为_______ ;沉淀的化学式为_______ ;“滤液”中主要溶质的化学式为_______
(2)要检测“酸溶”后,溶液中是否含有 所用的试剂是
所用的试剂是_______ ;若溶液中检测不到 的原因是
的原因是_______ ;
(3)“酸溶”时, 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为_______
(4)实验室过滤所需的玻璃仪器有_______
(5)煅烧的化学方程式为_______
 )可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含
)可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含 和少量
和少量 )制取铁红,所设计的流程如下:
)制取铁红,所设计的流程如下:
请回答下列问题:
(1)苏打的化学式为
(2)要检测“酸溶”后,溶液中是否含有
 所用的试剂是
所用的试剂是 的原因是
的原因是(3)“酸溶”时,
 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为(4)实验室过滤所需的玻璃仪器有
(5)煅烧的化学方程式为
您最近一年使用:0次
2023-02-11更新
|
379次组卷
|
2卷引用:重庆市南开中学校2022-2023学年高一上学期期末联合检测化学试题
名校
7 . 某研究性学习小组拟配制FeI2溶液并探究相关性质。
Ⅰ.配制240mL0.2mol·L-1FeI2溶液
(1)配制FeI2溶液除烧杯、量筒、胶头滴管外,
①还需要的玻璃仪器是_____ 。
②用托盘天平称量,需要称取FeI2_____ g。
③定容时,若仰视容量瓶刻度线会使配制的FeI2溶液浓度_____ 。(填“偏大”或“偏小”)
④久置的FeI2溶液容易变质,检测其是否变质的试剂为_____ 。
Ⅱ.探究Fe2+与I-的还原性强弱
取10mL上述FeI2溶液,向其中滴加少量新制的氯水,振荡后发现溶液呈黄色。
同学们对产生黄色的原因提出假设:
假设1:只有I-被少量Cl2氧化成I2溶解在溶液中,碘水为黄色,还原性:I->Fe2+;
假设2:只有Fe2+被少量Cl2氧化成Fe3+,FeCl3溶液为黄色,还原性:Fe2+>I-。
(2)设计方案,验证假设
①为______ (填“CCl4”或“苯”)。
②上层呈______ 色。
最终实验现象证实:假设1正确。
③若向20mL上述FeI2溶液通入112mL(标准状况)Cl2,反应的离子方程式为______ 。
Ⅰ.配制240mL0.2mol·L-1FeI2溶液
(1)配制FeI2溶液除烧杯、量筒、胶头滴管外,
①还需要的玻璃仪器是
②用托盘天平称量,需要称取FeI2
③定容时,若仰视容量瓶刻度线会使配制的FeI2溶液浓度
④久置的FeI2溶液容易变质,检测其是否变质的试剂为
Ⅱ.探究Fe2+与I-的还原性强弱
取10mL上述FeI2溶液,向其中滴加少量新制的氯水,振荡后发现溶液呈黄色。
同学们对产生黄色的原因提出假设:
假设1:只有I-被少量Cl2氧化成I2溶解在溶液中,碘水为黄色,还原性:I->Fe2+;
假设2:只有Fe2+被少量Cl2氧化成Fe3+,FeCl3溶液为黄色,还原性:Fe2+>I-。
(2)设计方案,验证假设
| 实验方案 | 预期现象 | 结论 |
| 向反应后的溶液中加入适量______,振荡,静置,分层,观察下层液体颜色,在上层溶液中加入KSCN溶液,观察上层颜色 | 下层呈紫红色 | 假设1正确 |
| ______ | 假设2正确 |
②上层呈
最终实验现象证实:假设1正确。
③若向20mL上述FeI2溶液通入112mL(标准状况)Cl2,反应的离子方程式为
您最近一年使用:0次
名校
解题方法
8 . 某化学兴趣小组利用如图所示的装置进行“铁与水蒸气反应”实验,并检验产物的性质。请回答下列问题:
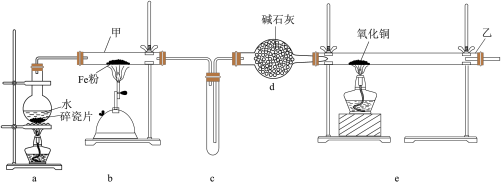
(1)组装好仪器后,应先进行的操作为_______ 。
(2)在进行实验时,应该先点燃a处的酒精灯,其原因是_______ 。
(3)仪器甲中发生反应的化学方程式为_______ 若有3mol还原剂参加反应,转移电子的物质的量为_______ mol。
(4)本实验装置存在的不足之处为_______ 。
(5)若将Fe3O4溶于足量的稀盐酸后,取少量该溶液于试管中,滴加几滴KI溶液后,为了判断KI是否发生了反应,可以选择_______进行检验。(填字母)

(1)组装好仪器后,应先进行的操作为
(2)在进行实验时,应该先点燃a处的酒精灯,其原因是
(3)仪器甲中发生反应的化学方程式为
(4)本实验装置存在的不足之处为
(5)若将Fe3O4溶于足量的稀盐酸后,取少量该溶液于试管中,滴加几滴KI溶液后,为了判断KI是否发生了反应,可以选择_______进行检验。(填字母)
| A.淀粉溶液 | B.KSCN溶液 | C.酸性高锰酸钾溶液 | D.NaOH溶液 |
您最近一年使用:0次
名校
解题方法
9 . 某学习小组为认识铁及其化合物的性质做了如下一组综合实验,根据实验流程回答相关问题:
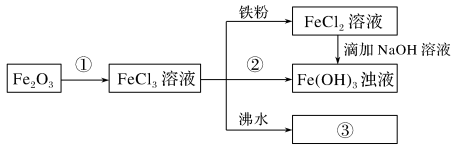
(1)物质②为_______ 。
(2)请写出FeCl3与铁粉反应的离子方程式_______ 。
(3)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为_______ ,此过程中发生的氧化还原反应为(用化学方程式表达)_______ 。
(4)检验溶液中Fe3+存在的试剂是_______ ,证明Fe3+存在的现象是_______ 。

(1)物质②为
(2)请写出FeCl3与铁粉反应的离子方程式
(3)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为
(4)检验溶液中Fe3+存在的试剂是
您最近一年使用:0次
10 . 某研究小组利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO、SiO2,其中SiO2及少量其他杂质不参与反应且难溶于水)制备绿矾(FeSO4•7H2O),其流程如图所示:
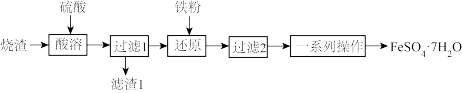
(1)“滤渣1”的主要成分是____ (填化学式)。
(2)“还原”时,主要反应的离子方程式为____ 。
(3)检验“过滤2”所得滤液中不含Fe3+的最佳试剂是____ (填化学式)。
(4)“一系列操作”中包含的操作依次有蒸发浓缩、____ 、过滤、洗涤、干燥等。
(5)利用绿矾配制的FeSO4溶液制备Fe(OH)2沉淀,其实验装置如图所示。植物油层的目的是____ 。若将制得的Fe(OH)2沉淀露置于空气中,则最终变为红褐色,则反应的化学方程式为____ 。


(1)“滤渣1”的主要成分是
(2)“还原”时,主要反应的离子方程式为
(3)检验“过滤2”所得滤液中不含Fe3+的最佳试剂是
(4)“一系列操作”中包含的操作依次有蒸发浓缩、
(5)利用绿矾配制的FeSO4溶液制备Fe(OH)2沉淀,其实验装置如图所示。植物油层的目的是

您最近一年使用:0次
2022-04-06更新
|
274次组卷
|
2卷引用:重庆实验外国语学校2022-2023学年高一上学期1月期末考试化学试题



