1 . 高铁酸钾(K2FeO4) 是一新型高效无毒的多功能水处理剂,可除水中氨氮、硫化物、藻类等。K2FeO4易溶于水,微溶于浓KOH溶液,在0~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
I.制备K2FeO4
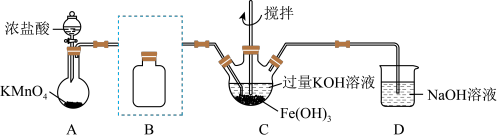
实验室利用如图装置制备K2FeO4,其原理如下:3Cl2+ 2Fe(OH)3+10KOH= 2K2FeO4+ 6KCl+ 8H2O。

(1)D仪器的名称是_______ ,A中反应的化学方程式为_______ 。
(2)B中饱和食盐水的作用是_______ , 实验时C采用冰水浴的原因是_______ 。
(3)D中盛装的试剂可选用_______(双选,填选项字母)。
(4)C中制备目标产物的离子方程式:_______
(5)若用图乙代替A装置,则分液漏斗中的浓盐酸更易顺利流下,则a管的作用是_______ 。

II.探究K2FeO4的性质
某研究性小组通过K2FeO4与Na2S的反应来探究K2FeO4的性质。
已知:①Fe2+遇铁氰化钾(K3[Fe(CN)6]) 溶液,可产生蓝色沉淀。
②BaS是黄色或黑红粉末,遇水逐渐水解为H2S和Ba(OH)2。
实验步骤如下:
(6)配平步骤1中反应的离子方程式______
_______ +_______S2-+_______H+=_______Fe3++_______
+_______S2-+_______H+=_______Fe3++_______ +20H2O
+20H2O
(7)步骤3中溶液变红的原因可能有两个:一是K2FeO4与Na2S 反应生成Fe3+,二是_______ (用文字作答)。
III.探究K2FeO4对有机污染物的去除效果
(8)对比K2FeO4、KMnO4、 FeCl3 三种物质对有机污染物去除效果如下图所示(三种试剂的初始浓度均为2.0 ×10-4mol·L-1)。

氧化阶段,去除有机污染物效果最差的试剂是_______ ;絮凝阶段,几乎不具备絮凝能力的试剂是_______ 。综上分析,试剂_______ 兼具氧化性和絮凝性双重功效,是优异的有机污染物去除剂。
I.制备K2FeO4
实验室利用如图装置制备K2FeO4,其原理如下:3Cl2+ 2Fe(OH)3+10KOH= 2K2FeO4+ 6KCl+ 8H2O。

(1)D仪器的名称是
(2)B中饱和食盐水的作用是
(3)D中盛装的试剂可选用_______(双选,填选项字母)。
| A.NaCl | B.FeCl2 | C.H2SO4 | D.NaOH |
(5)若用图乙代替A装置,则分液漏斗中的浓盐酸更易顺利流下,则a管的作用是

II.探究K2FeO4的性质
某研究性小组通过K2FeO4与Na2S的反应来探究K2FeO4的性质。
已知:①Fe2+遇铁氰化钾(K3[Fe(CN)6]) 溶液,可产生蓝色沉淀。
②BaS是黄色或黑红粉末,遇水逐渐水解为H2S和Ba(OH)2。
实验步骤如下:
| 步骤 | 操作 | 现象 |
| 1 | 取0.1mol·L-1的Na2S溶液2mL于试管中,滴加几滴0.1mol·L-1的盐酸调至酸性,迅速加入少量K2FeO4固体,搅拌 | _____ |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 无明显现象 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 溶液变红 |
| 4 | 取步骤1中溶液,滴加BaCl2溶液 | 出现白色沉淀 |
_______
 +_______S2-+_______H+=_______Fe3++_______
+_______S2-+_______H+=_______Fe3++_______ +20H2O
+20H2O(7)步骤3中溶液变红的原因可能有两个:一是K2FeO4与Na2S 反应生成Fe3+,二是
III.探究K2FeO4对有机污染物的去除效果
(8)对比K2FeO4、KMnO4、 FeCl3 三种物质对有机污染物去除效果如下图所示(三种试剂的初始浓度均为2.0 ×10-4mol·L-1)。

氧化阶段,去除有机污染物效果最差的试剂是
您最近一年使用:0次
2 . 实验小组制备高铁酸钾 并探究其性质。
并探究其性质。
资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略)
①A为氯气发生装置,写出A中反应的离子反应方程式,并用单线桥表示电子转移_______ 。
②将除杂装置B补充完整;并标明所用试剂_______ 。
③C中得到紫色固体和溶液。C中 发生的反应有
发生的反应有_______ 、_______ 。
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 ,为证明是否
,为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
i.由方案I中溶液变红可知a中含有_______ 离子,但该离子的产生不能判断一定 将
将 氧化,还可能由
氧化,还可能由_______ 产生(用离子方程式表示)。
ii.方案II可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是_______ 。
根据 的制备实验得出:氧化性
的制备实验得出:氧化性
_______  (填“>””或“<”),而方案II实验表明,
(填“>””或“<”),而方案II实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
 并探究其性质。
并探究其性质。资料:
 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)
①A为氯气发生装置,写出A中反应的离子反应方程式,并用单线桥表示电子转移
②将除杂装置B补充完整;并标明所用试剂
③C中得到紫色固体和溶液。C中
 发生的反应有
发生的反应有(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 ,为证明是否
,为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案I | 取少量a,滴加 溶液至过量,溶液呈红色 溶液至过量,溶液呈红色 |
| 方案II | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b,取少量b,滴加盐酸,有 溶出,得到紫色溶液b,取少量b,滴加盐酸,有 产生。 产生。 |
 将
将 氧化,还可能由
氧化,还可能由ii.方案II可证明
 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是根据
 的制备实验得出:氧化性
的制备实验得出:氧化性
 (填“>””或“<”),而方案II实验表明,
(填“>””或“<”),而方案II实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
名校
解题方法
3 . 价类二维图是学习元素及其化合物知识的重要模型和工具。图1为某常见金属单质及其部分化合物的价类二维图。下列推断不合理的是


| A.b、c均可与氢碘酸反应,但反应原理不同 |
| B.h具有强氧化性,可用于饮用水的消毒,还原产物可以净水 |
| C.可通过图2装置制备物质d,且较长时间不易被氧化 |
| D.a→f→g→e的每步转化均可一步实现 |
您最近一年使用:0次
2022-10-29更新
|
455次组卷
|
2卷引用:内蒙古赤峰二中2023届高三上学期10月第二次月考化学试题



