名校
1 . 下列实验操作能达到实验目的的是( )
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将饱和FeC13溶液滴加到沸水中并不断搅拌 |
| B | 证明二氧化硫具有漂白性 | 将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色变化 |
| C | 检验Fe3+ | 向溶液中加入几滴KSCN溶液液变红色 |
| D | 验证铁比铜还原性强 | FeCl3溶液与Cu反应,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-03-08更新
|
127次组卷
|
2卷引用:四川省泸县第一中学2022-2023学年高一上学期12月月考化学试题
名校
解题方法
2 . I.无水四氯化锡(SnCl4)用于制作FTO导电玻璃,FTO导电玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等领域,可用如图所示装置制备四氯化锡。
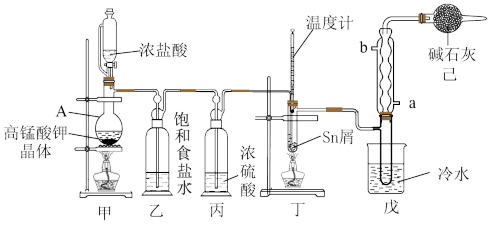
有关信息如下表所示:
(1)仪器A中发生反应的化学方程为_______
(2)将装置按图示连接好,在滴入浓盐酸之前需要什么操作_______ ,待观察到装置丁内充满黄绿色气体后,开始加热装置丁。如果缺少装置乙,装置丁内还可能发生的副反应的化学方程式为_______ ,装置已的作用是_______
II.FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了以下实验:
探究FeBr2的还原性。取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。甲同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
已知:①Br2易溶于有机溶剂四氯化碳(CCl4)且所得溶液呈橙红色;
②四氯化碳(CCl4)不溶于水且密度比水大。
(4)若假设2正确,向FeBr2溶液中通入少许Cl2,反应的离子方程式为_______ 。
(5)乙同学仔细观察发现甲同学做的实验①中,上层溶液呈浅黄色,于是他提出两个自己的观点,请你帮他补充:_______ ;_______ 。

有关信息如下表所示:
| 化学式 | Sn | SnCl2 | SnCl4 |
| 熔点/°C | 232 | 247 | -34 |
| 沸点/°C | 2602 | 623 | 114 |
| 其他性质 | 银白色固体 | 无色晶体,Sn2+易被Fe3+、I2等氧化为Sn4+ | 无色液体,易溶于水并能与水反应 |
(2)将装置按图示连接好,在滴入浓盐酸之前需要什么操作
II.FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了以下实验:
探究FeBr2的还原性。取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。甲同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
已知:①Br2易溶于有机溶剂四氯化碳(CCl4)且所得溶液呈橙红色;
②四氯化碳(CCl4)不溶于水且密度比水大。
| 实验步骤、预期现象 | 结论 |
| ①取适量溶液于试管中,向其中加入 | 假设1正确 |
| ②另取适量溶液于试管中,向其中加入 | 假设2正确 |
(5)乙同学仔细观察发现甲同学做的实验①中,上层溶液呈浅黄色,于是他提出两个自己的观点,请你帮他补充:
您最近一年使用:0次
3 . 某化学研究性学习小组模拟工业生产流程制备无水氯化铁并对产物做如下探究实验。

已知:①无水氯化铁在空气中易潮解,加热易升华;
②工业上,向500~600℃的铁屑中通入氯气可生产无水氯化铁;
③向炽热的铁屑中通入氯化氢可以生产无水氯化亚铁和氢气。
(1)仪器a的名称是_______ ,a中盛有浓盐酸,烧瓶中盛有高锰酸钾,写出烧瓶中发生反应的化学方程式为_______ 。
(2)若缺少B装置,对本实验造成的影响是_______ 。
(3)F装置的作用是_______ 。
(4)G装置可用于尾气处理,反应后 转化为
转化为 ,则装置
,则装置 中发生反应的离子方程式为
中发生反应的离子方程式为_______ 。
(5)实验结束并冷却后,将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

①淡红色溶液中加入过量H2O2溶液后,溶液红色加深的原因是_______ 。
②已知红色褪去的同时还有O2生成,该小组对红色褪去的原因进行探究。
假设1 H2O2将SCN—氧化。
假设2:_______ 将SCN—氧化。
为验证哪种假设成立,设计如下实验:
③实验Ⅰ中第1份溶液的目的是 _______ 。由实验Ⅰ和Ⅱ可得出的结论为_______ 。

已知:①无水氯化铁在空气中易潮解,加热易升华;
②工业上,向500~600℃的铁屑中通入氯气可生产无水氯化铁;
③向炽热的铁屑中通入氯化氢可以生产无水氯化亚铁和氢气。
(1)仪器a的名称是
(2)若缺少B装置,对本实验造成的影响是
(3)F装置的作用是
(4)G装置可用于尾气处理,反应后
 转化为
转化为 ,则装置
,则装置 中发生反应的离子方程式为
中发生反应的离子方程式为(5)实验结束并冷却后,将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

①淡红色溶液中加入过量H2O2溶液后,溶液红色加深的原因是
②已知红色褪去的同时还有O2生成,该小组对红色褪去的原因进行探究。
假设1 H2O2将SCN—氧化。
假设2:
为验证哪种假设成立,设计如下实验:
| 实验 | 操作 | 现象 | |
| 实验I(取褪色后溶液3等份) | 第1份 | 滴加FeCl3溶液 | 无明显变化 |
| 第2份 | 滴加KSCN溶液 | 溶液出现红色 | |
| 第3份 | 滴稀盐酸和BaCl2溶液 | 产生白色沉淀 | |
| 实验Ⅱ(取与褪色后的溶液同浓度的FeCl3溶液) | 滴加2滴KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |
您最近一年使用:0次
名校
解题方法
4 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(2)在实验室中,FeCl3可以用铁粉与_______ 反应制备,保存FeCl2溶液会加入少量铁屑,其原理是_______ (用化学方程式表示)。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①甲同学取少量待测溶液﹐滴入_______ (写出试剂名称),溶液呈红色,证明溶液中含有Fe3+。
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是_______ 。(用离子方程式和必要的文字进行解释)已知:氧化性KMnO4>Cl2
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为_______ 。
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
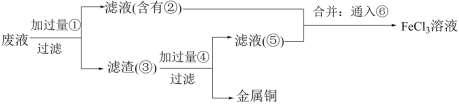
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:_______ 。用H2O2代替⑥也能实现实验目的。请写出加入H2O2的离子方程式:_______ 。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)在实验室中,FeCl3可以用铁粉与
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
①甲同学取少量待测溶液﹐滴入
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
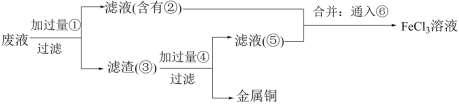
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:
您最近一年使用:0次
2022-04-05更新
|
408次组卷
|
2卷引用:四川省成都市龙泉驿区教育科学研究院2021-2022学年高二下学期期中考试化学试卷
5 . 下列实验设计不能达到实验目的的是
| 实验目的 | 实验设计 | |
| A | 检验溶液中 是否被氧化 是否被氧化 | 取少量待测液,滴加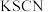 溶液,观察溶液颜色变化 溶液,观察溶液颜色变化 |
| B | 净化实验室制备的 | 气体依次通过盛有饱和 溶液、浓 溶液、浓 的洗气瓶 的洗气瓶 |
| C | 测定 溶液的pH 溶液的pH | 将待测液滴在湿润的pH试纸上,与标准比色卡对照 |
| D | 工业酒精制备无水乙醇 | 工业酒精中加生石灰,蒸馏 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-09更新
|
10208次组卷
|
37卷引用:四川省成都绵实外国语学校2021-2022学年高二下学期6月月考(理科)化学试题
四川省成都绵实外国语学校2021-2022学年高二下学期6月月考(理科)化学试题四川省成都七中(高新校区)2020-2021学年高二下学期期末零诊模拟化学试题(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题05 化学基础实验—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)专题16 基础化学实验-2022年高考化学二轮复习重点专题常考点突破练(已下线)秘籍05 微型实验方案设计与评价-备战2022年高考化学抢分秘籍(全国通用)(已下线)卷05 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷05题 化学实验基础-备战2022年高考化学临考题号押题(新高考通版)(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)专题11 基本实验专练(已下线)微专题13 亚铁离子、三价铁离子的性质及检验-备战2023年高考化学一轮复习考点微专题湖南省邵阳市第一中学2022届高三下学期第三次模拟考试化学试题(已下线)第26讲 物质的分离、提纯、检验与鉴别(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第27讲 物质的制备与性质实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)山西省芮城县陌南中学2021-2022学年高一下学期5月月考化学试题广东省普宁市华侨中学2022-2023学年高二上学期11月期中考试化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)四川省内江市第二中学2023-2024学年高三上学期12月月考理综试题2021年新高考湖南化学高考真题陕西省榆林市清源中学2020-2021学年高二下学期第二次月考化学试题(已下线)第28讲 物质的分离、提纯和检验(精练)-2022年高考化学一轮复习讲练测(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点35 化学实验方案的设计与评价-备战2022年高考化学一轮复习考点帮(浙江专用)山东省济宁市实验中学2022届高三上学期开学考试化学试题(已下线)课时53 简单实验方案的设计与评价-2022年高考化学一轮复习小题多维练(全国通用)福建省福清西山学校2021-2022学年高三上学期10月月考化学试题(已下线)考向34 物质的检验、分离和提纯-备战2022年高考化学一轮复习考点微专题广东省河源正德中学2021-2022学年高二上学期第一次段考化学试题2021年湖南省高考化学试卷变式题1-10广西桂林市第十九中学2021-2022年高二上学期期中质量检测化学试题天津市扶轮中学2022-2023学年高三上学期期末考试化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)热点题型特训 实验方案中逻辑关系的匹配判断山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期9月第一次月考化学试题天津市南开中学2024届高三下学期第五次月检测化学试卷
名校
解题方法
6 . 下列实验操作、现象、结论或解释均正确的是

| A.为测定新制氯水的pH,用玻璃棒蘸取溶液滴在pH试纸上,与标准比色卡对照即可 |
B.将少量 溶液加入 溶液加入 悬浊液中,振荡,可观察到沉淀由白色变为红褐色 悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
C.将1mLKSCN溶液与1mL同浓度的 溶液充分混合后,再继续加入KSCN溶液,溶液颜色加深,由此现象可证明溶液中存在如下平衡: 溶液充分混合后,再继续加入KSCN溶液,溶液颜色加深,由此现象可证明溶液中存在如下平衡: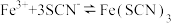 |
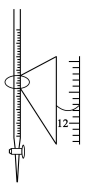
| D.由如图装置量取一定,体积的盐酸,其读数为12.20mL |
您最近一年使用:0次
2021-12-25更新
|
358次组卷
|
2卷引用:四川省成都市蓉城名校联盟2021-2022学年高二上学期期末联考化学试题
7 . 无水FeCl3常作为反应的催化剂。某研究小组设计了如下流程,以废铁屑(含有少量碳、Fe2O3和SiO2杂质)为原料制备无水FeCl3和硅胶。根据信息回答下列问题:
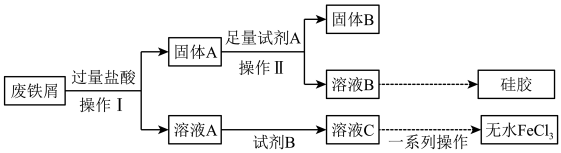
(1)操作I的名称是_______ 。
(2)若向溶液A中加入KSCN溶液无明显现象,则加入过量盐酸时,所发生的反应离子方程式有:Fe+2H+=Fe2+ +H2↑,其还原剂为_______ 。Fe2O3 +6H+=2Fe3++3H2O、_______ 。
(3)加入足量试剂A反应的离子方程式是_______ 。
(4)为避免引入新杂质,试剂B可以选用_______ (填编号)。
a. KMnO4溶液 b.氯水 c.溴水 d. H2O2溶液
(5)简述检验溶液A中阴离子的操作和现象_______ 。
(6)工业上用溶液C腐蚀铜制印刷线路板的化学方程式是_______ 。
(7)医学上也常用FeCl3作凝血剂,请简要叙述其原理_______ 。

(1)操作I的名称是
(2)若向溶液A中加入KSCN溶液无明显现象,则加入过量盐酸时,所发生的反应离子方程式有:Fe+2H+=Fe2+ +H2↑,其还原剂为
(3)加入足量试剂A反应的离子方程式是
(4)为避免引入新杂质,试剂B可以选用
a. KMnO4溶液 b.氯水 c.溴水 d. H2O2溶液
(5)简述检验溶液A中阴离子的操作和现象
(6)工业上用溶液C腐蚀铜制印刷线路板的化学方程式是
(7)医学上也常用FeCl3作凝血剂,请简要叙述其原理
您最近一年使用:0次
8 . 铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是__ 。
A.Fe B.FeCl2 C.FeCl3 D.Fe2O3
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有__ (填化学性质)。
②如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:__ 。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:
__ Fe(OH)3+__ ClO-+__ =__ FeO42-+__ Cl-+__
(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是__ ,操作I用到的玻璃仪器有烧杯、玻璃棒和__ 。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为__ 。
③上述流程中操作III包括__ 、__ 、过滤、洗涤。
(1)所含铁元素只有还原性的物质是
A.Fe B.FeCl2 C.FeCl3 D.Fe2O3
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有
②如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:
(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为
③上述流程中操作III包括
您最近一年使用:0次
2020-04-17更新
|
107次组卷
|
7卷引用:四川省南充市蓬安中学2021-2022学年高一下学期开学考试化学试题
四川省南充市蓬安中学2021-2022学年高一下学期开学考试化学试题四川省广安代市中学校2020-2021学年高一下学期入学考试化学试题【校级联考】福建省龙岩市一级达标校2018-2019学年高一上学期期末教学质量检查化学试题【校级联考】福建省龙岩市非一级达标校2018-2019学年高一上学期期末教学质量检查化学试题广西崇左市2019-2020学年高一上学期期末考试化学试题(已下线)【南昌新东方】2019 莲塘一中 高一上第二次月考(已下线)第一节 铁及其化合物(一)-2020-2021学年高一化学必修第一册课时同步练(新人教)
名校
解题方法
9 . CS(NH2)2(硫脲,白色而有光泽的晶体,溶于水,20℃时溶解度为13.6g;在150 ℃时转变成NH4SCN)是用于制造药物、染料、金属矿物的浮选剂等的原料。某化学实验小组同学用Ca(HS)2与CaCN2(石灰氮)合成硫脲并探究其性质。
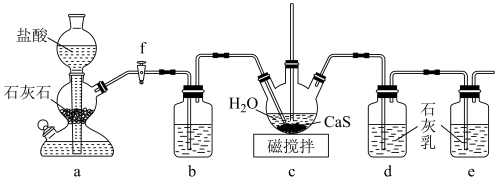
(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
①装置a中反应发生的操作为___________ ;装置b中盛放的试剂是___________ 。
②装置c中的长直导管的作用是___________ 。c装置中CO2不宜过量,原因是___________ 。
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱,合适的加热方式是___________ ;该反应的化学方程式为___________ 。
(3)探究硫脲的性质:取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是___________ 。
(4)测定硫脲含量的方法如下:
步骤1:准确称取a g产品,经溶解等步骤最后在500 mL容量瓶中定容。
步骤2:准确量取20.00 mL配制好的溶液注入碘量瓶中,加入V1 mL c1 mol·L-1 I2的标准溶液及适量的NaOH溶液,于暗处放置10 min。 (2NaOH+I2=NaIO+NaI+H2O,4NaIO+(NH2)2CS+H2O =(NH2)2CO+4NaI+H2SO4)
步骤3:加水及适量的盐酸,摇匀。
步骤4:用c2 mol·L-1标准Na2S2O3溶液滴定剩余的I2 ( I2+2Na2S2O3=2NaI+Na2S4O6) ,加入淀粉溶液,滴定至终点时消耗Na2S2O3溶液V2mL。
“步骤4”滴定至终点时的颜色变化是___________ ,产品中(NH2)2CS的质量分数为___________ (列出计算式)。

(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
①装置a中反应发生的操作为
②装置c中的长直导管的作用是
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱,合适的加热方式是
(3)探究硫脲的性质:取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是
(4)测定硫脲含量的方法如下:
步骤1:准确称取a g产品,经溶解等步骤最后在500 mL容量瓶中定容。
步骤2:准确量取20.00 mL配制好的溶液注入碘量瓶中,加入V1 mL c1 mol·L-1 I2的标准溶液及适量的NaOH溶液,于暗处放置10 min。 (2NaOH+I2=NaIO+NaI+H2O,4NaIO+(NH2)2CS+H2O =(NH2)2CO+4NaI+H2SO4)
步骤3:加水及适量的盐酸,摇匀。
步骤4:用c2 mol·L-1标准Na2S2O3溶液滴定剩余的I2 ( I2+2Na2S2O3=2NaI+Na2S4O6) ,加入淀粉溶液,滴定至终点时消耗Na2S2O3溶液V2mL。
“步骤4”滴定至终点时的颜色变化是
您最近一年使用:0次
名校
10 . Fe(NO3)3是一种重要的媒染剂和金属表面处理剂,易溶于水、乙醇,微溶于硝酸,具有较强的氧化性。某学习小组利用如图装置制备Fe(NO3)3并探究其性质。
回答下列问题:
步骤一:制备Fe(NO3)3
a中加入100mL8mol·L-1硝酸,b中加入5.6g铁屑,将硝酸与铁屑混合后水浴加热。
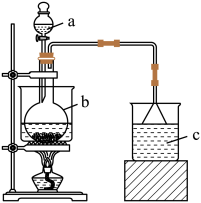
(1)仪器b的名称是___ 。
(2)反应过程中观察到b中铁屑溶解,溶液变黄色,液面上方有红棕色气体产生,仪器b中反应的离子方程式是___ 。
(3)c中所盛试剂是___ ,倒扣漏斗的作用是___ 。
(4)若要从反应后的溶液中得到Fe(NO3)3晶体,应采取的操作是:将溶液蒸发浓缩、冷却结晶、过滤、用____ 洗涤、干燥。
步骤二:探究Fe(NO3)3的性质
i.测得0.1mol·L-1Fe(NO3)3溶液的pH约等于1.6。
ii.将5mL0.1mol·L-1Fe(NO3)3溶液倒入有银镜的试管中,约1min后银镜完全溶解。
(5)使银镜溶解的原因可能有两个:a.NO3−(H+)使银镜溶解;b.__ 使银镜溶解。为证明b成立,设计如下方案:取少量银镜溶解后的溶液于另一支试管中,___ 。
回答下列问题:
步骤一:制备Fe(NO3)3
a中加入100mL8mol·L-1硝酸,b中加入5.6g铁屑,将硝酸与铁屑混合后水浴加热。

(1)仪器b的名称是
(2)反应过程中观察到b中铁屑溶解,溶液变黄色,液面上方有红棕色气体产生,仪器b中反应的离子方程式是
(3)c中所盛试剂是
(4)若要从反应后的溶液中得到Fe(NO3)3晶体,应采取的操作是:将溶液蒸发浓缩、冷却结晶、过滤、用
步骤二:探究Fe(NO3)3的性质
i.测得0.1mol·L-1Fe(NO3)3溶液的pH约等于1.6。
ii.将5mL0.1mol·L-1Fe(NO3)3溶液倒入有银镜的试管中,约1min后银镜完全溶解。
(5)使银镜溶解的原因可能有两个:a.NO3−(H+)使银镜溶解;b.
您最近一年使用:0次
2020-06-01更新
|
193次组卷
|
2卷引用:四川省泸州市泸县第四中学2022届高三三诊模拟考试理科综合化学试题



