名校
1 . 某兴趣小组通过实验制备Fe(NO3)3并进行性质探究。
(1)HNO3的制备:利用下图装置,模拟氨的催化氧化法制备硝酸。其中,甲为氨气的发生装置,且甲中所用试剂只能从下列物质选取:A. 浓氨水 B. NH4Cl C. NH4NO3 D. CaO
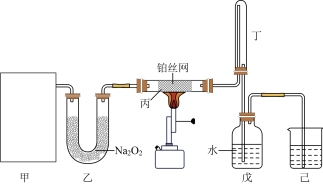
①若选择试剂A和D,则甲中发生反应的化学方程式为_______ 。
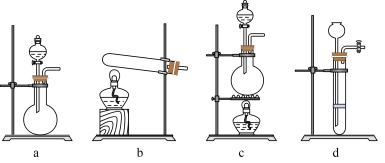
②若只用一种试剂制取氨气,则该试剂的最佳选择为_______ (选填试剂标号),此时,甲中空白处所需装置应为_______ (选填下列标号)。
③实验结束后从戊中取出少量液体于试管中,滴入紫色石蕊试液,当观察到_______ 现象时,说明已制得硝酸。若没有观察到此现象,可能的原因是_______ 。
(2)Fe(NO3)3溶液的制备:利用硝酸与下列物质反应制备Fe(NO3)3溶液时,最佳选择为_______ (填标号)。
A. Fe B. FeO C. Fe2O3 D. Fe3O4 E. Fe(OH)2
(3)Fe(NO3)3溶液性质的探究:取适量0.1mol·L-1 Fe(NO3)3溶液,加入到新制的银镜中,发现银镜溶解,且无其它固体析出。
①实验任务:通过设计实验探究Fe(NO3)3溶液溶解银的原因。
②查阅资料: 在不同条件下的还原产物较复杂,有时难以观察到气体产生。
在不同条件下的还原产物较复杂,有时难以观察到气体产生。
③提出猜想:猜想a:Fe3+具有氧化性,能够氧化Ag;
猜想b:Fe(NO3)3溶液呈酸性,在此酸性条件下 能氧化Ag。
能氧化Ag。
④设计实验、验证猜想
Ⅰ. 甲同学从上述实验的生成物中检测出Fe2+,验证了猜想a成立。请写出Fe3+氧化Ag的离子方程式_______ 。
Ⅱ. 乙同学设计实验验证猜想 ,请帮他完成下表中内容
,请帮他完成下表中内容
(1)HNO3的制备:利用下图装置,模拟氨的催化氧化法制备硝酸。其中,甲为氨气的发生装置,且甲中所用试剂只能从下列物质选取:A. 浓氨水 B. NH4Cl C. NH4NO3 D. CaO

①若选择试剂A和D,则甲中发生反应的化学方程式为
②若只用一种试剂制取氨气,则该试剂的最佳选择为

③实验结束后从戊中取出少量液体于试管中,滴入紫色石蕊试液,当观察到
(2)Fe(NO3)3溶液的制备:利用硝酸与下列物质反应制备Fe(NO3)3溶液时,最佳选择为
A. Fe B. FeO C. Fe2O3 D. Fe3O4 E. Fe(OH)2
(3)Fe(NO3)3溶液性质的探究:取适量0.1mol·L-1 Fe(NO3)3溶液,加入到新制的银镜中,发现银镜溶解,且无其它固体析出。
①实验任务:通过设计实验探究Fe(NO3)3溶液溶解银的原因。
②查阅资料:
 在不同条件下的还原产物较复杂,有时难以观察到气体产生。
在不同条件下的还原产物较复杂,有时难以观察到气体产生。③提出猜想:猜想a:Fe3+具有氧化性,能够氧化Ag;
猜想b:Fe(NO3)3溶液呈酸性,在此酸性条件下
 能氧化Ag。
能氧化Ag。④设计实验、验证猜想
Ⅰ. 甲同学从上述实验的生成物中检测出Fe2+,验证了猜想a成立。请写出Fe3+氧化Ag的离子方程式
Ⅱ. 乙同学设计实验验证猜想
 ,请帮他完成下表中内容
,请帮他完成下表中内容| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② | 若银镜消失,猜想b成立; 若银镜不消失,猜想b不成立。 |
您最近一年使用:0次
2021-11-03更新
|
1162次组卷
|
6卷引用:山东省新泰市第一中学北校2022-2023学年高三上学期期中考试化学试题
山东省新泰市第一中学北校2022-2023学年高三上学期期中考试化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】19广东省揭阳市惠来县第一中学2021-2022学年高一下学期第二次阶段考试化学试题广东省佛山顺德市2021-2022学年高三一模化学试题(已下线)专题28 性质探究类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)广东省佛山顺德区2022届高三上学期第一次教学质量检测化学试题
2 . 为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器和夹持仪器)
| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 精制含Ca2+、Mg2+、 的食盐水 的食盐水 | 胶头滴管、烧杯、试管、漏斗、玻璃棒 | 粗盐水、稀盐酸、氯化钡溶液、氢氧化钠溶液、碳酸钠溶液 |
| B | 制备Fe(OH)3胶体 | 烧杯、酒精灯、胶头滴管 | 1mol/L氢氧化钠溶液、1mol/L氯化铁溶液 |
| C | 确定FeCl3是否完全变质 | 试管、酒精灯、胶头滴管 | 稀硫酸、高锰酸钾溶液 |
| D | 利用反萃取原理从碘的四氯化碳溶液中获取碘单质 | 漏斗、烧杯、玻璃棒、分液漏斗 | 稀硫酸、。氢氧化钠溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 下列操作能达到相应实验目的的是
| 实验目的 | 操作 | |
| A | 检验 溶液是否变质 溶液是否变质 | 取少量加入到酸性 溶液中 溶液中 |
| B | 测定家用84消毒液的 | 用洁净的玻璃棒蘸取少许消毒液滴在 试纸上 试纸上 |
| C | 除去 中的少量 中的少量 | 将混合气体通过盛有饱和 溶液的洗气瓶 溶液的洗气瓶 |
| D | 实验室制备 胶体 胶体 | 向沸水中逐滴加入饱和 溶液,边加边搅拌 溶液,边加边搅拌 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-25更新
|
277次组卷
|
2卷引用:山东省威海市2021-2022学年高一上学期期末考试化学试题
解题方法
4 . 硫酸亚铁晶体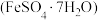 在医药上可作补血剂。
在医药上可作补血剂。
I.在实验室中,可通过如下实验由废铁屑(含氧化铁)制备 。
。
a.将一定量废铁屑放入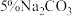 溶液中,煮沸除油污,过滤,用水洗净铁屑;
溶液中,煮沸除油污,过滤,用水洗净铁屑;
b.向洗净的铁屑中加入少量的稀硫酸,使反应完全,得 溶液;
溶液;
c.析出晶体;
d.滤出晶体,用少量冰水洗涤2~3次,再用滤纸吸干;
e.将制得的晶体密封保存。
请回答下列问题:
(1)步骤b中发生氧化还原反应的离子方程式为_______ 和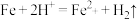 。
。
(2)步骤c的具体操作为_______ 。
Ⅱ.课外小组测定某硫酸亚铁补血片中铁元素的含量。实验步骤如下:

请回答下列问题:
(3)若向步骤Ⅲ所得滤液中滴加 溶液后出现
溶液后出现_______ 现象,说明滤液中含有 ;检验滤液中还存在
;检验滤液中还存在 ,应选用的试剂为
,应选用的试剂为_______ (填字母)。
a.氯水 b.酸性 溶液 c.
溶液 c. 溶液
溶液
(4)步骤Ⅳ加入足量 的目的为
的目的为_______ ﹔
(5)该补血片与维生素C同时服用,有利于 的吸收,这说明维生素C具有
的吸收,这说明维生素C具有_______ (填“氧化性”或“还原性”)。
(6)假设实验过程中铁元素无损耗,则每片补血片中铁元素的质量为_______ g(用含a的代数式表示)。
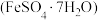 在医药上可作补血剂。
在医药上可作补血剂。I.在实验室中,可通过如下实验由废铁屑(含氧化铁)制备
 。
。a.将一定量废铁屑放入
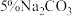 溶液中,煮沸除油污,过滤,用水洗净铁屑;
溶液中,煮沸除油污,过滤,用水洗净铁屑;b.向洗净的铁屑中加入少量的稀硫酸,使反应完全,得
 溶液;
溶液;c.析出晶体;
d.滤出晶体,用少量冰水洗涤2~3次,再用滤纸吸干;
e.将制得的晶体密封保存。
请回答下列问题:
(1)步骤b中发生氧化还原反应的离子方程式为
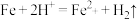 。
。(2)步骤c的具体操作为
Ⅱ.课外小组测定某硫酸亚铁补血片中铁元素的含量。实验步骤如下:

请回答下列问题:
(3)若向步骤Ⅲ所得滤液中滴加
 溶液后出现
溶液后出现 ;检验滤液中还存在
;检验滤液中还存在 ,应选用的试剂为
,应选用的试剂为a.氯水 b.酸性
 溶液 c.
溶液 c. 溶液
溶液(4)步骤Ⅳ加入足量
 的目的为
的目的为(5)该补血片与维生素C同时服用,有利于
 的吸收,这说明维生素C具有
的吸收,这说明维生素C具有(6)假设实验过程中铁元素无损耗,则每片补血片中铁元素的质量为
您最近一年使用:0次
解题方法
5 . “分类”是一种思想方法,利用分类对物质性质进行探究是科学探究的重要方法,某学习兴趣小组为探究物质的性质向实验室提供了如下实验试剂清单:
利用上述试剂,小组同学完成以下实验,回答下列问题:
(1)生活中常作为食品抗氧化剂的是___________ (填序号);常温下,实验室用②和④制备 ,选择②而不选择①的原因
,选择②而不选择①的原因___________ 。
(2)纳米级碳酸钙在造纸业中有重要用途,查阅资料后,小组同学采用将 和
和 混合通入⑤中的方法制备,证明所得分散系中的碳酸钙为纳米级碳酸钙的操作方法是
混合通入⑤中的方法制备,证明所得分散系中的碳酸钙为纳米级碳酸钙的操作方法是___________ 。
(3)实验中需用⑦配制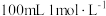 烧碱溶液,下列操作不正确的是___________。
烧碱溶液,下列操作不正确的是___________。
(4)取适量⑨于试管中,滴入少量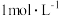 烧碱溶液,反应的现象为
烧碱溶液,反应的现象为___________ ;试剂⑨保存不当易变质,证明⑨是否完全变质可选择的试剂为___________ (填试剂序号)
| 组别 | 一 | 二 | 三 | 四 |
| 试剂及编号 | ①铁粉 | ④浓硝酸 | ⑤澄清石灰水 | ⑧酸性 溶液 溶液 |
| ②铜粉 | ⑥氨水 | ⑨ 溶液 溶液 | ||
| ③氯水 | ⑦ 固体 固体 | ⑩ 溶液 溶液 |
(1)生活中常作为食品抗氧化剂的是
 ,选择②而不选择①的原因
,选择②而不选择①的原因(2)纳米级碳酸钙在造纸业中有重要用途,查阅资料后,小组同学采用将
 和
和 混合通入⑤中的方法制备,证明所得分散系中的碳酸钙为纳米级碳酸钙的操作方法是
混合通入⑤中的方法制备,证明所得分散系中的碳酸钙为纳米级碳酸钙的操作方法是(3)实验中需用⑦配制
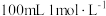 烧碱溶液,下列操作不正确的是___________。
烧碱溶液,下列操作不正确的是___________。A.用托盘天平在滤纸上称量 固体 固体 |
| B.将固体溶解后,溶液冷却至室温转移到容量瓶中 |
| C.转移溶液时,玻璃棒下端紧贴容量瓶刻线下内壁 |
| D.定容时用玻璃棒引流加入蒸馏水至凹液面最低端与刻线相平齐 |
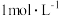 烧碱溶液,反应的现象为
烧碱溶液,反应的现象为
您最近一年使用:0次
名校
6 .  在工农业生产中有广泛的应用,某实验小组用如下装置模拟干法制备
在工农业生产中有广泛的应用,某实验小组用如下装置模拟干法制备 。
。
已知: 加热易升华,易与空气中水蒸气发生反应。
加热易升华,易与空气中水蒸气发生反应。
①检验装置的气密性;
②通入干燥的 ,赶尽装置中的空气;
,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入 ,通入一段时间干燥的
,通入一段时间干燥的 ,将收集器密封。
,将收集器密封。

回答下列问题:
(1)装置A中反应的化学方程式为_______ ,装置C中盛装无水 的仪器名称为
的仪器名称为_______ 。
(2)第③步加热后,少量 沉积在反应管A右端。要使沉积的
沉积在反应管A右端。要使沉积的 进入收集器,第④步操作是:
进入收集器,第④步操作是:_______ 。
(3)操作步骤中,通入氮气的目的是_______ 。
(4)装置C的作用为_______ 。
(5)装置D中 溶液用于吸收未反应的
溶液用于吸收未反应的 。写出该反应的离子方程式
。写出该反应的离子方程式_______ 。
(6)该组同学用装置D中的副产品 溶液吸收
溶液吸收 ,得到黄色固体S。写出该反应的离子方程式:
,得到黄色固体S。写出该反应的离子方程式:_______ 。
(7)称取收集器中粗产品 配制成
配制成 溶液,进行
溶液,进行 纯度的测定(粗产品中的杂质不参与反应,已知:
纯度的测定(粗产品中的杂质不参与反应,已知: )。取
)。取 溶液置于锥形瓶中,加入过量的
溶液置于锥形瓶中,加入过量的 溶液充分反应生成
溶液充分反应生成 ,生成的
,生成的 恰好与
恰好与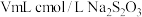 溶液反应。则
溶液反应。则 的纯度为
的纯度为_______ 。
 在工农业生产中有广泛的应用,某实验小组用如下装置模拟干法制备
在工农业生产中有广泛的应用,某实验小组用如下装置模拟干法制备 。
。已知:
 加热易升华,易与空气中水蒸气发生反应。
加热易升华,易与空气中水蒸气发生反应。①检验装置的气密性;
②通入干燥的
 ,赶尽装置中的空气;
,赶尽装置中的空气;③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入
 ,通入一段时间干燥的
,通入一段时间干燥的 ,将收集器密封。
,将收集器密封。
回答下列问题:
(1)装置A中反应的化学方程式为
 的仪器名称为
的仪器名称为(2)第③步加热后,少量
 沉积在反应管A右端。要使沉积的
沉积在反应管A右端。要使沉积的 进入收集器,第④步操作是:
进入收集器,第④步操作是:(3)操作步骤中,通入氮气的目的是
(4)装置C的作用为
(5)装置D中
 溶液用于吸收未反应的
溶液用于吸收未反应的 。写出该反应的离子方程式
。写出该反应的离子方程式(6)该组同学用装置D中的副产品
 溶液吸收
溶液吸收 ,得到黄色固体S。写出该反应的离子方程式:
,得到黄色固体S。写出该反应的离子方程式:(7)称取收集器中粗产品
 配制成
配制成 溶液,进行
溶液,进行 纯度的测定(粗产品中的杂质不参与反应,已知:
纯度的测定(粗产品中的杂质不参与反应,已知: )。取
)。取 溶液置于锥形瓶中,加入过量的
溶液置于锥形瓶中,加入过量的 溶液充分反应生成
溶液充分反应生成 ,生成的
,生成的 恰好与
恰好与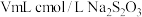 溶液反应。则
溶液反应。则 的纯度为
的纯度为
您最近一年使用:0次
2022-12-11更新
|
152次组卷
|
2卷引用:山东省淄博实验中学2022-2023学年高一上学期六科限时检测化学试题
7 . 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示,回答下列问题:
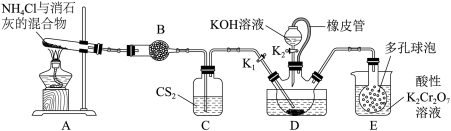
已知:①CS2不溶于水,密度比水大;②三颈烧瓶内盛放有CS2、水和催化剂。
(1)制备NH4SCN溶液:
①实验前,经检验装置的气密性良好。装置A中发生反应的化学方程式为____ ;装置B中的试剂是____ 。三颈烧瓶的下层CS2液体必须浸没导气管口,目的是____ 。
②实验开始时,打开K1,加热装置A、D,使A中产生的气体级级通入D中,发生反应:
CS2+3NH3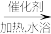 NH4SCN+NH4HS,该反应缓慢进行至CS2消失。
NH4SCN+NH4HS,该反应缓慢进行至CS2消失。
(2)制备KSCN溶液:
①熄灭A处的酒精灯,关闭K1和K2,移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后(NH4HS H2S↑+NH3↑),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为
H2S↑+NH3↑),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为____ 。
②装置E中,NH3被酸性重铬酸钾氧化为氨气,反应的离子方程式为____ 。
(3)测定晶体史KSCN的含量:称取10.0g样品,配成1000mL溶液。量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液作指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色),判断达到滴定终点的现象是____ 。
②晶体中KSCN的质量分数为____ 。

已知:①CS2不溶于水,密度比水大;②三颈烧瓶内盛放有CS2、水和催化剂。
(1)制备NH4SCN溶液:
①实验前,经检验装置的气密性良好。装置A中发生反应的化学方程式为
②实验开始时,打开K1,加热装置A、D,使A中产生的气体级级通入D中,发生反应:
CS2+3NH3
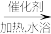 NH4SCN+NH4HS,该反应缓慢进行至CS2消失。
NH4SCN+NH4HS,该反应缓慢进行至CS2消失。(2)制备KSCN溶液:
①熄灭A处的酒精灯,关闭K1和K2,移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后(NH4HS
 H2S↑+NH3↑),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为
H2S↑+NH3↑),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为②装置E中,NH3被酸性重铬酸钾氧化为氨气,反应的离子方程式为
(3)测定晶体史KSCN的含量:称取10.0g样品,配成1000mL溶液。量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液作指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色),判断达到滴定终点的现象是
②晶体中KSCN的质量分数为
您最近一年使用:0次



