1 . 已知无水 在空气中遇水易潮解变质,加热易升华。实验室拟通过氯气与铁的反应来制备
在空气中遇水易潮解变质,加热易升华。实验室拟通过氯气与铁的反应来制备 。
。
(1)利用表中实验装置,不能达到相应实验目的的是图___________ 。
(2)图甲中盛装浓盐酸的仪器的名称是___________ ;将仪器连接好以后,必须进行的第一步操作是___________ 。
(3)图丙的试管中可观察到的实验现象为___________ 。
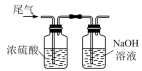
(4)图丁中浓硫酸的作用是___________ ,装有NaOH溶液(过量)的试剂瓶中发生反应的离子方程式为___________ 。
(5)电子工业常用30%的 溶液蚀刻绝缘板上的铜箔,制造印刷电路板。写出
溶液蚀刻绝缘板上的铜箔,制造印刷电路板。写出 溶液与金属铜发生反应的离子方程式:
溶液与金属铜发生反应的离子方程式:___________ 。
(6)高铁酸钠是一种新型绿色消毒剂,主要用于处理饮用水。可以通过反应: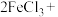
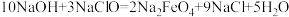 制取。该反应中氧化剂是
制取。该反应中氧化剂是___________ (填化学式,下同),氧化产物为___________ 。
 在空气中遇水易潮解变质,加热易升华。实验室拟通过氯气与铁的反应来制备
在空气中遇水易潮解变质,加热易升华。实验室拟通过氯气与铁的反应来制备 。
。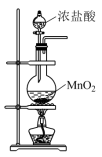 |  | 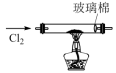 |  |
图甲:制备 | 图乙:净化 | 图丙: 与铁反应 与铁反应 | 图丁:尾气处理 |
(2)图甲中盛装浓盐酸的仪器的名称是
(3)图丙的试管中可观察到的实验现象为
(4)图丁中浓硫酸的作用是
(5)电子工业常用30%的
 溶液蚀刻绝缘板上的铜箔,制造印刷电路板。写出
溶液蚀刻绝缘板上的铜箔,制造印刷电路板。写出 溶液与金属铜发生反应的离子方程式:
溶液与金属铜发生反应的离子方程式:(6)高铁酸钠是一种新型绿色消毒剂,主要用于处理饮用水。可以通过反应:
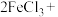
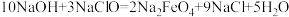 制取。该反应中氧化剂是
制取。该反应中氧化剂是
您最近一年使用:0次
名校
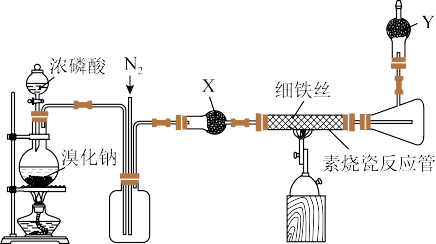
2 . 溴化亚铁(FeBr2,易潮解、800 ℃升华)是一种无机化工品,常用作聚合反应催化剂,也用于制药工业。某同学在实验室制备FeBr2(Fe与HBr反应)并探究Fe2+和Br-还原性强弱,装置(部分夹持仪器已省略)如图所示:
已知:2FeBr3 2FeBr2 +Br2
2FeBr2 +Br2
回答下列问题:
(1)用来盛装浓磷酸的仪器名称为。_______ 。
(2)写出圆底烧瓶中体现的制酸原理:_______ 。
(3)上述装置中,X、Y中分别盛装的试剂依次是_______ (填字母)。
(4)实验结束后,关闭热源,仍需要通入一段时间N2,其目的是_______ 。
(5)若用浓硫酸代替浓磷酸,圆底烧瓶中的反应方程式为_______ ,该方案同样可以制备FeBr2,请简述原因:_______ 。
(6)Fe2+和Br-还原性强弱探究,实验装置如图所示。向m中的FeBr2溶掖(约10 mL)中通入少量Cl2,充分反应后,打开活塞k,使约2 mL的溶液流入试管中,然后向试管中滴加_______ (填试剂化学式)溶液,观察到_______ (填现象),证明还原性:Fe2+>Br-。
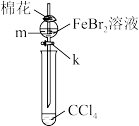

已知:2FeBr3
 2FeBr2 +Br2
2FeBr2 +Br2回答下列问题:
(1)用来盛装浓磷酸的仪器名称为。
(2)写出圆底烧瓶中体现的制酸原理:
(3)上述装置中,X、Y中分别盛装的试剂依次是_______ (填字母)。
| A.氯化钙、碱石灰 |
| B.碱石灰、氯化钙 |
| C.氯化钙、硫酸铜 |
| D.氢氧化钠、硫酸铜 |
(5)若用浓硫酸代替浓磷酸,圆底烧瓶中的反应方程式为
(6)Fe2+和Br-还原性强弱探究,实验装置如图所示。向m中的FeBr2溶掖(约10 mL)中通入少量Cl2,充分反应后,打开活塞k,使约2 mL的溶液流入试管中,然后向试管中滴加
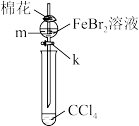
您最近一年使用:0次
名校
3 . 碱式氯化铜是重要的无机杀菌剂,是一种绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
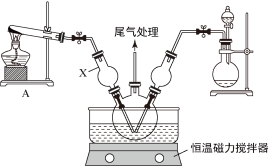
(1)仪器X的名称是______ ,其主要作用有导气、______ 。
(2)实验室利用装置A制NH3,发生反应的化学方程式为_______ 。
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象有_____ 。
(4)若体系中NH3过量会导致碱式氯化铜的产量___ (填“偏高”、“偏低”或“无影响”),原因为___ 。
Ⅱ.无水碱式氯化铜组成的测定。称取产品4.29 g,加硝酸溶解,并加水定容至200 mL,得到待测液。
(5)铜的测定:取20.00 mL待测液,经测定Cu2+浓度为0.2 mol·L-1。则称取的样品中 n(Cu2+)=_____ mol。
(6)采用沉淀滴定法测定氯:用NH4SCN标准溶液滴定过量的AgNO3(已知:AgSCN是一种难溶于水的白色固体),实验如下图:

①滴定时,应选用下列哪种物质作为指示剂_____ (填标号)。
a.FeSO4 b.Fe(NO3)3 c.FeCl3
②重复实验操作三次,消耗NH4SCN溶液的体积平均为10.00 mL。则称取的样品中n(Cl-)=_____ mol。
(7)根据上述实验结果可推知无水碱式氯化铜的化学式为_____ 。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。

(1)仪器X的名称是
(2)实验室利用装置A制NH3,发生反应的化学方程式为
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象有
(4)若体系中NH3过量会导致碱式氯化铜的产量
Ⅱ.无水碱式氯化铜组成的测定。称取产品4.29 g,加硝酸溶解,并加水定容至200 mL,得到待测液。
(5)铜的测定:取20.00 mL待测液,经测定Cu2+浓度为0.2 mol·L-1。则称取的样品中 n(Cu2+)=
(6)采用沉淀滴定法测定氯:用NH4SCN标准溶液滴定过量的AgNO3(已知:AgSCN是一种难溶于水的白色固体),实验如下图:

①滴定时,应选用下列哪种物质作为指示剂
a.FeSO4 b.Fe(NO3)3 c.FeCl3
②重复实验操作三次,消耗NH4SCN溶液的体积平均为10.00 mL。则称取的样品中n(Cl-)=
(7)根据上述实验结果可推知无水碱式氯化铜的化学式为
您最近一年使用:0次
2020-07-10更新
|
218次组卷
|
2卷引用:湖南省娄底市第五中学2021-2022学年高三下学期期中考试化学试题
4 . 以下实验设计不能达到实验目的的是
| 实验目的 | 实验设计 | |
| A | 除去碳酸钠固体中的碳酸氢钠 | 将固体加热至恒重 |
| B | 制备无水氯化铝 | 蒸发氯化铝溶液 |
| C | 证明溶液中FeCl2是否变质 | 取少量待测液,滴加KSCN溶液 |
| D | 鉴别溴化钠和碘化钾溶液 | 分别加新制氯水后,加入淀粉溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 下列实验操作能达到实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | Cl2通入紫色石蕊试液中 | 检验氯水显酸性及Cl2有漂白性 |
| B | 向Cu与浓H2SO4反应后的试管中加水 | 通过观察溶液颜色确定CuSO4的生成 |
| C | 向某溶液中滴加几滴K3Fe(CN)6溶液 | 检验FeCl3溶液中存在Fe2+杂质 |
| D | 将乙醇与浓H2SO4混合液快速加热至140℃ | 制备乙烯气体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-27更新
|
224次组卷
|
4卷引用:湖南省三湘名校教育联盟2021-2022学年高三下学期3月大联考化学试题
湖南省三湘名校教育联盟2021-2022学年高三下学期3月大联考化学试题辽宁省2021-2022学年高三3月联合考试化学试题(已下线)必刷卷04-2022年高考化学考前信息必刷卷(河北专用)(已下线)选择题11-15
6 . 下列实验设计不能达到实验目的的是
| 实验目的 | 实验设计 | |
| A | 检验溶液中 是否被氧化 是否被氧化 | 取少量待测液,滴加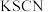 溶液,观察溶液颜色变化 溶液,观察溶液颜色变化 |
| B | 净化实验室制备的 | 气体依次通过盛有饱和 溶液、浓 溶液、浓 的洗气瓶 的洗气瓶 |
| C | 测定 溶液的pH 溶液的pH | 将待测液滴在湿润的pH试纸上,与标准比色卡对照 |
| D | 工业酒精制备无水乙醇 | 工业酒精中加生石灰,蒸馏 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-09更新
|
10211次组卷
|
37卷引用:湖南省邵阳市第一中学2022届高三下学期第三次模拟考试化学试题
湖南省邵阳市第一中学2022届高三下学期第三次模拟考试化学试题2021年新高考湖南化学高考真题2021年湖南省高考化学试卷变式题1-10(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题05 化学基础实验—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)专题16 基础化学实验-2022年高考化学二轮复习重点专题常考点突破练(已下线)秘籍05 微型实验方案设计与评价-备战2022年高考化学抢分秘籍(全国通用)(已下线)卷05 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷05题 化学实验基础-备战2022年高考化学临考题号押题(新高考通版)(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)专题11 基本实验专练(已下线)微专题13 亚铁离子、三价铁离子的性质及检验-备战2023年高考化学一轮复习考点微专题(已下线)第26讲 物质的分离、提纯、检验与鉴别(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第27讲 物质的制备与性质实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)山西省芮城县陌南中学2021-2022学年高一下学期5月月考化学试题四川省成都绵实外国语学校2021-2022学年高二下学期6月月考(理科)化学试题广东省普宁市华侨中学2022-2023学年高二上学期11月期中考试化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)陕西省榆林市清源中学2020-2021学年高二下学期第二次月考化学试题四川省成都七中(高新校区)2020-2021学年高二下学期期末零诊模拟化学试题(已下线)第28讲 物质的分离、提纯和检验(精练)-2022年高考化学一轮复习讲练测(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点35 化学实验方案的设计与评价-备战2022年高考化学一轮复习考点帮(浙江专用)山东省济宁市实验中学2022届高三上学期开学考试化学试题(已下线)课时53 简单实验方案的设计与评价-2022年高考化学一轮复习小题多维练(全国通用)福建省福清西山学校2021-2022学年高三上学期10月月考化学试题(已下线)考向34 物质的检验、分离和提纯-备战2022年高考化学一轮复习考点微专题广东省河源正德中学2021-2022学年高二上学期第一次段考化学试题广西桂林市第十九中学2021-2022年高二上学期期中质量检测化学试题天津市扶轮中学2022-2023学年高三上学期期末考试化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)热点题型特训 实验方案中逻辑关系的匹配判断四川省内江市第二中学2023-2024学年高三上学期12月月考理综试题山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期9月第一次月考化学试题天津市南开中学2024届高三下学期第五次月检测化学试卷
名校
解题方法
7 . 绿矾常用于制造补血制剂、净水剂等。以废铁屑(主要含Fe、含少量Fe2O3、油脂等杂质)为原料制备绿矾晶体(FeSO4·7H2O)的流程如图,并设计实验探究绿矾的性质。回答下列问题:
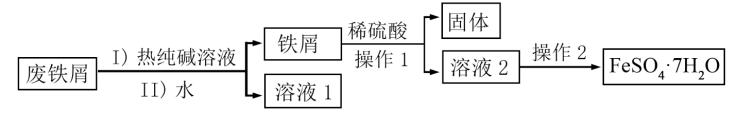
(1)用热纯碱溶液洗涤废铁屑的目的是____ 。“操作1”需要的玻璃仪器有____ 。
(2)检验“溶液2”中是否含Fe3+的试剂是____ (填标号)。
(3)选用75%酒精而不选用蒸馏水洗涤绿矾的优点是____ 。
(4)实验室配制绿矾溶液时常加入少量铁粉,其作用是____ (用离子方程式表示)。
(5)大多数文献认为“FeSO4分解生成Fe2O3、SO2、SO3”。某实验小组提出质疑,认为可能还有O2生成。他们设计实验分离SO3、SO2并检验O2,实验装置如图所示(加热仪器省略)。
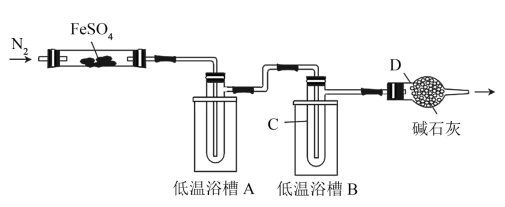
已知部分信息如表:
Ⅰ.几种物质的熔、沸点如表所示:
Ⅱ.几种盐浴温度如表所示:
①低温浴槽A宜选择盐浴____ (填字母),仪器C收集的物质是____ (填化学式)。
②若____ (填实验操作和现象),则证明FeSO4分解有O2生成。

(1)用热纯碱溶液洗涤废铁屑的目的是
(2)检验“溶液2”中是否含Fe3+的试剂是
| A.K3[Fe(CN)6]溶液 | B.KSCN溶液 |
| C.酸性KMnO4溶液 | D.氯水和KSCN溶液 |
(4)实验室配制绿矾溶液时常加入少量铁粉,其作用是
(5)大多数文献认为“FeSO4分解生成Fe2O3、SO2、SO3”。某实验小组提出质疑,认为可能还有O2生成。他们设计实验分离SO3、SO2并检验O2,实验装置如图所示(加热仪器省略)。

已知部分信息如表:
Ⅰ.几种物质的熔、沸点如表所示:
| 物质 | SO3 | SO2 | O2 |
| 熔点(℃) | 16.8 | -72.7 | -218.4 |
| 沸点(℃) | 44.8 | -10 | -182.9 |
Ⅱ.几种盐浴温度如表所示:
| 盐浴 | 浴温 | 盐类及用量 | 碎冰用量 |
| a | -30.0~4.0℃ | NH4Cl(20g)+NaCl(40g) | 100g |
| b | -9.0℃ | CaCl2·6H2O(20g) | 100g |
| c | -17.7℃ | NaNO3(50g) | 100g |
①低温浴槽A宜选择盐浴
②若
您最近一年使用:0次
解题方法
8 . 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,与Cl2的氧化性相近,可用于自来水消毒。为检测二氧化氯能否与KI溶液反应,某兴趣小组设计了下述实验(实验装置如图所示,且气密性良好,D中稳定剂不能与Cl2反应)。回答下列问题:

(1)打开B的活塞,A中发生反应,且产物有ClO2、Cl2等,该反应的化学方程式为_______ 。
(2)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时观察到F中溶液的颜色不变,则装置C的作用是_______ 。
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并放出ClO2,反应的离子方程式为_______ 。打开E的活塞,D中发生反应,观察到装置F中的溶液变成蓝色,则F的反应中氢化剂与还原剂的物质的量之比为_______ 。
(4)自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取300.0mL的水样,酸化,加入足量的碘化钾反应,再用0.2000 Na2S2O3溶液和生成的碘单质反应(反应的化学方程式为:
Na2S2O3溶液和生成的碘单质反应(反应的化学方程式为: ),恰好完全反应时用去25.00mL Na2S2O3溶液,测得该水样中的ClO2含量为
),恰好完全反应时用去25.00mL Na2S2O3溶液,测得该水样中的ClO2含量为_______  。
。
(5)该小组同学还制得了ClO2的水溶液,以探究FeI2的还原性。他们进行了如下实验:取一定量的FeI2溶液,向其中滴加少量ClO2的水溶液,振荡后溶液呈黄色,某同学对产生黄色的原因提出了如下假设:
假设1:Fe2+被ClO2氧化;
假设2: 被ClO2氧化。
被ClO2氧化。
为验证假设1,请你完成下表。

(1)打开B的活塞,A中发生反应,且产物有ClO2、Cl2等,该反应的化学方程式为
(2)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时观察到F中溶液的颜色不变,则装置C的作用是
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并放出ClO2,反应的离子方程式为
(4)自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取300.0mL的水样,酸化,加入足量的碘化钾反应,再用0.2000
 Na2S2O3溶液和生成的碘单质反应(反应的化学方程式为:
Na2S2O3溶液和生成的碘单质反应(反应的化学方程式为: ),恰好完全反应时用去25.00mL Na2S2O3溶液,测得该水样中的ClO2含量为
),恰好完全反应时用去25.00mL Na2S2O3溶液,测得该水样中的ClO2含量为 。
。(5)该小组同学还制得了ClO2的水溶液,以探究FeI2的还原性。他们进行了如下实验:取一定量的FeI2溶液,向其中滴加少量ClO2的水溶液,振荡后溶液呈黄色,某同学对产生黄色的原因提出了如下假设:
假设1:Fe2+被ClO2氧化;
假设2:
 被ClO2氧化。
被ClO2氧化。为验证假设1,请你完成下表。
| 实验步骤 | 预期现象 | 结论 |
| 取少量黄色溶液于试管中,滴加几滴 | 假设1正确 |
您最近一年使用:0次
名校
9 . 某工业废水中含有大量的Cu2+、Fe3+、Fe2+和 ,拟从该废水中回收金属铜并制得绿矾(FeSO4·7H2O),工艺流程如下图:
,拟从该废水中回收金属铜并制得绿矾(FeSO4·7H2O),工艺流程如下图:
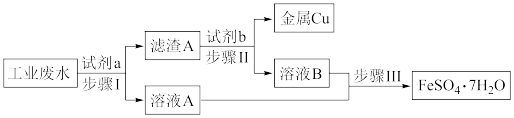
(1)下列叙述正确的是___________。
(2)步骤Ⅰ发生反应的离子方程式为Fe+Cu2+=Fe2++Cu和___________ 。
(3)取2mL溶液A于试管中,滴加少量NaOH溶液,观察到的实验现象是___________ 。
(4)获得的绿矾晶体(FeSO4·7H2O)可能有部分被氧化,请设计检验方案验证(操作、现象、结论)___________ 。
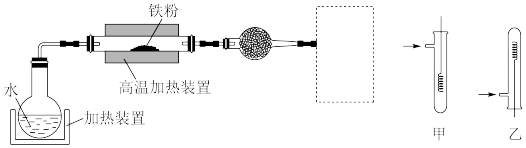
(5)已知:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)。虚线框处宜选择的装置是
Fe3O4(s)+4H2(g)。虚线框处宜选择的装置是___________ (填“甲”或“乙”)。
 ,拟从该废水中回收金属铜并制得绿矾(FeSO4·7H2O),工艺流程如下图:
,拟从该废水中回收金属铜并制得绿矾(FeSO4·7H2O),工艺流程如下图:
(1)下列叙述正确的是___________。
| A.滤渣A为Fe和Cu的混合物 |
| B.试剂b为盐酸 |
| C.步骤Ⅱ可以分离出Cu,并能得到FeSO4溶液 |
| D.步骤Ⅲ为蒸发溶液 |
(3)取2mL溶液A于试管中,滴加少量NaOH溶液,观察到的实验现象是
(4)获得的绿矾晶体(FeSO4·7H2O)可能有部分被氧化,请设计检验方案验证(操作、现象、结论)
(5)已知:3Fe(s)+4H2O(g)
 Fe3O4(s)+4H2(g)。虚线框处宜选择的装置是
Fe3O4(s)+4H2(g)。虚线框处宜选择的装置是
您最近一年使用:0次
2022-02-20更新
|
150次组卷
|
2卷引用:湖南省娄底市第四中学2021-2022学年高一下学期第一次月考化学试题
名校
解题方法
10 . 硫脲[ ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙( )与
)与 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
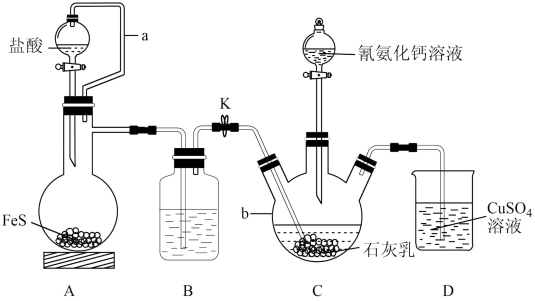
回答下列问题:
(1) 的电子式为
的电子式为_______ 。仪器b的名称是_______ 。
(2)装置A中a的作用是_______ ,A中发生反应的化学方程式为_______ 。
(3)装置B中盛放的试剂是_______ ,其作用是_______ 。
(4)装置C中生成硫脲的总反应为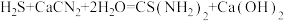 ,若反应分两步进行,写出第二步生成硫脲的化学方程式:
,若反应分两步进行,写出第二步生成硫脲的化学方程式:_______ 。
(5)装置D中可能出现的现象是_______ 。
(6)硫氰化铵( )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是_______ (写出操作步骤和实验现象)。
 ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙( )与
)与 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
回答下列问题:
(1)
 的电子式为
的电子式为(2)装置A中a的作用是
(3)装置B中盛放的试剂是
(4)装置C中生成硫脲的总反应为
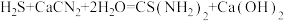 ,若反应分两步进行,写出第二步生成硫脲的化学方程式:
,若反应分两步进行,写出第二步生成硫脲的化学方程式:(5)装置D中可能出现的现象是
(6)硫氰化铵(
 )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
您最近一年使用:0次
2022-04-16更新
|
442次组卷
|
3卷引用:湖南省隆回县第一中学2022届高三下学期第二次模拟考试化学试题



