名校
解题方法
1 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(2)在实验室中,FeCl3可以用铁粉与_______ 反应制备,保存FeCl2溶液会加入少量铁屑,其原理是_______ (用化学方程式表示)。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①甲同学取少量待测溶液﹐滴入_______ (写出试剂名称),溶液呈红色,证明溶液中含有Fe3+。
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是_______ 。(用离子方程式和必要的文字进行解释)已知:氧化性KMnO4>Cl2
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为_______ 。
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
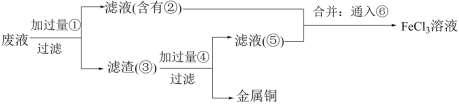
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:_______ 。用H2O2代替⑥也能实现实验目的。请写出加入H2O2的离子方程式:_______ 。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)在实验室中,FeCl3可以用铁粉与
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
①甲同学取少量待测溶液﹐滴入
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
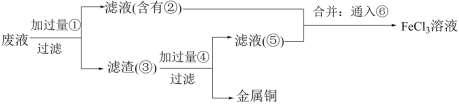
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:
您最近一年使用:0次
2022-04-05更新
|
408次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市第一中学2021--2022学年高一上学期期末考试化学试题
名校
解题方法
2 . 下列关于 、
、 性质实验的说法错误的是
性质实验的说法错误的是
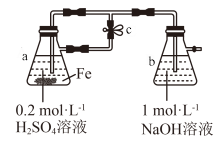
 、
、 性质实验的说法错误的是
性质实验的说法错误的是
A.用上图装置可以制备 沉淀 沉淀 |
B. 溶液中滴加KI溶液,会有碘单质生成 溶液中滴加KI溶液,会有碘单质生成 |
| C.配制溶液所用的蒸馏水通常要煮沸 |
D.向 溶液中加入少量铁粉是为了防止 溶液中加入少量铁粉是为了防止 被氧化 被氧化 |
您最近一年使用:0次
2014·陕西·二模
名校
解题方法
3 . 为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_______________________________________________ 。
(2)棉花中浸润的溶液化学式为_________________________ 。
(3)A中发生反应的化学方程式为____________________________________ 。
(4)过程Ⅳ中检验其中Fe3+ 和Fe2+的试剂分别为___________ 和__________ 。
确定有Fe3+ 和Fe2+现象分别是_______________ 和____________________ 。
(5)过程Ⅵ,检验B溶液中是否含有SO42—的操作是_____________________ 。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:
Cl2 > Fe3+ > SO2的是________ (填“甲”“乙”“丙”)。
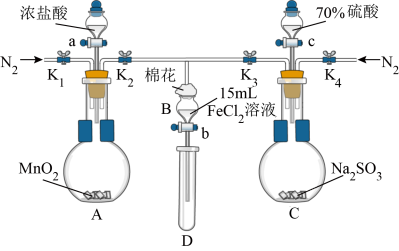
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是
(2)棉花中浸润的溶液化学式为
(3)A中发生反应的化学方程式为
(4)过程Ⅳ中检验其中Fe3+ 和Fe2+的试剂分别为
确定有Fe3+ 和Fe2+现象分别是
(5)过程Ⅵ,检验B溶液中是否含有SO42—的操作是
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:
| 过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO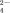 |
| 乙 | 既有Fe3+又有Fe2+ | 有SO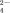 |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
您最近一年使用:0次
2016-12-09更新
|
431次组卷
|
5卷引用:新疆和田地区第二中学2022-2023学年高二上学期11月期中考试化学试题
新疆和田地区第二中学2022-2023学年高二上学期11月期中考试化学试题(已下线)2014陕西省西工大附中高三上学期第二次适应性训练化学试卷安徽省淮北地区2019届高三上学期入学摸底考试化学试题陕西省宝鸡中学2019届高三入学调研考化学试题(已下线)考点13 物质结构 元素周期律 化学键——《备战2020年高考精选考点专项突破题集》
名校
4 . 下列中学常见实验的现象或表述正确的是
| A.赤铁矿的主要成分是Fe3O4 |
| B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 |
| C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可 |
| D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加入足量的铁粉,然后过滤 |
您最近一年使用:0次
2016-12-09更新
|
124次组卷
|
2卷引用:新疆乌鲁木齐市第四中学2021-2022学年高一上学期期末考试化学试题
名校
5 . 铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如下:
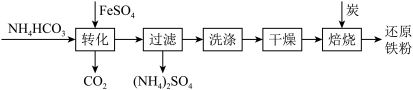
实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节获得FeCO3。
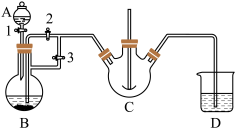
(1)NH4HCO3盛放在装置___________ 中(填仪器名称)。
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合,操作方法是___________ 。发生主要反应的离子方程式为___________ 。检验久置的FeSO4是否变质的方法是___________ 。
(3)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为___________ ,取干燥后的FeCO3样品12.49g,与炭混合后焙烧,最终得到还原铁粉6.16g,计算样品中杂质FeOOH的质量:___________ g。

实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节获得FeCO3。

(1)NH4HCO3盛放在装置
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合,操作方法是
(3)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为
您最近一年使用:0次
2021-10-19更新
|
109次组卷
|
2卷引用:新疆克孜勒苏柯尔克孜自治州阿克陶县2022-2023学年高二上学期11月期中考试化学试题



