1 .  化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究
化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究 与
与 的反应机理,实验步骤如下:
的反应机理,实验步骤如下:
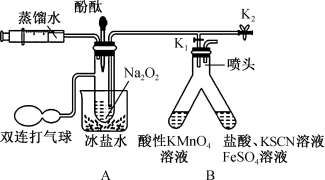
Ⅰ.打开 、
、 ,通过注射器注入适量蒸馏水,使固体全部溶解(未见气泡产生);
,通过注射器注入适量蒸馏水,使固体全部溶解(未见气泡产生);
Ⅱ.将部分液体转移至B中;
Ⅲ.向A剩余的溶液中滴加几滴酚酞试液。
请回答下列问题:
(1)“步骤Ⅱ”B中左侧溶液褪色且有气泡产生,右侧溶液变为红色。
①将部分液体转移至B中的具体操作为_______ 。
②右侧溶液变红色的原因是_______ (用离子方程式解释)。
③左侧 参与反应的离子方程式为
参与反应的离子方程式为_______ 。
(2)若向“步骤Ⅱ”A的剩余溶液中加入 时,有大量气泡产生。
时,有大量气泡产生。
① 在该反应中的作用为
在该反应中的作用为_______ 。
②“步骤Ⅲ”的现象为_______ ;由此推测 与
与 反应的第一步为
反应的第一步为_______ (写出化学方程式)。
(3)过氧化钠可与铝粉发生反应: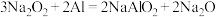 ,该反应可以体现
,该反应可以体现 具有
具有_______ (填“氧化性”、“还原性”或“既有氧化性,也有还原性”)。
 化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究
化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究 与
与 的反应机理,实验步骤如下:
的反应机理,实验步骤如下:
Ⅰ.打开
 、
、 ,通过注射器注入适量蒸馏水,使固体全部溶解(未见气泡产生);
,通过注射器注入适量蒸馏水,使固体全部溶解(未见气泡产生);Ⅱ.将部分液体转移至B中;
Ⅲ.向A剩余的溶液中滴加几滴酚酞试液。
请回答下列问题:
(1)“步骤Ⅱ”B中左侧溶液褪色且有气泡产生,右侧溶液变为红色。
①将部分液体转移至B中的具体操作为
②右侧溶液变红色的原因是
③左侧
 参与反应的离子方程式为
参与反应的离子方程式为(2)若向“步骤Ⅱ”A的剩余溶液中加入
 时,有大量气泡产生。
时,有大量气泡产生。①
 在该反应中的作用为
在该反应中的作用为②“步骤Ⅲ”的现象为
 与
与 反应的第一步为
反应的第一步为(3)过氧化钠可与铝粉发生反应:
 ,该反应可以体现
,该反应可以体现 具有
具有
您最近一年使用:0次
2023-01-04更新
|
772次组卷
|
3卷引用:辽宁省辽南协作体2022-2023学年高一上学期期末考试化学试题
名校
解题方法
2 . 某无色溶液中存在大量的Ba2+、OH-、I-,则该溶液中还可能大量存在的离子是
A. | B. | C. | D. |
您最近一年使用:0次
2023-01-04更新
|
201次组卷
|
3卷引用:上海市复旦大学附属中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
3 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是_______(填字母代号)。
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
①请写出FeCl3溶液与铜反应的离子方程式:_______ 。
②反应后的废液中含有Fe3+,请写出用KSCN溶液检验铁离子的离子方程式_______ 。请问能否用酸性高锰酸钾溶液检验反应后的溶废液中是否含有Fe2+?_______ (填能或不能),并用离子方程式解释原因:_______ 。
③现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。
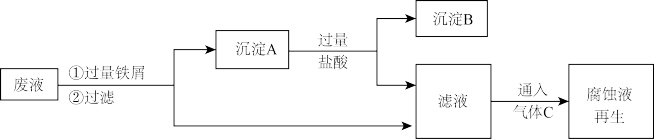
沉淀A中含有的单质:_______ ,气体C可以把滤液转化成FeCl3腐蚀液,写出反应过程中的离子方程式_______ 。加入H2O2溶液也可以到达相同目的,请写出H2O2与滤液反应离子方程式:_______ 。
(1)所含铁元素既有氧化性又有还原性的物质是_______(填字母代号)。
| A.Fe | B.FeCl2 | C.FeSO4 | D.Fe2O3 |
①请写出FeCl3溶液与铜反应的离子方程式:
②反应后的废液中含有Fe3+,请写出用KSCN溶液检验铁离子的离子方程式
③现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。

沉淀A中含有的单质:
您最近一年使用:0次
2023-01-02更新
|
417次组卷
|
2卷引用:河南省郑州市中牟县第一高级中学2022-2023学年高一上学期第三次月考化学试题
名校
解题方法
4 . 铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
【查阅资料】1.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
2. 中的硫元素为-2价。
中的硫元素为-2价。
实验I.检验该补铁剂中铁元素的价态。

(1)将补铁剂碾碎的目的是_______ 。
(2)试剂1是_______ ,试剂2是_______ 。
(3)加入试剂2后溶液变为浅红色,说明溶液①中含有_______ 。
(4)能证明溶液①中含有 的实验现象是
的实验现象是_______ 。
(5)补全在上述条件下 与
与 发生反应的离子方程式:
发生反应的离子方程式:_______ 。

(6)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的 与
与 发生了化学反应。
发生了化学反应。
a.甲同学猜测的依据是_______ 。
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是_______ 。
实验II.测定该补铁剂中铁元素的含量。

(7)计算每片该补铁剂含铁元素的质量为_______ g。
(8)人体只能吸收 ,医生建议在服用该补铁剂时,同时服用有较强还原性的维生素C,理由是
,医生建议在服用该补铁剂时,同时服用有较强还原性的维生素C,理由是_______ 。
【查阅资料】1.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
2.
 中的硫元素为-2价。
中的硫元素为-2价。实验I.检验该补铁剂中铁元素的价态。

(1)将补铁剂碾碎的目的是
(2)试剂1是
(3)加入试剂2后溶液变为浅红色,说明溶液①中含有
(4)能证明溶液①中含有
 的实验现象是
的实验现象是(5)补全在上述条件下
 与
与 发生反应的离子方程式:
发生反应的离子方程式:
(6)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的
 与
与 发生了化学反应。
发生了化学反应。a.甲同学猜测的依据是
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是
实验II.测定该补铁剂中铁元素的含量。

(7)计算每片该补铁剂含铁元素的质量为
(8)人体只能吸收
 ,医生建议在服用该补铁剂时,同时服用有较强还原性的维生素C,理由是
,医生建议在服用该补铁剂时,同时服用有较强还原性的维生素C,理由是
您最近一年使用:0次
名校
解题方法
5 . 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.和 反应能放出 反应能放出 的溶液中: 的溶液中: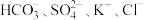 |
B.无色透明溶液中: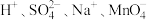 |
C.能使酚酞变红的溶液中: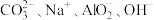 |
D.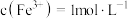 的溶液中: 的溶液中: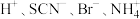 |
您最近一年使用:0次
名校
解题方法
6 . 在下列各溶液中离子能大量共存的是
A. 、 、 、 、 、 、 | B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 | D. 、 、 、 、 、 、 |
您最近一年使用:0次
2023-01-01更新
|
191次组卷
|
3卷引用:黑龙江省哈尔滨市2021-2022学年高一上学期期末学业质量检测化学试题
名校
7 . 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。某实验小组模拟工业制备硫氰化钾的方法,设计实验如图:
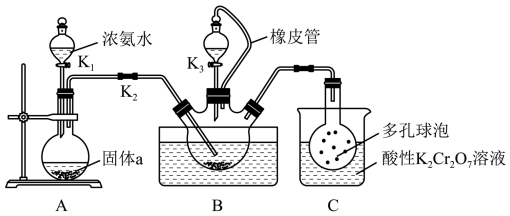
已知: 是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
Ⅰ.制备 溶液
溶液
(1)装置A用于制备 ,圆底烧瓶内的固体a是
,圆底烧瓶内的固体a是_______ (填名称)。
(2)三颈烧瓶内盛放有 、水和固体催化剂,发生反应
、水和固体催化剂,发生反应 。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入
。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入 中,其目的是使反应更充分且
中,其目的是使反应更充分且_______ 。
(3)一段时间后,当观察到三颈烧瓶内_______ 时,停止通入气体,反应完成。
Ⅱ.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待 完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为
完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为_______ ;酸性 溶液除可以吸收
溶液除可以吸收 外,还能吸收的气体是
外,还能吸收的气体是_______ 。
Ⅲ.制备KSCN晶体
先通过过滤除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。
(5)测定晶体中KSCN的含量:称取10.0 g样品,配成1000 mL溶液。量取25.00 mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000 mol/L 标准溶液滴定,达到滴定终点,三次滴定平均消耗
标准溶液滴定,达到滴定终点,三次滴定平均消耗 标准溶液20.00 mL。
标准溶液20.00 mL。
①滴定时发生的反应: (白色),则指示剂的化学式为
(白色),则指示剂的化学式为_______ (填序号)。则滴定终点的现象是_______ 。
A. B.
B. C.
C. D.
D.
②晶体中KSCN的质量分数为_______ (计算结果保留三位有效数字)。

已知:
 是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:Ⅰ.制备
 溶液
溶液(1)装置A用于制备
 ,圆底烧瓶内的固体a是
,圆底烧瓶内的固体a是(2)三颈烧瓶内盛放有
 、水和固体催化剂,发生反应
、水和固体催化剂,发生反应 。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入
。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入 中,其目的是使反应更充分且
中,其目的是使反应更充分且(3)一段时间后,当观察到三颈烧瓶内
Ⅱ.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待
 完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为
完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为 溶液除可以吸收
溶液除可以吸收 外,还能吸收的气体是
外,还能吸收的气体是Ⅲ.制备KSCN晶体
先通过过滤除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。
(5)测定晶体中KSCN的含量:称取10.0 g样品,配成1000 mL溶液。量取25.00 mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000 mol/L
 标准溶液滴定,达到滴定终点,三次滴定平均消耗
标准溶液滴定,达到滴定终点,三次滴定平均消耗 标准溶液20.00 mL。
标准溶液20.00 mL。①滴定时发生的反应:
 (白色),则指示剂的化学式为
(白色),则指示剂的化学式为A.
 B.
B. C.
C. D.
D.
②晶体中KSCN的质量分数为
您最近一年使用:0次
2022-12-31更新
|
473次组卷
|
5卷引用:黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试化学试题
黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(实验探究题)福建省三明市2022-2023学年高三上学期期末考试化学试题江苏省盐城市北京师范大学盐城附属学校2023届高三上学期期末考试化学试题
解题方法
8 . 某校化学兴趣小组探究SO2与FeCl3溶液的反应。
资料:铁氰化钾 可以与Fe2+形成蓝色沉淀,常用于Fe2+检验。
可以与Fe2+形成蓝色沉淀,常用于Fe2+检验。

(1)实验室常用70%硫酸与亚硫酸钠固体制备SO2,写出反应的化学方程式_______ 。
(2)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由黄色变成浅绿色,写出相关反应的离子方程式_______ 。
(3)向试管B中溶液通入SO2至饱和,溶液变成红色,静置5min后,溶液的颜色从红色慢慢变回黄色。静置9h后,溶液慢慢由黄色变为浅绿色。
①甲同学认为溶液变红的原因是通入SO2后,Fe3+水解程度增大,形成Fe(OH)3胶体。乙同学根据SO2的性质否定了这一推论,原因是_______ 。
②丙同学取上述5min后的黄色溶液,滴加盐酸酸化的BaCl2溶液,产生白色沉淀。该同学认为SO2与Fe3+发生氧化还原反应。丁同学认为该结论不严谨,重新设计并进行实验,证明两者发生了氧化还原反应,写出实验方案及现象_______ 。
(4)查阅资料:Fe3+能与S(IV)微粒形成红色配合物。
该小组同学分析SO2水溶液成分,猜想可能是其中含S(IV)微粒SO2、H2SO3、_______ 与Fe3+形成配合物而使溶液呈现红色。进行如下实验:
①a=_______ 。
②根据实验I现象,溶液中SO2、H2SO3浓度增大,红色消失,说明红色物质可能与SO2、H2SO3无关;_______ ,红色物质可能与 有关。
有关。
(5)通过上述实验可得结论:
①SO2与FeCl3溶液的反应,可以发生配位反应、氧化还原反应。
②_______ 。
资料:铁氰化钾
 可以与Fe2+形成蓝色沉淀,常用于Fe2+检验。
可以与Fe2+形成蓝色沉淀,常用于Fe2+检验。
(1)实验室常用70%硫酸与亚硫酸钠固体制备SO2,写出反应的化学方程式
(2)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由黄色变成浅绿色,写出相关反应的离子方程式
(3)向试管B中溶液通入SO2至饱和,溶液变成红色,静置5min后,溶液的颜色从红色慢慢变回黄色。静置9h后,溶液慢慢由黄色变为浅绿色。
①甲同学认为溶液变红的原因是通入SO2后,Fe3+水解程度增大,形成Fe(OH)3胶体。乙同学根据SO2的性质否定了这一推论,原因是
②丙同学取上述5min后的黄色溶液,滴加盐酸酸化的BaCl2溶液,产生白色沉淀。该同学认为SO2与Fe3+发生氧化还原反应。丁同学认为该结论不严谨,重新设计并进行实验,证明两者发生了氧化还原反应,写出实验方案及现象
(4)查阅资料:Fe3+能与S(IV)微粒形成红色配合物。
该小组同学分析SO2水溶液成分,猜想可能是其中含S(IV)微粒SO2、H2SO3、
| 序号 | 实验 | 加入试剂 | 现象 |
| I |  | 2mL1mol/LNaHSO3溶液;再滴加几滴盐酸 | 溶液变成红色,比(3)中溶液红色深;滴加盐酸后,溶液颜色由红色变成黄色 |
| II | 2mL1mol/LNa2SO3溶液 | 溶液变成红色,比I中溶液红色深 |
②根据实验I现象,溶液中SO2、H2SO3浓度增大,红色消失,说明红色物质可能与SO2、H2SO3无关;
 有关。
有关。(5)通过上述实验可得结论:
①SO2与FeCl3溶液的反应,可以发生配位反应、氧化还原反应。
②
您最近一年使用:0次
9 . 过二硫酸盐具有强氧化性,可作氧化剂和漂白剂。MnO2是一种重要的化工试剂,在合成工业用途广泛。
Ⅰ.过二硫酸钠(Na2S2O8)也叫做高硫酸钠,可用于废气处理及有害物质氧化降解。用过二硫酸铵[(NH4)2S2O8]溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体。同时还会放出氨气。某化学兴趣小组在实验室模拟制备Na2S2O8晶体(装置如图-1所示)。

已知:反应过程中发生的副反应为:2NH3+3Na2S2O8+ 6NaOH 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)反应过程中持续通入N2目的是_______ 。
(2)过二硫酸盐的性质及应用。
①Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,该物质的电子式为_______ 。
②过二硫酸铵可用于检验废水中的Cr3+是否超标,如果超标,溶液会变成橙色(Cr2O ) ,写出该反应的离子方程式:
) ,写出该反应的离子方程式:_______ 。
Ⅱ.由软锰矿(主要成分为MnO2,主要杂质有Al2O3和SiO2),制备MnO2的一种工艺流程如图:

已知:该工艺条件下,MnO2和H2SO4不反应,MnO2的氧化性随酸性的减弱而减弱。
(3)上述流程中可循环利用的物有_______ 。 (写化学式)
(4)纯化时需要加入的试剂有MnO2和NH3·H2O。加入的顺序为_______ 。
A.先加入MnO2,后加入NH3·H2O B.先加入NH3·H2O,后加入MnO2
(5)已知MnSO4可发生如下反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O,MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量( )与NaOH和MnSO4物质的量比值之间的关系如图-2所示:
)与NaOH和MnSO4物质的量比值之间的关系如图-2所示:

根据信息,补充完整制取纯净MnO2的实验方案:将40mL 1.0mol / L的MnSO4溶液和40mL 1.0mol / L的K2S2O8溶液混合,_______ ,干燥,得到纯净的MnO2(实验中须使用的试剂是1.0mol / L NaOH溶液、1.0 mol / L H2SO4溶液、1.0mol / L BaCl2溶液、蒸馏水)
Ⅰ.过二硫酸钠(Na2S2O8)也叫做高硫酸钠,可用于废气处理及有害物质氧化降解。用过二硫酸铵[(NH4)2S2O8]溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体。同时还会放出氨气。某化学兴趣小组在实验室模拟制备Na2S2O8晶体(装置如图-1所示)。

已知:反应过程中发生的副反应为:2NH3+3Na2S2O8+ 6NaOH
 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2(1)反应过程中持续通入N2目的是
(2)过二硫酸盐的性质及应用。
①Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,该物质的电子式为
②过二硫酸铵可用于检验废水中的Cr3+是否超标,如果超标,溶液会变成橙色(Cr2O
 ) ,写出该反应的离子方程式:
) ,写出该反应的离子方程式:Ⅱ.由软锰矿(主要成分为MnO2,主要杂质有Al2O3和SiO2),制备MnO2的一种工艺流程如图:

已知:该工艺条件下,MnO2和H2SO4不反应,MnO2的氧化性随酸性的减弱而减弱。
(3)上述流程中可循环利用的物有
(4)纯化时需要加入的试剂有MnO2和NH3·H2O。加入的顺序为
A.先加入MnO2,后加入NH3·H2O B.先加入NH3·H2O,后加入MnO2
(5)已知MnSO4可发生如下反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O,MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量(
 )与NaOH和MnSO4物质的量比值之间的关系如图-2所示:
)与NaOH和MnSO4物质的量比值之间的关系如图-2所示:
根据信息,补充完整制取纯净MnO2的实验方案:将40mL 1.0mol / L的MnSO4溶液和40mL 1.0mol / L的K2S2O8溶液混合,
您最近一年使用:0次
名校
解题方法
10 . 常温下,下列各组离子在指定的溶液中一定能大量共存的是
A.在加入铝产生氢气的溶液: 、 、 、 、 、 、 |
B.在 溶液中: 溶液中: 、 、 、 、 、 、 |
C.在碱性溶液中: 、 、 、 、 、 、 |
D.在透明溶液中: 、 、 、 、 、 、 |
您最近一年使用:0次



