名校
1 . 硫酸亚铁(FeSO4)是中学化学常用试剂,可用于治疗缺铁性贫血症。
(1)实验室配备FeSO4溶液时为防止硫酸亚铁变质,常采用的措施是___________ (填一种)。
(2)以FeSO4为原料可制备碱式硫酸铁[Fe4(OH)2(SO4)5]、铁红、硫酸亚铁铵[(NH4)2Fe(SO4)2,俗名摩尔盐],转化关系如图所示。___________ 。
②制备FeCO3时,向FeSO4溶液中加入过量的NH4HCO3溶液,有气体生成,该反应的离子方程式为___________ 。
③制备摩尔盐时将反应物混合,经___________ 、冷却结晶、过滤、洗涤、干燥得到产品。
用工业废渣(主要含有Fe2O3、FeO、Al2O3及少量Fe)制备绿矾FeSO4·7H2O晶体的流程如下:___________ 。
(4)“溶解”后所得溶液中含有的阳离子为Fe3+和___________ 。
(5)“还原”时选择FeS2而不用Cu粉的原因是___________ 。
(6)测定绿矾中Fe2+的氧化率实验方案如下:
步骤一:称取一定质量的绿矾样品,将其溶于适量的无氧蒸馏水并配成250mL溶液;
步骤二:取步骤一中配得的溶液25.00mL于锥形瓶,并加入适量稀硫酸酸化,逐滴滴加0.0400mol/LKMnO4溶液至恰好完全反应,反应原理为:MnO +Fe2++H+=Mn2++Fe3++H2O(未配平),消耗KMnO4溶液20.00mL;
+Fe2++H+=Mn2++Fe3++H2O(未配平),消耗KMnO4溶液20.00mL;
步骤三:另取步骤一中配得的溶液25.00mL于烧杯,加入足量氨水,将沉淀过滤、洗涤、干燥,在空气中灼烧至固体质量不再变化,称得残留红棕色固体的质量为0.4g。(已知: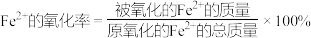 )
)
根据以上数据,计算该绿矾样品中Fe2+的氧化率,写出计算过程:___________ 。
(1)实验室配备FeSO4溶液时为防止硫酸亚铁变质,常采用的措施是
(2)以FeSO4为原料可制备碱式硫酸铁[Fe4(OH)2(SO4)5]、铁红、硫酸亚铁铵[(NH4)2Fe(SO4)2,俗名摩尔盐],转化关系如图所示。
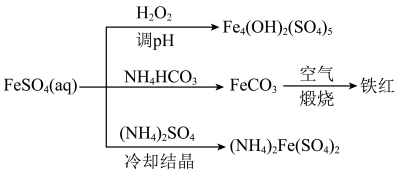
②制备FeCO3时,向FeSO4溶液中加入过量的NH4HCO3溶液,有气体生成,该反应的离子方程式为
③制备摩尔盐时将反应物混合,经
用工业废渣(主要含有Fe2O3、FeO、Al2O3及少量Fe)制备绿矾FeSO4·7H2O晶体的流程如下:

(4)“溶解”后所得溶液中含有的阳离子为Fe3+和
(5)“还原”时选择FeS2而不用Cu粉的原因是
(6)测定绿矾中Fe2+的氧化率实验方案如下:
步骤一:称取一定质量的绿矾样品,将其溶于适量的无氧蒸馏水并配成250mL溶液;
步骤二:取步骤一中配得的溶液25.00mL于锥形瓶,并加入适量稀硫酸酸化,逐滴滴加0.0400mol/LKMnO4溶液至恰好完全反应,反应原理为:MnO
 +Fe2++H+=Mn2++Fe3++H2O(未配平),消耗KMnO4溶液20.00mL;
+Fe2++H+=Mn2++Fe3++H2O(未配平),消耗KMnO4溶液20.00mL;步骤三:另取步骤一中配得的溶液25.00mL于烧杯,加入足量氨水,将沉淀过滤、洗涤、干燥,在空气中灼烧至固体质量不再变化,称得残留红棕色固体的质量为0.4g。(已知:
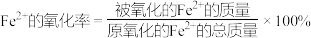 )
)根据以上数据,计算该绿矾样品中Fe2+的氧化率,写出计算过程:
您最近半年使用:0次
名校
2 . 铁黑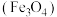 是常见的铁系颜料,:可利用硫铁矿废水为原料进行制备,不仅为硫铁矿废水的处理开辟了新途径,同时也实现了资源利用,生产流程如下:
是常见的铁系颜料,:可利用硫铁矿废水为原料进行制备,不仅为硫铁矿废水的处理开辟了新途径,同时也实现了资源利用,生产流程如下:
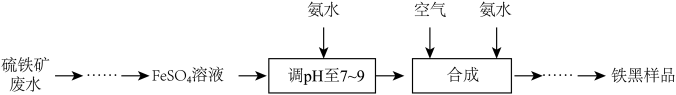
(1)在实验室中,为防止 溶液被氧化变质,需要往试剂瓶中加入
溶液被氧化变质,需要往试剂瓶中加入_______ ,检验 溶液是否变质的常用试剂是
溶液是否变质的常用试剂是_______ 。
(2)加入氨水调 至7~9时,发生反应的离子方程式为
至7~9时,发生反应的离子方程式为_______ ; “合成”步骤中, 转化为
转化为 的化学方程式为
的化学方程式为_______ 。
(3)某化学学习小组测定产品中铁的含量,实验步骤如下:
步骤一:取 铁黑样品于锥形瓶中,加入足量盐酸,加热使之完全溶解。
铁黑样品于锥形瓶中,加入足量盐酸,加热使之完全溶解。
步骤二:加入过量的 溶液将
溶液将 还原成
还原成 ,再加入
,再加入 溶液。
溶液。
步骤三:在酸性条件下,加入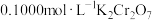 溶液与
溶液与 发生反应:
发生反应:  ,恰好完全反应时,消耗
,恰好完全反应时,消耗 溶液
溶液 。
。
由步骤二得出 的还原性
的还原性_______  的还原性(填“强于”或“弱于”);加入
的还原性(填“强于”或“弱于”);加入 溶液的目的是
溶液的目的是_______ 。样品中 元素的质量分数为
元素的质量分数为_______  。
。
 是常见的铁系颜料,:可利用硫铁矿废水为原料进行制备,不仅为硫铁矿废水的处理开辟了新途径,同时也实现了资源利用,生产流程如下:
是常见的铁系颜料,:可利用硫铁矿废水为原料进行制备,不仅为硫铁矿废水的处理开辟了新途径,同时也实现了资源利用,生产流程如下:
(1)在实验室中,为防止
 溶液被氧化变质,需要往试剂瓶中加入
溶液被氧化变质,需要往试剂瓶中加入 溶液是否变质的常用试剂是
溶液是否变质的常用试剂是(2)加入氨水调
 至7~9时,发生反应的离子方程式为
至7~9时,发生反应的离子方程式为 转化为
转化为 的化学方程式为
的化学方程式为(3)某化学学习小组测定产品中铁的含量,实验步骤如下:
步骤一:取
 铁黑样品于锥形瓶中,加入足量盐酸,加热使之完全溶解。
铁黑样品于锥形瓶中,加入足量盐酸,加热使之完全溶解。步骤二:加入过量的
 溶液将
溶液将 还原成
还原成 ,再加入
,再加入 溶液。
溶液。步骤三:在酸性条件下,加入
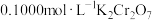 溶液与
溶液与 发生反应:
发生反应:  ,恰好完全反应时,消耗
,恰好完全反应时,消耗 溶液
溶液 。
。由步骤二得出
 的还原性
的还原性 的还原性(填“强于”或“弱于”);加入
的还原性(填“强于”或“弱于”);加入 溶液的目的是
溶液的目的是 元素的质量分数为
元素的质量分数为 。
。
您最近半年使用:0次
2023-04-23更新
|
197次组卷
|
2卷引用:山东省菏泽市2022-2023学年高一上学期教学质量检测(期末)化学试题
名校
3 . 铁及其化合物在生产、生活中有着广泛的应用。
I.钢(一种铁碳合金)是用量最大、用途最广的合金。钢中碳的含量范围为_______ 。
a.4.3%~5% b.2%~4.3% c.0.03%~2%
II.FeSO4可作补血剂,用于治疗缺铁性贫血症。用 FeSO4溶液制备 Fe(OH)2的操作是用长滴管吸取不含 O2的 NaOH 溶液,插入 FeSO4溶液液面下,再挤出 NaOH 溶液。这样操作的原因是为了防止 Fe(OH)2被氧化,写出其被氧化的化学反应方程式_______ 。
III.高铁酸钾(K2FeO4)是一种新型、高效、无毒的多功能水处理剂。查阅资料已知:K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液自身发生氧化还原生成Fe3+,并快速产生 O2,在碱性溶液中较稳定。
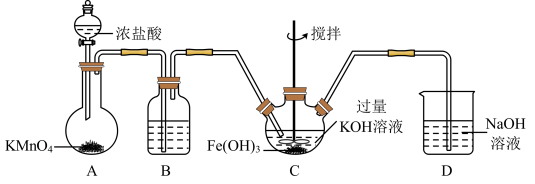
(1)制备K2FeO4
①在装置A中发生的化学反应中 HCl显示出来的性质为_______ 。
②C为制备K2FeO4装置,次氯酸钾与氢氧化铁在碱性环境中反应生成K2FeO4,该氧化还原反应中氧化剂与还原剂的物质的量之比为_______ 。
(2)探究K2FeO4的性质
取 C中浅紫红色溶液,加入稀硫酸,产生黄绿色气体,得溶液 a,经检验气体中含有 Cl2。为证明K2FeO4能否氧化 Cl-而产生 Cl2,设计如下方案:取少量溶液 a,滴加_______ 溶液至过量,溶液呈红色。由方案中溶液变红可知 a中含有 Fe3+,该离子的产生不能判断一定是由 K2FeO4被 Cl-还原而形成的,原因是_______ 。
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
①完成并配平离子方程式:_______
_______FeO +_______H+=_______Fe3++_______O2↑+_______H2O
+_______H+=_______Fe3++_______O2↑+_______H2O
②现取C中洗涤并干燥后的样品10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。(计算结果保留到 0.1%)
I.钢(一种铁碳合金)是用量最大、用途最广的合金。钢中碳的含量范围为
a.4.3%~5% b.2%~4.3% c.0.03%~2%
II.FeSO4可作补血剂,用于治疗缺铁性贫血症。用 FeSO4溶液制备 Fe(OH)2的操作是用长滴管吸取不含 O2的 NaOH 溶液,插入 FeSO4溶液液面下,再挤出 NaOH 溶液。这样操作的原因是为了防止 Fe(OH)2被氧化,写出其被氧化的化学反应方程式
III.高铁酸钾(K2FeO4)是一种新型、高效、无毒的多功能水处理剂。查阅资料已知:K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液自身发生氧化还原生成Fe3+,并快速产生 O2,在碱性溶液中较稳定。

(1)制备K2FeO4
①在装置A中发生的化学反应中 HCl显示出来的性质为
②C为制备K2FeO4装置,次氯酸钾与氢氧化铁在碱性环境中反应生成K2FeO4,该氧化还原反应中氧化剂与还原剂的物质的量之比为
(2)探究K2FeO4的性质
取 C中浅紫红色溶液,加入稀硫酸,产生黄绿色气体,得溶液 a,经检验气体中含有 Cl2。为证明K2FeO4能否氧化 Cl-而产生 Cl2,设计如下方案:取少量溶液 a,滴加
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
①完成并配平离子方程式:
_______FeO
 +_______H+=_______Fe3++_______O2↑+_______H2O
+_______H+=_______Fe3++_______O2↑+_______H2O②现取C中洗涤并干燥后的样品10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为
您最近半年使用:0次
名校
4 . 纳米Fe3O4在磁流体、催化剂、医学等领域具有广阔的应用前景。氧化共沉淀制备纳米Fe3O4的方法如下:
Ⅰ.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到FeOOH红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生白色沉淀,该反应的离子方程式是___________ 。
②该白色沉淀置于空气中能观察的现象是___________ 。
③上述反应完成后,测得a值与FeOOH产率及其生成后溶液pH的关系,结果如下:
用离子方程式解释FeOOH生成后溶液pH下降的原因:___________ 。
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeOOH向Fe2O3的转化;
ii.溶液中存在少量Fe2+,导致FeOOH向Fe2O3的转化。
①经分析,假设i不成立的实验依据是___________ 。
②其他条件相同时,向FeOOH浊液中加入不同浓度Fe2+,30min后测定物质的组成,结果如下:
以上结果表明:___________ 。
③a=7和a=9时,FeOOH产率差异很大的原因是___________ 。
Ⅱ.Fe2+和Fe3+共沉淀:向FeOOH红棕色悬浊液中同时加入FeSO4溶液和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3O4。
(3)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是___________ 。
②已知N=n(FeOOH)/n(Fe2+),其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如下图所示:
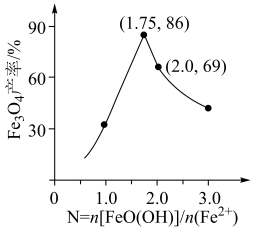
经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是___________ 。
(4)测量制得的纳米Fe3O4中n(Fe3+)/n(Fe2+):取ag样品,加入足量盐酸使之完全溶解,加入SnCl2将Fe3+还原为Fe2+;除去过量SnCl2后,用c1mol/LK2Cr2O7标准溶液滴定(还原产物为Cr3+),消耗K2Cr2O7溶液的体积为v1mL,另取ag样品,加入足量稀硫酸使之完全溶解,用c2mol/LKMnO4标准溶液滴定至终点,消耗KMnO4溶液的体积为v2mL,则样品中n(Fe3+)/n(Fe2+)为___________ 。
Ⅰ.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到FeOOH红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生白色沉淀,该反应的离子方程式是
②该白色沉淀置于空气中能观察的现象是
③上述反应完成后,测得a值与FeOOH产率及其生成后溶液pH的关系,结果如下:
| a | 7.0 | 8.0 | 9.0 |
| FeO(OH)的产率 | <50% | 95% | >95% |
| FeO(OH)生成后的pH | 接近4 | 接近4 | 接近4 |
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeOOH向Fe2O3的转化;
ii.溶液中存在少量Fe2+,导致FeOOH向Fe2O3的转化。
①经分析,假设i不成立的实验依据是
②其他条件相同时,向FeOOH浊液中加入不同浓度Fe2+,30min后测定物质的组成,结果如下:
| c(Fe2+)/mol/L | FeO(OH)百分含量/% | Fe2O3百分含量/% |
| 0.00 | 100 | 0 |
| 0.01 | 40 | 60 |
| 0.02 | 0 | 100 |
③a=7和a=9时,FeOOH产率差异很大的原因是
Ⅱ.Fe2+和Fe3+共沉淀:向FeOOH红棕色悬浊液中同时加入FeSO4溶液和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3O4。
(3)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是
②已知N=n(FeOOH)/n(Fe2+),其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如下图所示:

经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是
(4)测量制得的纳米Fe3O4中n(Fe3+)/n(Fe2+):取ag样品,加入足量盐酸使之完全溶解,加入SnCl2将Fe3+还原为Fe2+;除去过量SnCl2后,用c1mol/LK2Cr2O7标准溶液滴定(还原产物为Cr3+),消耗K2Cr2O7溶液的体积为v1mL,另取ag样品,加入足量稀硫酸使之完全溶解,用c2mol/LKMnO4标准溶液滴定至终点,消耗KMnO4溶液的体积为v2mL,则样品中n(Fe3+)/n(Fe2+)为
您最近半年使用:0次
名校
5 . 铁常见的化合价有0、+2、+3,某化学兴趣小组进行了一系列有关铁及其化合物的实验,并检验其中所含的铁元素的化合价。
Ⅰ.利用如图装置进行“铁与水反应”的实验,并检验产物。
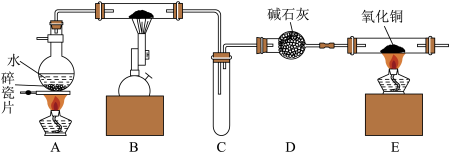
(1)B中反应的化学方程式为_______ 。
(2)E中的氧化铜出现由黑色变成红色可以证明反应后生成H2,点燃E处酒精灯之前应进行的具体操作步骤是_______ 。
(3)
现象A是_______ , a溶液中不含Fe3+的原因是金属铁将三价铁离子变成二价铁离子。
Ⅱ.铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
[查阅资料] 1.该 补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
2.KSCN中的硫元素为-2价。
3.K3[ Fe(CN)6]与Fe2+会产生蓝色沉淀。
实验一:检验该补铁剂中铁元素的价态。
(4)已知甲同学为了检验药品中Fe2+的存在。将药物碾碎、水溶后过滤。取少量所得滤液于试管中,加入K3[Fe(CN)6]溶液,未出现明显现象,其主要原因为_______ 。
改进后进行如下操作:

(5)试剂1是_______ , 试剂2是_______ 。
(6)加入试剂2后溶液变为浅红色,说明溶液①中含有_______ 。
(7)能证明溶液①中含有Fe2+的实验现象是_______ 。
(8)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是_______ 。
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是_______ 。
实验二:测定该补铁剂中铁元素的含量。
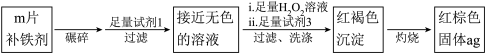
(9)计算每片该补铁剂含铁元素的质量为_______ g。
(10)人体只能吸收Fe2+,医生建议在服用该补铁剂时,同时服用维生素C,理由是_______ 。
Ⅰ.利用如图装置进行“铁与水反应”的实验,并检验产物。

(1)B中反应的化学方程式为
(2)E中的氧化铜出现由黑色变成红色可以证明反应后生成H2,点燃E处酒精灯之前应进行的具体操作步骤是
(3)
| 步骤 | 现象 |
| Ⅰ.取B中硬质玻璃管反应后样品少许,加入足量的盐酸并过滤,滤液为a | 固体溶解,溶液为绿色 |
| Ⅱ.取a溶液少许,滴加KSCN溶液 | 溶液不变红色 |
| Ⅲ.取a溶液少许,滴加NaOH溶液 | 现象A |
Ⅱ.铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
[查阅资料] 1.该 补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
2.KSCN中的硫元素为-2价。
3.K3[ Fe(CN)6]与Fe2+会产生蓝色沉淀。
实验一:检验该补铁剂中铁元素的价态。
(4)已知甲同学为了检验药品中Fe2+的存在。将药物碾碎、水溶后过滤。取少量所得滤液于试管中,加入K3[Fe(CN)6]溶液,未出现明显现象,其主要原因为
改进后进行如下操作:

(5)试剂1是
(6)加入试剂2后溶液变为浅红色,说明溶液①中含有
(7)能证明溶液①中含有Fe2+的实验现象是
(8)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是
实验二:测定该补铁剂中铁元素的含量。

(9)计算每片该补铁剂含铁元素的质量为
(10)人体只能吸收Fe2+,医生建议在服用该补铁剂时,同时服用维生素C,理由是
您最近半年使用:0次
名校
6 . A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂。

(1)物质C的化学式___________ ;物质B的电子式为___________
(2)写出反应的化学反应方程式:⑤___________
(3)写出反应的离子方程式:⑦___________
(4)Na2FeO4还可在碱性条件下,用NaClO氧化Fe(OH)3来制备,请书写离子方程式:____________ 。根据Na2FeO4元素的价态及反应前后的产物推测Na2FeO4杀菌消毒做净水剂的原因___________ 。
(5)可用滴定分析法测定Na2FeO4的纯度,已知: FeO +CrO
+CrO +2H2O=CrO
+2H2O=CrO +Fe(OH)3+OH-;2CrO
+Fe(OH)3+OH-;2CrO +2H+=Cr2O
+2H+=Cr2O +H2O ; Cr2O
+H2O ; Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O。现称量2.28g高铁酸钠粗样品溶解,加入足量KCrO2充分反应后过滤,将滤液定容于250mL容量瓶,每次取25mL定容后的溶液,加入稀硫酸进行酸化,再用0.100mol/L的(NH4)2Fe(SO4)2标准溶液滴定三次,每次消耗标准液的体积分别为28.36mL、29.98mL、30.02mL。则:
+6Fe2++14H+=2Cr3++6Fe3++7H2O。现称量2.28g高铁酸钠粗样品溶解,加入足量KCrO2充分反应后过滤,将滤液定容于250mL容量瓶,每次取25mL定容后的溶液,加入稀硫酸进行酸化,再用0.100mol/L的(NH4)2Fe(SO4)2标准溶液滴定三次,每次消耗标准液的体积分别为28.36mL、29.98mL、30.02mL。则:
①上述样品中高铁酸钠的质量分数为___________ 。
② 若到达滴定终点时仰视读数,将导致所测定的样品质量分数___________ 。(偏大、偏小、不变)

(1)物质C的化学式
(2)写出反应的化学反应方程式:⑤
(3)写出反应的离子方程式:⑦
(4)Na2FeO4还可在碱性条件下,用NaClO氧化Fe(OH)3来制备,请书写离子方程式:
(5)可用滴定分析法测定Na2FeO4的纯度,已知: FeO
 +CrO
+CrO +2H2O=CrO
+2H2O=CrO +Fe(OH)3+OH-;2CrO
+Fe(OH)3+OH-;2CrO +2H+=Cr2O
+2H+=Cr2O +H2O ; Cr2O
+H2O ; Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O。现称量2.28g高铁酸钠粗样品溶解,加入足量KCrO2充分反应后过滤,将滤液定容于250mL容量瓶,每次取25mL定容后的溶液,加入稀硫酸进行酸化,再用0.100mol/L的(NH4)2Fe(SO4)2标准溶液滴定三次,每次消耗标准液的体积分别为28.36mL、29.98mL、30.02mL。则:
+6Fe2++14H+=2Cr3++6Fe3++7H2O。现称量2.28g高铁酸钠粗样品溶解,加入足量KCrO2充分反应后过滤,将滤液定容于250mL容量瓶,每次取25mL定容后的溶液,加入稀硫酸进行酸化,再用0.100mol/L的(NH4)2Fe(SO4)2标准溶液滴定三次,每次消耗标准液的体积分别为28.36mL、29.98mL、30.02mL。则:①上述样品中高铁酸钠的质量分数为
② 若到达滴定终点时仰视读数,将导致所测定的样品质量分数
您最近半年使用:0次



