1 . 铁及其化合物在生产、生活中有着广泛的应用。
(1)刻制铜印刷电路板时,要用FeCl3溶液作为“腐蚀液”,发生反应的离子方程式为_______ ,为了将反应后溶液中的Cu2+回收利用,并得到含有一种溶质的溶液,进行的具体操作是_______ 。
(2)高温时16.8g铁与足量水蒸气反应,生成气体的体积是_______ L(标准状况下)。
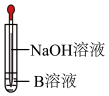
(3)如图,在胶头滴管挤出NaOH溶液的瞬间可观察到生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色,请写出上述现象中白色沉淀转化成红褐色沉淀的化学方程式_______ 。_______ 。
②酸浸时,Fe3O4与硫酸反应的化学方程式为_______ ;通入O2的目的是_______ 。
③滤渣的成分是_______ (填化学式)。
④“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+,再用酸性K2Cr2O7标准溶液测定Fe2+的量( 被还原为Cr3+),则SnCl2、Fe2+和Cr3+中还原性最强的是
被还原为Cr3+),则SnCl2、Fe2+和Cr3+中还原性最强的是_______ 。
(1)刻制铜印刷电路板时,要用FeCl3溶液作为“腐蚀液”,发生反应的离子方程式为
(2)高温时16.8g铁与足量水蒸气反应,生成气体的体积是
(3)如图,在胶头滴管挤出NaOH溶液的瞬间可观察到生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色,请写出上述现象中白色沉淀转化成红褐色沉淀的化学方程式
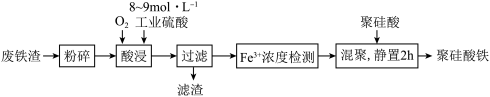
②酸浸时,Fe3O4与硫酸反应的化学方程式为
③滤渣的成分是
④“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+,再用酸性K2Cr2O7标准溶液测定Fe2+的量(
 被还原为Cr3+),则SnCl2、Fe2+和Cr3+中还原性最强的是
被还原为Cr3+),则SnCl2、Fe2+和Cr3+中还原性最强的是
您最近一年使用:0次
名校
解题方法
2 . 高铁酸钾 是一种新型、高效、多功能水处理剂,与水反应可生成透明的红褐色胶体,反应原理:
是一种新型、高效、多功能水处理剂,与水反应可生成透明的红褐色胶体,反应原理: 。
。
(1)胶体分散质粒子的直径范围是_________ 。该反应中 是
是_________ 。
A.还原剂 B.氧化剂 C.被还原 D.被氧化
(2) 能杀灭水中细菌的原因是
能杀灭水中细菌的原因是___________ 。
(3)配平湿法制高铁酸钾的离子反应方程式_________ 。
___________Fe(OH)3+___________ClO-+__________ ___________
___________ +___________
+___________ + ___________。
+ ___________。
 是一种新型、高效、多功能水处理剂,与水反应可生成透明的红褐色胶体,反应原理:
是一种新型、高效、多功能水处理剂,与水反应可生成透明的红褐色胶体,反应原理: 。
。(1)胶体分散质粒子的直径范围是
 是
是A.还原剂 B.氧化剂 C.被还原 D.被氧化
(2)
 能杀灭水中细菌的原因是
能杀灭水中细菌的原因是(3)配平湿法制高铁酸钾的离子反应方程式
___________Fe(OH)3+___________ClO-+__________
 ___________
___________ +___________
+___________ + ___________。
+ ___________。
您最近一年使用:0次
名校
解题方法
3 . 采用氧化沉淀法可以利用绿矾制取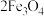 ,其制取流程如图所示:
,其制取流程如图所示:___________ (填写化学式),由溶液 获得该副产品的操作是:蒸发浓缩→
获得该副产品的操作是:蒸发浓缩→___________ →过滤洗涤 晶体加热至完全失去结晶水。
晶体加热至完全失去结晶水。
(2)某兴趣小组模仿如图流程制取 ,在实验前要测定绿矾的含量:称取
,在实验前要测定绿矾的含量:称取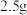 工业绿矾,配制成
工业绿矾,配制成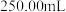 溶液。量取
溶液。量取 溶液于锥形瓶中,用
溶液于锥形瓶中,用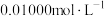 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的平均体积为
溶液的平均体积为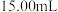 。(滴定时发生反应的离子方程式为
。(滴定时发生反应的离子方程式为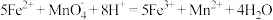 )则绿矾的质量分数为
)则绿矾的质量分数为___________ (计算结果保留三位小数)。
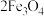 ,其制取流程如图所示:
,其制取流程如图所示:
 获得该副产品的操作是:蒸发浓缩→
获得该副产品的操作是:蒸发浓缩→ 晶体加热至完全失去结晶水。
晶体加热至完全失去结晶水。(2)某兴趣小组模仿如图流程制取
 ,在实验前要测定绿矾的含量:称取
,在实验前要测定绿矾的含量:称取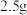 工业绿矾,配制成
工业绿矾,配制成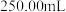 溶液。量取
溶液。量取 溶液于锥形瓶中,用
溶液于锥形瓶中,用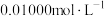 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的平均体积为
溶液的平均体积为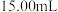 。(滴定时发生反应的离子方程式为
。(滴定时发生反应的离子方程式为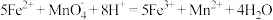 )则绿矾的质量分数为
)则绿矾的质量分数为
您最近一年使用:0次
4 . 铁及其化合物与生产、生活关系密切:
(1)下列铁化合物中,可以通过化合反应得到是_______(填字母序号)。
(2) 可作为铜电路板的腐蚀液,该反应的化学方程式
可作为铜电路板的腐蚀液,该反应的化学方程式_______ 。向反应后的溶液加入_______ (填名称),可回收Cu,并得到 溶液。
溶液。
(3)用废铁皮制取( )的部分流程示意图如下:
)的部分流程示意图如下:_______ 。
(4) 可制取新型、高效水处理剂高铁酸钾,反应原理为
可制取新型、高效水处理剂高铁酸钾,反应原理为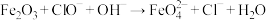 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为_______ 。
(5) 可将氨氮废水中
可将氨氮废水中 的转化为
的转化为 除去。从价态角度分析,
除去。从价态角度分析, 能处理氨氮废水的原因是
能处理氨氮废水的原因是_______ 。当该反应转移1.2mol电子时,能产生_______ mol 。
。
(1)下列铁化合物中,可以通过化合反应得到是_______(填字母序号)。
A. | B. | C. | D. |
(2)
 可作为铜电路板的腐蚀液,该反应的化学方程式
可作为铜电路板的腐蚀液,该反应的化学方程式 溶液。
溶液。(3)用废铁皮制取(
 )的部分流程示意图如下:
)的部分流程示意图如下: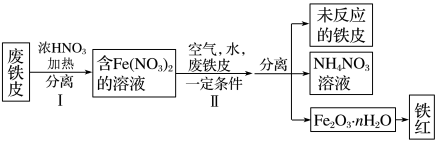
(4)
 可制取新型、高效水处理剂高铁酸钾,反应原理为
可制取新型、高效水处理剂高铁酸钾,反应原理为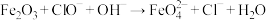 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为(5)
 可将氨氮废水中
可将氨氮废水中 的转化为
的转化为 除去。从价态角度分析,
除去。从价态角度分析, 能处理氨氮废水的原因是
能处理氨氮废水的原因是 。
。
您最近一年使用:0次
2024-05-03更新
|
136次组卷
|
2卷引用:福建省莆田第二十五中学2023-2024学年高一下学期期中考试化学试题
名校
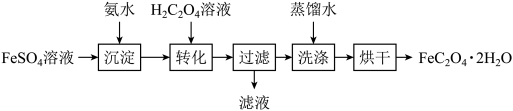
5 . 草酸亚铁晶体(FeC2O4·2H2O)可作为制备电池正极材料磷酸铁锂的原料。以FeSO4溶液制备电池级草酸亚铁晶体的实验流程如图:_______ 。
(2)“沉淀”步骤得到的混合体系不宜在空气中久置,其原因是_______ 。
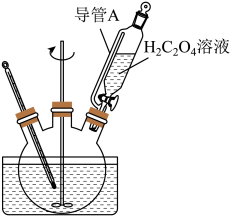
(3)“转化”在图所示的装置中进行。导管A的作用是_______ 。_______ 。
(5)测定草酸亚铁样品纯度的方法如下:准确称取0.2500g样品,加入适量水、浓H2SO4、磷酸,用0.04500mol·L-1KMnO4标准溶液滴定至终点(草酸亚铁转化为Fe3+和CO2),消耗KMnO4标准溶液18.00mL。计算样品中FeC2O4·2H2O的纯度_______ (写出计算过程)。
(2)“沉淀”步骤得到的混合体系不宜在空气中久置,其原因是
(3)“转化”在图所示的装置中进行。导管A的作用是
(5)测定草酸亚铁样品纯度的方法如下:准确称取0.2500g样品,加入适量水、浓H2SO4、磷酸,用0.04500mol·L-1KMnO4标准溶液滴定至终点(草酸亚铁转化为Fe3+和CO2),消耗KMnO4标准溶液18.00mL。计算样品中FeC2O4·2H2O的纯度
您最近一年使用:0次
名校
解题方法
6 . 化合价和物质类别是整理元素及化合物知识的两个要素,可表示为“价—类”二维图。铁元素的“价—类”二维图如图所示,下列说法正确的是
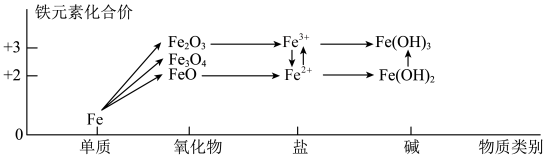
| A.高温条件下Fe和水蒸气反应生成Fe(OH)2和H2,该反应为置换反应 |
| B.FeO在加热的条件下能被氧气氧化成Fe3O4 |
| C.将饱和的FeCl3溶液加热煮沸可制得氢氧化铁胶体 |
| D.Fe(OH)2浊液露置于空气中,由白色立即变为红褐色 |
您最近一年使用:0次
2024-04-26更新
|
99次组卷
|
2卷引用:江西省宜春市丰城中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
7 . 下列铁的化合物中,不能通过化合反应得到的是
| A.FeCl2 | B.Fe(OH)2 | C.Fe3O4 | D.Fe(OH)3 |
您最近一年使用:0次
名校
8 . 某化学课外小组在制备 过程中观察到生成的白色沉淀迅速变为灰绿色,一段时间后变为红褐色。该小组同学对产生灰绿色沉淀的原因进行了实验探究。
过程中观察到生成的白色沉淀迅速变为灰绿色,一段时间后变为红褐色。该小组同学对产生灰绿色沉淀的原因进行了实验探究。
已知:检验溶液中的 可用
可用 溶液,
溶液, 与
与 反应生成蓝色沉淀。
反应生成蓝色沉淀。
Ⅰ.甲同学猜测灰绿色沉淀是 和
和 的混合物,设计并完成了实验1和实验2。
的混合物,设计并完成了实验1和实验2。
(1)实验1中产生红褐色沉淀的化学方程式为___________ 。
(2)实验1中加入维生素C溶液是利用了该物质的___________ 性,实验2中检验 加入的试剂b为
加入的试剂b为___________ 溶液。
(3)实验2的现象说明甲同学的猜测___________ (填“正确”或“不正确”)。
Ⅱ.乙同学查阅资料得知, 沉淀具有较强的吸附性,猜测灰绿色可能是
沉淀具有较强的吸附性,猜测灰绿色可能是 吸附
吸附 引起的,设计并完成了实验3~实验5。
引起的,设计并完成了实验3~实验5。
(4)依据乙同学的猜测,实验4中沉淀无灰绿色的原因为___________ 。
(5)该小组同学依据实验5的实验现象,间接证明了乙同学猜测的正确性,则实验5的实验现象可能为___________ 。
Ⅲ.该小组同学尝试用如图装置制取 。
。 沉淀,在上述装置中加入试剂,塞紧塞子后,应先
沉淀,在上述装置中加入试剂,塞紧塞子后,应先___________ (填“打开”或“关闭”)止水夹K,一段时间后,再___________ (填“打开”或“关闭”)止水夹K,最终可在___________ (填“A”或“B”)中观察到白色沉淀。
 过程中观察到生成的白色沉淀迅速变为灰绿色,一段时间后变为红褐色。该小组同学对产生灰绿色沉淀的原因进行了实验探究。
过程中观察到生成的白色沉淀迅速变为灰绿色,一段时间后变为红褐色。该小组同学对产生灰绿色沉淀的原因进行了实验探究。已知:检验溶液中的
 可用
可用 溶液,
溶液, 与
与 反应生成蓝色沉淀。
反应生成蓝色沉淀。Ⅰ.甲同学猜测灰绿色沉淀是
 和
和 的混合物,设计并完成了实验1和实验2。
的混合物,设计并完成了实验1和实验2。| 编号 | 实验操作 | 实验现象 |
| 实验1 | 向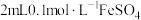 溶液中滴加 溶液中滴加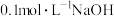 溶液(两溶液中均先加几滴维生素C溶液) 溶液(两溶液中均先加几滴维生素C溶液) | 液面上方出现白色沉淀,一段时间后变为灰绿色,长时间后变为红褐色 |
| 实验2 | 取实验1中少量灰绿色沉淀,洗净后加盐酸溶解,分成两份。①中加入试剂a,②中加入试剂b | ①中出现蓝色沉淀,②中溶液未变成红色 |
(1)实验1中产生红褐色沉淀的化学方程式为
(2)实验1中加入维生素C溶液是利用了该物质的
 加入的试剂b为
加入的试剂b为(3)实验2的现象说明甲同学的猜测
Ⅱ.乙同学查阅资料得知,
 沉淀具有较强的吸附性,猜测灰绿色可能是
沉淀具有较强的吸附性,猜测灰绿色可能是 吸附
吸附 引起的,设计并完成了实验3~实验5。
引起的,设计并完成了实验3~实验5。| 编号 | 实验操作 | 实验现象 |
| 实验3 | 向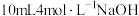 溶液中逐滴加入 溶液中逐滴加入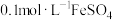 溶液(两溶液中均先加几滴维生素 溶液(两溶液中均先加几滴维生素 溶液) 溶液) | 液面上方产生白色沉淀(带有较多灰绿色)。沉淀下沉后,部分灰绿色沉淀变为白色 |
| 实验4 | 向 溶液中逐滴加入 溶液中逐滴加入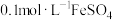 溶液(两溶液中均先加几滴维生素 溶液(两溶液中均先加几滴维生素 溶液) 溶液) | 液面上方产生白色沉淀(无灰绿色)。沉淀下沉后,仍为白色 |
| 实验5 | 取实验4中白色沉淀,洗净后放在潮湿的空气中 |
(4)依据乙同学的猜测,实验4中沉淀无灰绿色的原因为
(5)该小组同学依据实验5的实验现象,间接证明了乙同学猜测的正确性,则实验5的实验现象可能为
Ⅲ.该小组同学尝试用如图装置制取
 。
。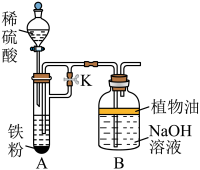
 沉淀,在上述装置中加入试剂,塞紧塞子后,应先
沉淀,在上述装置中加入试剂,塞紧塞子后,应先
您最近一年使用:0次
2024-02-07更新
|
44次组卷
|
2卷引用:河南省郑州市宇华实验学校2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
9 . 碳酸亚铁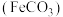 难溶于水,常用于制取铁或补血剂。一种
难溶于水,常用于制取铁或补血剂。一种 的制备装置如下图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得
的制备装置如下图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得 沉淀。
沉淀。
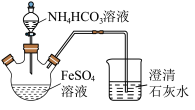
(1)恰好完全反应后,检验三颈烧瓶内溶液中阳离子的方法是___________ 。
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是___________ 。
(3) 在潮湿的空气中先转化为
在潮湿的空气中先转化为 ,最终变为
,最终变为 ,并进一步转化为
,并进一步转化为 。写出
。写出 在潮湿的空气中转化为
在潮湿的空气中转化为 的化学方程式:
的化学方程式:___________ 。
(4)某 固体被部分氧化,为测定其中
固体被部分氧化,为测定其中 的质量分数,现进行如下实验:称取
的质量分数,现进行如下实验:称取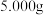 固体样品,加足量盐酸充分溶解,将溶液稀释至
固体样品,加足量盐酸充分溶解,将溶液稀释至 。量取
。量取 该溶液,加入
该溶液,加入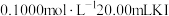 溶液,两者正好完全反应。已知实验过程中发生反应如下:
溶液,两者正好完全反应。已知实验过程中发生反应如下: 。计算
。计算 固体样品中
固体样品中 的质量分数,写出计算过程
的质量分数,写出计算过程___________ 。
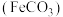 难溶于水,常用于制取铁或补血剂。一种
难溶于水,常用于制取铁或补血剂。一种 的制备装置如下图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得
的制备装置如下图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得 沉淀。
沉淀。
(1)恰好完全反应后,检验三颈烧瓶内溶液中阳离子的方法是
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是
(3)
 在潮湿的空气中先转化为
在潮湿的空气中先转化为 ,最终变为
,最终变为 ,并进一步转化为
,并进一步转化为 。写出
。写出 在潮湿的空气中转化为
在潮湿的空气中转化为 的化学方程式:
的化学方程式:(4)某
 固体被部分氧化,为测定其中
固体被部分氧化,为测定其中 的质量分数,现进行如下实验:称取
的质量分数,现进行如下实验:称取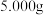 固体样品,加足量盐酸充分溶解,将溶液稀释至
固体样品,加足量盐酸充分溶解,将溶液稀释至 。量取
。量取 该溶液,加入
该溶液,加入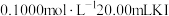 溶液,两者正好完全反应。已知实验过程中发生反应如下:
溶液,两者正好完全反应。已知实验过程中发生反应如下: 。计算
。计算 固体样品中
固体样品中 的质量分数,写出计算过程
的质量分数,写出计算过程
您最近一年使用:0次
名校
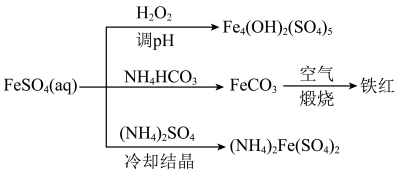
10 . 硫酸亚铁(FeSO4)是中学化学常用试剂,可用于治疗缺铁性贫血症。
(1)实验室配备FeSO4溶液时为防止硫酸亚铁变质,常采用的措施是___________ (填一种)。
(2)以FeSO4为原料可制备碱式硫酸铁[Fe4(OH)2(SO4)5]、铁红、硫酸亚铁铵[(NH4)2Fe(SO4)2,俗名摩尔盐],转化关系如图所示。___________ 。
②制备FeCO3时,向FeSO4溶液中加入过量的NH4HCO3溶液,有气体生成,该反应的离子方程式为___________ 。
③制备摩尔盐时将反应物混合,经___________ 、冷却结晶、过滤、洗涤、干燥得到产品。
用工业废渣(主要含有Fe2O3、FeO、Al2O3及少量Fe)制备绿矾FeSO4·7H2O晶体的流程如下:___________ 。
(4)“溶解”后所得溶液中含有的阳离子为Fe3+和___________ 。
(5)“还原”时选择FeS2而不用Cu粉的原因是___________ 。
(6)测定绿矾中Fe2+的氧化率实验方案如下:
步骤一:称取一定质量的绿矾样品,将其溶于适量的无氧蒸馏水并配成250mL溶液;
步骤二:取步骤一中配得的溶液25.00mL于锥形瓶,并加入适量稀硫酸酸化,逐滴滴加0.0400mol/LKMnO4溶液至恰好完全反应,反应原理为:MnO +Fe2++H+=Mn2++Fe3++H2O(未配平),消耗KMnO4溶液20.00mL;
+Fe2++H+=Mn2++Fe3++H2O(未配平),消耗KMnO4溶液20.00mL;
步骤三:另取步骤一中配得的溶液25.00mL于烧杯,加入足量氨水,将沉淀过滤、洗涤、干燥,在空气中灼烧至固体质量不再变化,称得残留红棕色固体的质量为0.4g。(已知: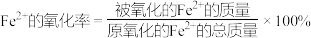 )
)
根据以上数据,计算该绿矾样品中Fe2+的氧化率,写出计算过程:___________ 。
(1)实验室配备FeSO4溶液时为防止硫酸亚铁变质,常采用的措施是
(2)以FeSO4为原料可制备碱式硫酸铁[Fe4(OH)2(SO4)5]、铁红、硫酸亚铁铵[(NH4)2Fe(SO4)2,俗名摩尔盐],转化关系如图所示。
②制备FeCO3时,向FeSO4溶液中加入过量的NH4HCO3溶液,有气体生成,该反应的离子方程式为
③制备摩尔盐时将反应物混合,经
用工业废渣(主要含有Fe2O3、FeO、Al2O3及少量Fe)制备绿矾FeSO4·7H2O晶体的流程如下:

(4)“溶解”后所得溶液中含有的阳离子为Fe3+和
(5)“还原”时选择FeS2而不用Cu粉的原因是
(6)测定绿矾中Fe2+的氧化率实验方案如下:
步骤一:称取一定质量的绿矾样品,将其溶于适量的无氧蒸馏水并配成250mL溶液;
步骤二:取步骤一中配得的溶液25.00mL于锥形瓶,并加入适量稀硫酸酸化,逐滴滴加0.0400mol/LKMnO4溶液至恰好完全反应,反应原理为:MnO
 +Fe2++H+=Mn2++Fe3++H2O(未配平),消耗KMnO4溶液20.00mL;
+Fe2++H+=Mn2++Fe3++H2O(未配平),消耗KMnO4溶液20.00mL;步骤三:另取步骤一中配得的溶液25.00mL于烧杯,加入足量氨水,将沉淀过滤、洗涤、干燥,在空气中灼烧至固体质量不再变化,称得残留红棕色固体的质量为0.4g。(已知:
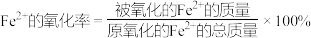 )
)根据以上数据,计算该绿矾样品中Fe2+的氧化率,写出计算过程:
您最近一年使用:0次



