1 . 下列有关反应的化学方程式或离子反应方程式书写正确的是
| A.FeCl3腐蚀覆铜板的离子方程式为:2Fe3++3Cu=2Fe+3Cu2+ |
B.Al与NaOH溶液反应的离子方程式为:Al+2OH-=AlO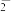 +H2↑ +H2↑ |
| C.Fe(OH)2沉淀与水溶液中的O2反应的化学方程式为:2Fe(OH)2+O2+H2O=2Fe(OH)3 |
| D.FeCl2与Cl2反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl- |
您最近一年使用:0次
21-22高一上·全国·课后作业
解题方法
2 .
化学式 | Fe(OH)2 | Fe(OH)3 |
颜色状态 | 白色固体 | 红褐色固体 |
与盐酸反应 | Fe(OH)2+2H+=Fe2++2H2O | Fe(OH)3+3H+=Fe3++3H2O |
受热分解 | - | |
制备 | 可溶性亚铁盐与碱溶液反应: | 可溶性铁盐与碱溶液反应: |
二者的关系 | 在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成 | |
您最近一年使用:0次
3 . 含有下列离子的五种溶液①Ag+ ②Mg2+ ③Fe2+ ④Al3+ ⑤Fe3+试回答下列问题:
(1)既能被氧化又能被还原的离子是____________ (填离子符号,下同)
(2)向③中加入NaOH溶液并在空气中放置,现象是______ 有关化学方程式为__
(3)加入过量Na2O2溶液无沉淀的是_____________
(4)加铁粉溶液质量增重的是_________ ,溶液质量减轻的___________
(5)遇KSCN溶液呈红色的是_________________________
(6)能用来鉴别Cl–存在的离子是___________
(1)既能被氧化又能被还原的离子是
(2)向③中加入NaOH溶液并在空气中放置,现象是
(3)加入过量Na2O2溶液无沉淀的是
(4)加铁粉溶液质量增重的是
(5)遇KSCN溶液呈红色的是
(6)能用来鉴别Cl–存在的离子是
您最近一年使用:0次
名校
解题方法
4 . 用油造气的废镍催化剂(含NiCO3、Na2SiO3、少量Fe2+、Fe3+及Cr3+的化合物)制取NiSO4•7H2O的工艺流程如图所示(CTAC一种硅酸胶体凝聚剂)。回答下列问题:
(1)“浸取”时,在硫酸浓度和用量、溶解时温度、搅拌速率均一定时,提高镍的回收率还可采取的措施是___ (写出一条)。
(2)“滤渣1”的主要成分是__ 。
(3)“一次碱析”时,Cr(OH)3转化为的CrO 的离子方程式为
的离子方程式为___ 。
(4)加氨水“溶解”的目的是__ ,‘滤渣2”的主要成分是__ 。
(5)“氧化”时,HNO3被还原为NO,该反应的化学方程式为__ 。

(1)“浸取”时,在硫酸浓度和用量、溶解时温度、搅拌速率均一定时,提高镍的回收率还可采取的措施是
(2)“滤渣1”的主要成分是
(3)“一次碱析”时,Cr(OH)3转化为的CrO
 的离子方程式为
的离子方程式为(4)加氨水“溶解”的目的是
(5)“氧化”时,HNO3被还原为NO,该反应的化学方程式为
您最近一年使用:0次
名校
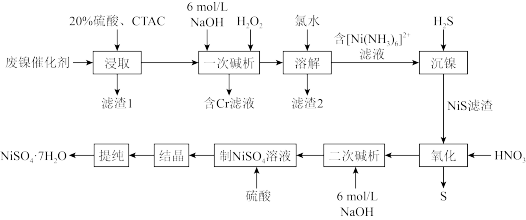
5 . 某工厂的工业废水中含有大量的FeSO4和较多的Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属铜。请根据以下流程图,回答下列问题。
①___________ ;②___________ ;③___________ ;④___________ ;
⑤___________ ;⑥___________ ;⑦___________ ;⑧___________ ;
(2)鉴别溶液④中的金属阳离子时,应滴加的试剂依次是___________ ,现象依次是___________ ;请写出该鉴别过程中属于氧化还原反应的离子方程式:___________ 。
(3)若取2mL溶液④加入试管中,然后滴加氢氧化钠溶液,产生的现象是___________ ;此过程涉及反应的化学方程式是___________ 。
①
⑤
(2)鉴别溶液④中的金属阳离子时,应滴加的试剂依次是
(3)若取2mL溶液④加入试管中,然后滴加氢氧化钠溶液,产生的现象是
您最近一年使用:0次
2021-12-01更新
|
1204次组卷
|
3卷引用:人教2019版必修第一册第三章 铁 金属材料复习与提高
名校
6 . Ⅰ.“金属钙线”是炼制优质钢材的脱氧脱磷剂,某“金属钙线”的主要成分为金属M和金属钙Ca,并含有3.5%(质量分数)CaO。
(1)Ca元素原子结构示意图_______ ,Ca(OH)2碱性比Mg(OH)2_______ (填“强”或“弱”)。
(2)配平用“金属钙线”脱氧脱磷的方程式:_______ 。
_______P+_______FeO+_______CaO _______Ca3(PO4)2+_______Fe
_______Ca3(PO4)2+_______Fe
(3)将“金属钙线”试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色的M(OH)n,该颜色变化过程的化学方程式为:_______ ,实验室检测Mn+最常用的试剂是_______ (填化学式)
Ⅱ.氢化钙(CaH2)固体登山运动员常用的能源提供剂
(4)已知CaH2+2H2O=Ca(OH)2+2H2↑,该反应的氧化剂是_______ 。
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是_______ 。
(1)Ca元素原子结构示意图
(2)配平用“金属钙线”脱氧脱磷的方程式:
_______P+_______FeO+_______CaO
 _______Ca3(PO4)2+_______Fe
_______Ca3(PO4)2+_______Fe(3)将“金属钙线”试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色的M(OH)n,该颜色变化过程的化学方程式为:
Ⅱ.氢化钙(CaH2)固体登山运动员常用的能源提供剂
(4)已知CaH2+2H2O=Ca(OH)2+2H2↑,该反应的氧化剂是
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是
您最近一年使用:0次
名校
7 . 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是
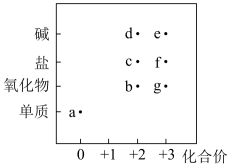

| A.向c溶液中滴加KSCN溶液,可证明c溶液是否变质 |
B.固体g溶于氢碘酸的离子方程式为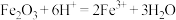 |
| C.通过化合反应或复分解反应均能直接得到e |
| D.可存在c→d→e→f→c的循环转化关系 |
您最近一年使用:0次
2021-11-26更新
|
687次组卷
|
5卷引用:山西省运城市2021-2022学年高一上学期11月期中检测化学试题
8 . A~H分别表示中学化学中常见的某种物质,它们之间的相互转化关系如图所示(部分反应物、生成物未列出)。已知:C、D、E、F、G五种物质中均含有同一种元素;A为淡黄色固体化合物;G为红褐色固体。

(1)请写出C的化学式___________ 。
(2)在D溶液中滴加H溶液,描述发生的现象:___________ 。
(3)写出①的化学方程式___________ 。写出⑥的化学方程式___________ 。

(1)请写出C的化学式
(2)在D溶液中滴加H溶液,描述发生的现象:
(3)写出①的化学方程式
您最近一年使用:0次
2021-11-17更新
|
330次组卷
|
2卷引用:浙江“七彩阳光”新高考研究联盟2021-2022学年高一上学期期中联考化学试题
名校
9 . 下列有关铁、铁矿石与铁的氧化物的说法正确的是
| A.赤铁矿的主要成分是Fe2O3,磁铁矿的主要成分是Fe3O4,Fe2O3俗称铁红 |
| B.在自然界中,不可能有游离态的铁存在 |
| C.能通过化合反应制得Fe(OH)3,但不能通过化合反应制得FeCl2 |
| D.铁的氧化物能与酸反应生成盐和水,因此Fe3O4、Fe2O3、FeO都是碱性氧化物 |
您最近一年使用:0次
2021-11-15更新
|
797次组卷
|
3卷引用:浙江省宁波市三锋教研联盟2021-2022学年高一上学期11月期中考试化学试题
浙江省宁波市三锋教研联盟2021-2022学年高一上学期11月期中考试化学试题甘肃省天水市第一中学2021-2022高一上学期第二次考试化学试题(已下线)【知识图鉴】单元讲练测必修第一册第三单元02基础练
名校
10 . 下列说法中不正确的是
| A.赤铁矿的主要成分与铁锈的主要成分相同 |
| B.Fe3O4可由单质直接化合而得到 |
| C.FeCl3、Fe(OH)3都可通过化合反应生成 |
| D.某溶液中滴加氯水,然后滴加KSCN溶液,溶液显红色,该溶液中一定含有Fe2+ |
您最近一年使用:0次
2021-11-11更新
|
86次组卷
|
2卷引用:吉林省长春市第二实验中学2021-2022学年高一上学期期中考试化学试题



