名校
解题方法
1 . 某固体混合物X可能含有Cu、Fe、Fe2O3、Ca(OH)2和Na2CO3中的几种。为确定其组成,某同学进行了如下实验:

| A.固体混合物X中一定含Ca(OH)2和Na2CO3 |
| B.固体混合物X中若含Cu,则一定还含Fe2O3 |
| C.气体B一定是纯净物 |
| D.溶液B中一定含2种金属阳离子 |
您最近一年使用:0次
2021-06-12更新
|
845次组卷
|
16卷引用:浙江省2020年7月普通高中学业水平考试化学试题
浙江省2020年7月普通高中学业水平考试化学试题浙江省上海外国语大学附属宏达高级中学2020-2021学年高二10月月考化学试题(已下线)【浙江新东方】绍兴qw97(已下线)【浙江新东方】绍兴qw68(已下线)【浙江新东方】在线化学 (20)安徽省滁州市定远县育才学校2020-2021学年高一下学期开学考试化学试题重庆市第二十九中学2020-2021学年高一上学期12月月考化学试题浙江省湖州市吴兴高级中学2020-2021学年高一上学期12月月考化学试题(已下线)【浙江新东方】在线化学37(已下线)【浙江新东方】双师78浙江省杭州市富阳区场口中学2020-2021学年高一下学期3月教学质量检测化学试题(已下线)【浙江新东方】双师304高一下浙江省吴兴高级中学2021-2022学年高一上学期12月月考化学试题(已下线)高中化学-高一下-15浙江省湖州市吴兴高级中学2023-2024学年高一上学期12月月考化学试题江苏省扬州中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
2 . 往装有 的烧杯中加入过量稀硫酸,充分反应后,仍有红色粉末剩余,则关于反应后溶液中金属阳离子的判断一定正确的是
的烧杯中加入过量稀硫酸,充分反应后,仍有红色粉末剩余,则关于反应后溶液中金属阳离子的判断一定正确的是
 的烧杯中加入过量稀硫酸,充分反应后,仍有红色粉末剩余,则关于反应后溶液中金属阳离子的判断一定正确的是
的烧杯中加入过量稀硫酸,充分反应后,仍有红色粉末剩余,则关于反应后溶液中金属阳离子的判断一定正确的是| A.只有Fe2+和Fe3+ | B.只有Fe2+ |
| C.一定有Fe2+、Cu2+,可能有Fe3+ | D.一定有Fe2+,可能有Cu2+ |
您最近一年使用:0次
2020-02-27更新
|
995次组卷
|
14卷引用:安徽省亳州市涡阳县育萃高级中学2019-2020学年高二下学期摸底考试化学试题
安徽省亳州市涡阳县育萃高级中学2019-2020学年高二下学期摸底考试化学试题浙江省东阳中学2018-2019学年高一上学期12月月考化学试题【校级联考】浙江省宁波市九校2017-2018学年高一第一学期期末联考化学试题【全国百强校】浙江省萧山中学2018-2019学年高一下学期2月份摸底考试化学试题(已下线)【新东方】2020-93(已下线)【新东方】2020-94(已下线)【南昌新东方】2019 南昌十中 高一下 第一次月考浙江省台州市书生中学2019-2020学年高一上学期第三次月考化学试题(已下线)【浙江新东方】在线化学 (18)重庆市第二十九中学2020-2021学年高一上学期12月月考化学试题浙江省杭州高级中学2020-2021学年高一上学期12月阶段测试化学试题浙江省舟山市2020-2021学年高一上学期期末考试化学试题甘肃省嘉峪关市第一中学2021届高三上学期二模考试化学试题辽宁省辽河油田第一高级中学2020-2021学年高一上学期期末考试化学试题(A部)
解题方法
3 . 我国古代许多著作在化学学科知识上都体现出了一定水平的认识。其中《管子•地数》中有记载:“上有丹沙者,下有黄金;上有慈石者,下有铜金。”
Ⅰ.“丹沙者丹砂也”,丹砂是古代炼丹的重要原料,也是实验室处理水银洒落后的产物。你认为丹砂主要成分是_____ ;(填化学式)“慈石者磁石也”,请写出磁石溶于盐酸的离子方程式:_____ ;
Ⅱ.“铜金者,斑岩铜矿也。”
安徽宣城茶亭铜金矿床是长江中下游成矿带中新发现的一个大型斑岩型矿床。斑岩铜矿中Cu主要以铜﹣铁硫化物(主要为CuFeS2)的形式存在。以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4•7H2O)。其主要流程如图:
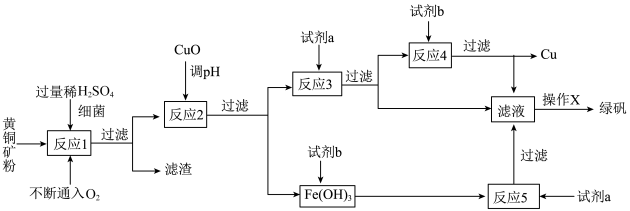
已知:①“反应1”:4CuFeS2 +2H2SO4 +17O2 ═4CuSO4 +2Fe2(SO4)3 +2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表:
(1)“反应1”中,每生成1 mol CuSO4转移电子数为_____ NA;
(2)“试剂a”是_____ ,“试剂b”是_____ ;
(3)“反应2”中加CuO调pH为3.7~4.7的目的是_____ ;
(4)“操作X”应为_____ 、_____ 、过滤、洗涤;请简述上述“操作X”中如何对所得 FeSO4•7H2O晶体进行洗涤_____ ;
(5)简述如何判断“反应5”已进行完全:_____ 。
Ⅰ.“丹沙者丹砂也”,丹砂是古代炼丹的重要原料,也是实验室处理水银洒落后的产物。你认为丹砂主要成分是
Ⅱ.“铜金者,斑岩铜矿也。”
安徽宣城茶亭铜金矿床是长江中下游成矿带中新发现的一个大型斑岩型矿床。斑岩铜矿中Cu主要以铜﹣铁硫化物(主要为CuFeS2)的形式存在。以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4•7H2O)。其主要流程如图:

已知:①“反应1”:4CuFeS2 +2H2SO4 +17O2 ═4CuSO4 +2Fe2(SO4)3 +2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表:
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
(2)“试剂a”是
(3)“反应2”中加CuO调pH为3.7~4.7的目的是
(4)“操作X”应为
(5)简述如何判断“反应5”已进行完全:
您最近一年使用:0次
名校
4 . 18.4g由铁、铜组成的混合粉末加入100mL5.0mol•L﹣1FeCl3溶液中,充分反应后,剩余固体质量为3.2g。下列说法正确的是( )
| A.原固体混合物中:n(Cu):n(Fe)=2:1 |
| B.反应后溶液中的溶质有FeCl2、FeCl3、CuCl2 |
| C.反应后溶液中:n(Fe2+)+n(Cu2+)=0.8mol |
| D.剩余固体是铁 |
您最近一年使用:0次
2019-12-14更新
|
341次组卷
|
2卷引用:安徽省滁州市九校2019-2020学年高一上学期期末联考化学试题
5 . 铁和铜是重要的过度元素,在工农业生产中有重要的作用。回答下列问题:
(1)铁元素在周期表中的位置__________________________ :
(2)将铁粉、铜粉、FeCl3、FeCl2和CuCl2溶液混合于某容器中充分反应后。
试判断下列情况下,溶液中存在的金属离子和金属单质。
①若铁粉有剩余,则容器中不可能有:____________ ;
②若容器内还含有大量的Fe3+,则容器中会有:_______________ ;
③若容器内还有较多的Cu2+和相当量的Cu,则容器内不可能有_______________ 。
(3)某溶液中含有Fe3+、Br—,如何验证含有Fe2+________________________________ ?限定使用的试剂有:KSCN溶液、AgNO3溶液、新制的氯水、稀硝酸、NaOH溶液、酸性KMnO4溶液、双氧水。
(4)铜的冶炼方法之一:蓝铜矿(主要成分是2CuCO3·Cu(OH)2)它与焦炭一起加热时,可以生成铜、CO2、和水,写出该反应的化学方程式:________________________ 。
(1)铁元素在周期表中的位置
(2)将铁粉、铜粉、FeCl3、FeCl2和CuCl2溶液混合于某容器中充分反应后。
试判断下列情况下,溶液中存在的金属离子和金属单质。
①若铁粉有剩余,则容器中不可能有:
②若容器内还含有大量的Fe3+,则容器中会有:
③若容器内还有较多的Cu2+和相当量的Cu,则容器内不可能有
(3)某溶液中含有Fe3+、Br—,如何验证含有Fe2+
(4)铜的冶炼方法之一:蓝铜矿(主要成分是2CuCO3·Cu(OH)2)它与焦炭一起加热时,可以生成铜、CO2、和水,写出该反应的化学方程式:
您最近一年使用:0次
14-15高一上·江苏宿迁·阶段练习
名校
6 . 某工厂用 FeCl3 溶液腐蚀镀有铜的绝缘板生产印刷电路。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL 废液加入足量的 AgNO3 溶液,生成沉淀 8.61g。(2)另取 10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液组成的判断错误的是
| A.一定含有 Fe 2+、 Fe 3+、 Cu2+、 Clˉ | B.c(Fe2+):c(Cu2+) = 2:1 |
| C.c(Clˉ) = 6mol / L, c(Fe 2+) = 1.2mol / L | D.c (Fe2+):c(Fe 3+) = 3:1 |
您最近一年使用:0次
2017-02-24更新
|
1167次组卷
|
9卷引用:安徽省肥东县高级中学2021届高三上学期第二次月考化学试题
安徽省肥东县高级中学2021届高三上学期第二次月考化学试题(已下线)2013-2014学年江苏省宿迁市高一上学期第二次月考化学试卷2015-2016学年辽宁省锦州中学高一上学期12月月考化学试卷2015-2016学年江苏省无锡市高一上学期期末化学试卷2017届浙江省“七彩阳光”新高考研究联盟高三下学期期初联考化学试卷黑龙江省哈尔滨市第六中学2020-2021学年高一12月月考化学试题江西省上高二中2020-2021学年高一上学期第三次月考化学试题江西省宜春市万载中学2021-2022学年高一上学期第三次月考化学试题陕西省西安市雁塔区第二中学2023-2024学年高一上学期第二次阶段性测评化学试题
14-15高一上·浙江宁波·期末
名校
解题方法
7 . 向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉充分反应后,得到的固体经过滤、干燥、称重,若所得固体的质量与加入的铁粉的质量相等,则原溶液中c(SO42-)与c(Cl-)之比为
| A.3︰14 | B.1︰7 | C.2︰7 | D.3︰2 |
您最近一年使用:0次
2016-12-09更新
|
528次组卷
|
6卷引用:安徽省安庆一中2018-2019学年高一上学期期末考试化学试题



