名校
解题方法
1 . 碘化钠在光学器件石油探测、安检、环境监测等领域有重要应用。某研究小组开发设计的制备高纯NaI的简化流程如图:
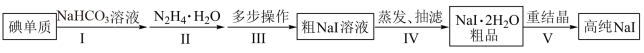
已知:
①I2(s)+I-(aq) I
I (aq)。
(aq)。
②水合肼(N2H4•H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO 离子。
离子。
①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为__ 。
②实验过程中,加少量NaI固体能使反应速率加快,其原因是__ 。
(2)步骤Ⅱ,水合肼与IO-反应的离子方程式为__ 。
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。
上述①②③操作中,调整pH值时依次加入的试剂为__ 。
A.NaOH B.HI C.NH3•H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有__ 。
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为__ 。
(5)将制备的NaI•2H2O粗品以95%乙醇为溶剂进行重结晶。请给出合理的操作排序__ 。
加热95%乙醇→____→___→___→____→纯品(选填序号)。
①减压蒸发结晶 ②NaI•2H2O粗品溶解 ③趁热过滤 ④真空干燥
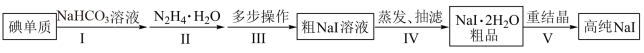
已知:
①I2(s)+I-(aq)
 I
I (aq)。
(aq)。②水合肼(N2H4•H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO
 离子。
离子。①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为
②实验过程中,加少量NaI固体能使反应速率加快,其原因是
(2)步骤Ⅱ,水合肼与IO-反应的离子方程式为
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。
上述①②③操作中,调整pH值时依次加入的试剂为
A.NaOH B.HI C.NH3•H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为
(5)将制备的NaI•2H2O粗品以95%乙醇为溶剂进行重结晶。请给出合理的操作排序
加热95%乙醇→____→___→___→____→纯品(选填序号)。
①减压蒸发结晶 ②NaI•2H2O粗品溶解 ③趁热过滤 ④真空干燥
您最近一年使用:0次
2020-07-10更新
|
307次组卷
|
4卷引用:江西省南昌市第二中学2020届高三下学期校测(一)理科综合化学试题
解题方法
2 . 下列有关物质性质的应用正确的是
| A.钠具有很强的还原性,可用钠与TiCl4溶液反应制取钛 |
| B.铝表面易形成致密的氧化膜,可用铝制贮罐盛装稀硝酸 |
| C.FeCl3具有很强的氧化性,可用于包括铜、不锈钢、铝等材料的蚀刻 |
| D.硫酸铜能与氯化钡反应,可用于给误食氯化钡的患者洗胃 |
您最近一年使用:0次
名校
3 . 某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式______________________________________ ;
(2)在实验室中,还可以用浓氨水与____________ (填写一种试剂)快速制取少量氨气;
(二)该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:
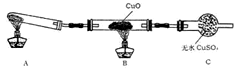
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是____ 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式:_________________________
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O_______________________________________________ 。
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 gCu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却后称量,A的质量为72g。据此可推得,A的化学式为____________ 。由此,得到的结论是:________________________________ 。
(一)制取氨气
(1)写出实验制取氨气的化学方程式
(2)在实验室中,还可以用浓氨水与
(二)该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:

(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式:
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+
 Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 gCu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却后称量,A的质量为72g。据此可推得,A的化学式为
您最近一年使用:0次
名校
4 . 中国传统文化对人类文明贡献巨大,很早就把化学技术应用到生产生活中。下列与化学有关的说法不正确 的是
| A.《天工开物》中“至于矾现五金色之形硫为群石之将,皆变化于烈火”,其中矾指金属硫酸盐 |
B.《神农本草经》中捉到:“白青[ ]得铁化为铜”,其中白青属于碱 ]得铁化为铜”,其中白青属于碱 |
| C.《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳极”这是利用了“KNO3的氧化性” |
| D.《本草经集注》中记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,烟起,乃真硝石也”,二者也可以利用“焰色试验”区分 |
您最近一年使用:0次
2021-11-20更新
|
498次组卷
|
3卷引用:江西省丰城中学 2021-2022 学年高三上学期第四次段考化学试题(尖子重点班)
江西省丰城中学 2021-2022 学年高三上学期第四次段考化学试题(尖子重点班)广东省广州市第六中学2021-2022学年高一上学期期中化学试题(已下线)3.2.2 硫酸 不同价态硫元素间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)
名校
解题方法
5 . 以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的分析不合理的是( )
| A.《本草纲目》中有如下记载:“火药乃焰硝(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”,其中利用了KNO3的氧化性 |
| B.商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品 |
| C.宋代《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜,该颜料耐酸耐碱 |
| D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作 |
您最近一年使用:0次
名校
6 . 已知:①甲醛(HCHO)与葡萄糖化学性质相似,都具有还原性。②甲醛易挥发,甲酸钙易溶于水。为探究过量的甲醛和新制Cu(OH)2反应的产物,进行如下实验:
(1)在下图装置中进行实验,向a中加入0.5mol·L-1CuSO4溶液50mL和5mol·L-1NaOH 溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热20分钟后冷却至室温。

仪器a、b的名称分别是________________ 、_______________ 。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分,将装置A 和如下图所示装置连接后进行实验。
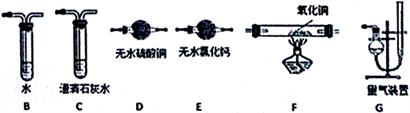
依次连接的合理顺序为A→____ →____→____→____→____→G。副产物中如果有CO,实验现象是:_____________________________________ 。
(3)已知HCHO 最终被氧化为CO32-,请写出a容器中发生的反应化学方程式:_________________________________________ 。
(4)反应后a中有红色固体产生,为探究其组成,提出如下假设:
假设一:只有Cu2O 假设二:只有Cu
假设三:CuO和Cu 假设四:_______________ ;
其中假设三明显不成立,理由是___________________________________ 。
(5)为了对(4)的猜想进行验证,进行如下实验(以下任步均充分反应):
已知:已知:Cu2O [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) [Cu(NH3)4]2+ (蓝色)
[Cu(NH3)4]2+ (蓝色)
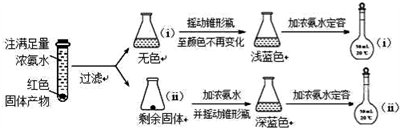
①锥形瓶ii中固体加入浓氨水后,完全溶解得到深蓝色溶液,该过程所发生的离子方程式为__________________________________________ ;
②将容量瓶ii中的溶液稀释20倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为_________________________________ 。
(1)在下图装置中进行实验,向a中加入0.5mol·L-1CuSO4溶液50mL和5mol·L-1NaOH 溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热20分钟后冷却至室温。

仪器a、b的名称分别是
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分,将装置A 和如下图所示装置连接后进行实验。

依次连接的合理顺序为A→
(3)已知HCHO 最终被氧化为CO32-,请写出a容器中发生的反应化学方程式:
(4)反应后a中有红色固体产生,为探究其组成,提出如下假设:
假设一:只有Cu2O 假设二:只有Cu
假设三:CuO和Cu 假设四:
其中假设三明显不成立,理由是
(5)为了对(4)的猜想进行验证,进行如下实验(以下任步均充分反应):
已知:已知:Cu2O
 [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) [Cu(NH3)4]2+ (蓝色)
[Cu(NH3)4]2+ (蓝色) 
①锥形瓶ii中固体加入浓氨水后,完全溶解得到深蓝色溶液,该过程所发生的离子方程式为
②将容量瓶ii中的溶液稀释20倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为
您最近一年使用:0次
名校
7 . 下列现象或事实、解释都正确的是
| 选项 | 现象或事实 | 解释 |
| A | 金属镁着火不能用泡沫灭火器灭火 | 燃烧生成的MgO与CO2反应 |
| B | K2FeO4用于自来水的消毒和净化 | K2FeO4具有强氧化性可杀菌消毒,其还原产物Fe3+水解得到的胶状物能净水 |
| C | 古代青铜器表面有铜锈,可放入盐酸中浸泡除锈 | 铜锈是铜在空气中缓慢氧化生成的氧化物,可溶于盐酸 |
| D | 常温下,将铁片浸入足量的浓硫酸中,铁片不溶解 | 常温下,铁与浓硫酸一定没有发生化学反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-11-13更新
|
531次组卷
|
11卷引用:江西省兴国三中2021届高三上学期第一次月考化学试题
江西省兴国三中2021届高三上学期第一次月考化学试题山东省聊城市冠县2020届高三10月月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——盐类水解的基础考查河北省唐山市第十一中学2021届高三9月入学检测化学试题内蒙古赤峰市宁城县2021届高三9月摸底考试化学试题四川省内江市第六中学2021届高三上学期10月月考化学试题安徽省泗县第一中学2022届高三上学期开学考试化学试题安徽省亳州市第五完全中学2021-2022学年高三上学期期中考试化学试题安徽省六安中学2021-2022学年高三上学期第三次月考化学试题广东省广州市第一中学2021-2022学年高三下学期2月教学质量监测化学试题陕西省延安市吴起高级中学2019-2020学年高二下学期第四次质量检测(期末)化学试题
名校
8 . 以下是利用主要成分为Cu2S和Fe2O3的工业废弃固体(其他成分不参与反应)制备有关物质,实验流程如图所示:
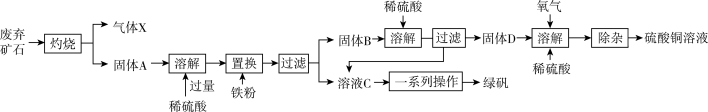
回答下列问题:
(1)气体X的化学式为____ 。
(2)加入铁粉时发生反应的离子方程式为:2H++Fe=Fe2++H2↑、____ 。
(3)常温下,固体D、O2和稀硫酸混合后几乎不反应,而加少量绿矾后随即发生反应。已知FeSO4对此反应起催化作用,则催化过程中反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O、_____ 。
(4)除杂时需先加合适的氧化剂将Fe2+氧化为Fe3+,再加试剂Y调节溶液pH以除去Fe3+,则氧化剂及试剂Y可以是____ (填编号)。
a.H2O2、CuO b.HNO3、Cu(OH)2 c.KMnO4、CuCl2 d.漂白粉、CuCO3
(5)无水硫酸铜受热分解生成氧化铜和气体,受热温度不同气体可能为SO3、SO2和O2中的一种、两种或三种。现设计如下实验测定产生的SO2、SO3和O2的物质的量,并计算各物质的化学计量数,从而确定CuSO4分解的化学方程式(已知实验结束时,硫酸铜完全分解)。
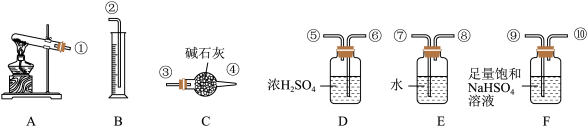
①仪器C的名称是_____ ,仪器F的作用是____ 。
②组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:①→⑨→⑩→⑥→⑤→_____ → → → →②(填接口序号)。
③若某小组称取6.4g无水CuSO4,实验过程中装置C增加的质量为3.84g,量筒中水的体积折算成标准状况下气体体积224mL,请通过计算确定实验条件下CuSO4分解的化学方程式:___ 。

回答下列问题:
(1)气体X的化学式为
(2)加入铁粉时发生反应的离子方程式为:2H++Fe=Fe2++H2↑、
(3)常温下,固体D、O2和稀硫酸混合后几乎不反应,而加少量绿矾后随即发生反应。已知FeSO4对此反应起催化作用,则催化过程中反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O、
(4)除杂时需先加合适的氧化剂将Fe2+氧化为Fe3+,再加试剂Y调节溶液pH以除去Fe3+,则氧化剂及试剂Y可以是
a.H2O2、CuO b.HNO3、Cu(OH)2 c.KMnO4、CuCl2 d.漂白粉、CuCO3
(5)无水硫酸铜受热分解生成氧化铜和气体,受热温度不同气体可能为SO3、SO2和O2中的一种、两种或三种。现设计如下实验测定产生的SO2、SO3和O2的物质的量,并计算各物质的化学计量数,从而确定CuSO4分解的化学方程式(已知实验结束时,硫酸铜完全分解)。

①仪器C的名称是
②组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:①→⑨→⑩→⑥→⑤→
③若某小组称取6.4g无水CuSO4,实验过程中装置C增加的质量为3.84g,量筒中水的体积折算成标准状况下气体体积224mL,请通过计算确定实验条件下CuSO4分解的化学方程式:
您最近一年使用:0次



