1 . 某学习小组设计实验探究CuSO4分解产物
Ⅰ.甲同学选择下列装置设计实验探究硫酸铜分解的气态产物SO3、SO2和O2,并验证SO2的还原性。
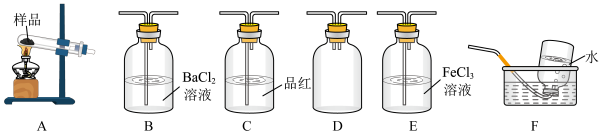
回答下列有关问题
(1)CuSO4水溶液呈酸性,其原因是______________________ (用离子方程式表示)。
(2)上述装置按气流从左至右排序为A、D、___________ E、F(填代号)。
(3)装置D的作用是___________ ;能证明有SO3生成的实验现象是___________ 。
(4)在实验过程中C装置中红色溶液逐渐变为无色溶液,说明A中分解产物有___________ ;待C中有明显现象后,F开始收集气体,F装置中集气瓶收集到了少量气体,该气体是___________ (填化学式)。
(5)为了验证SO2的还原性,取E装置中反应后的溶液于试管中,设计如下实验:
a 滴加少量的NH4SCN溶液 b 滴加少量的K3[Fe(CN)6]溶液
c 滴加酸性KMnO4溶液 d 滴加盐酸酸化的BaCl2溶液
其中,方案合理的有___________ (填代号),写出E装置中可能发生反应的离子方程式:_________ 。
Ⅱ.乙同学利用A中残留固体验证固体产物(假设硫酸铜已完全分解)
查阅资料知,铜有+2、+1价。Cu2O在酸性条件下不稳定,发生反应:Cu2O+2H+=Cu+Cu2++H2O。
(6)为了验证固体产物中是否有Cu2O,设计了下列4种方案,其中能达到实验目的的是___________ 。
甲:取少量残留固体于试管,滴加足量的稀硝酸,观察溶液颜色是否变为蓝色
乙:取少量残留固体于试管,滴加足量的稀硫酸,观察溶液颜色是否变为蓝色
丙:取少量残留固体于试管,滴加足量的稀盐酸,观察是否有红色固体生成
丁:取少量残留固体于试管,通入氢气,加热,观察是否生成红色固体
(7)经检验CuSO4分解生成CuO、Cu2O、SO3、SO2和O2,且CuO、Cu2O的质量之比为5:9,SO2、O2、SO3的体积之比(同温同压下测定)为4:3:2。写出CuSO4分解的化学方程式:_______ 。
Ⅰ.甲同学选择下列装置设计实验探究硫酸铜分解的气态产物SO3、SO2和O2,并验证SO2的还原性。

回答下列有关问题
(1)CuSO4水溶液呈酸性,其原因是
(2)上述装置按气流从左至右排序为A、D、
(3)装置D的作用是
(4)在实验过程中C装置中红色溶液逐渐变为无色溶液,说明A中分解产物有
(5)为了验证SO2的还原性,取E装置中反应后的溶液于试管中,设计如下实验:
a 滴加少量的NH4SCN溶液 b 滴加少量的K3[Fe(CN)6]溶液
c 滴加酸性KMnO4溶液 d 滴加盐酸酸化的BaCl2溶液
其中,方案合理的有
Ⅱ.乙同学利用A中残留固体验证固体产物(假设硫酸铜已完全分解)
查阅资料知,铜有+2、+1价。Cu2O在酸性条件下不稳定,发生反应:Cu2O+2H+=Cu+Cu2++H2O。
(6)为了验证固体产物中是否有Cu2O,设计了下列4种方案,其中能达到实验目的的是
甲:取少量残留固体于试管,滴加足量的稀硝酸,观察溶液颜色是否变为蓝色
乙:取少量残留固体于试管,滴加足量的稀硫酸,观察溶液颜色是否变为蓝色
丙:取少量残留固体于试管,滴加足量的稀盐酸,观察是否有红色固体生成
丁:取少量残留固体于试管,通入氢气,加热,观察是否生成红色固体
(7)经检验CuSO4分解生成CuO、Cu2O、SO3、SO2和O2,且CuO、Cu2O的质量之比为5:9,SO2、O2、SO3的体积之比(同温同压下测定)为4:3:2。写出CuSO4分解的化学方程式:
您最近一年使用:0次
2 . 氯化亚铜(CuCl)广泛应用于有机合成、染料、颜料、催化剂等工业。它是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸,可溶于氨水、浓盐酸,并生成配合物NH4[CuCl2];能在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是实验室制备氯化亚铜的流程图及实验装置图。
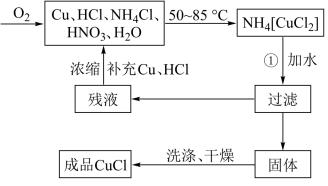
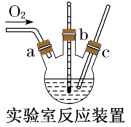
实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
(1)请写出①的化学方程式____________________________________ 。
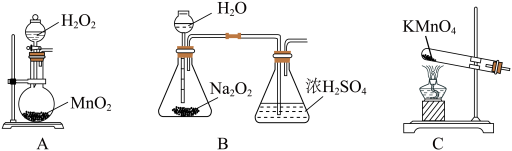
(2)本实验中通入O2的速率不宜过大,宜选择下图中的____ (填字母序号)方案,并说明选择该装置的理由__________________________________________ 。
(3)电炉加热升温至50℃时停止加热,反应快速进行,当烧瓶中液面上方的现象为_____ 时,停止通入氧气,打开瓶塞,沿C口倾出反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出。
(4)关于该实验过程中,下列说法正确的是_________________ 。
A 实验开始时,温度计显示反应液温度可能低于室温。
B 流程中过滤操作,可以采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C 该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D 反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(5)氯化亚铜的定量分析:
①称取成品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2,Fe2+ + Ce4+ = Fe3+ + Ce3+)
④数据处理:计算得CuCl的纯度为__________ 。


实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
(1)请写出①的化学方程式
(2)本实验中通入O2的速率不宜过大,宜选择下图中的

(3)电炉加热升温至50℃时停止加热,反应快速进行,当烧瓶中液面上方的现象为
(4)关于该实验过程中,下列说法正确的是
A 实验开始时,温度计显示反应液温度可能低于室温。
B 流程中过滤操作,可以采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C 该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D 反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(5)氯化亚铜的定量分析:
①称取成品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2,Fe2+ + Ce4+ = Fe3+ + Ce3+)
| 实验序号 | 1 | 2 | 3 |
| 滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
| 滴定终点读数(mL) | 24.70 | 24.95 | 24.85 |
您最近一年使用:0次
2019-08-10更新
|
853次组卷
|
3卷引用:浙江省诸暨中学2018-2019学年高二(实验班)下学期期中考试化学试题
19-20高二·浙江·期末
3 . Ⅰ.为探究硫酸铜晶体(CuSO4·xH2O)变热分解后所得产物,设计实验装置如图所示,部分实验现象为:A中蓝色晶体逐渐变成白色粉末,继续加热最终变成黑色;B中产生白色沉淀;D中溶液变成红色。(洗气瓶中试剂均足量)。
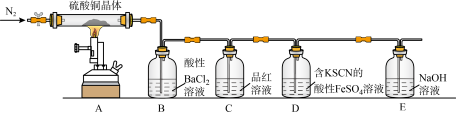
(1)分析推测该硫酸铜晶体最终分解产物可能有___ 。
(2)D中的反应分两步进行,写出第一步反应的离子方程式__ 。
Ⅱ.测定硫酸铜晶体(CuSO4·xH2O)中结晶水x的值,实验装置和过程如图:
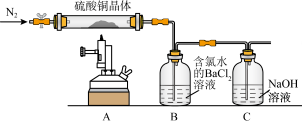
(1)取B中白色沉淀经过滤洗涤干燥称量得固体6.99g,经计算可得CuSO4·xH2O中x=__ ,再次鼓入 的目的是
的目的是__ 。
(2)某同学提出,要测定晶体中结晶水x的值,也可将B装置用装有浓硫酸的洗气瓶替换,最终测浓硫酸增重即可计算得到结果,评价该同学的方案是否可行?(如果不可行,请说明理由)__ 。

(1)分析推测该硫酸铜晶体最终分解产物可能有
(2)D中的反应分两步进行,写出第一步反应的离子方程式
Ⅱ.测定硫酸铜晶体(CuSO4·xH2O)中结晶水x的值,实验装置和过程如图:

(1)取B中白色沉淀经过滤洗涤干燥称量得固体6.99g,经计算可得CuSO4·xH2O中x=
 的目的是
的目的是(2)某同学提出,要测定晶体中结晶水x的值,也可将B装置用装有浓硫酸的洗气瓶替换,最终测浓硫酸增重即可计算得到结果,评价该同学的方案是否可行?(如果不可行,请说明理由)
您最近一年使用:0次
解题方法
4 . 孔雀石的主要成分为Cu2(OH)2CO3,还含少量的FeO、Fe2O3、SiO2。实验室以孔雀石为原料制备CuSO4·5H2O的步骤如下:

为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如表。请回答:
(1)孔雀石首先要粉碎,其目的是_____ ;溶液A中的金属阳离子有_________ ;若调pH=9.0将杂质铁元素除去,其后果是:________________________________ 。
(2) “除杂”时先加入足量H2O2,目的是________________________ ;再加入CuO固体调节溶液pH的范围至_________ ,其中加入CuO作用是____________________ 。
(3)操作X包括_________________________________ 、过滤和洗涤等;在进行该操作时,将溶液B再适当酸化目的是_________________________________________ 。
(4)请设计一种实验方案检验溶液中Fe3+是否完全除去(写出操作步骤、现象和结论)________________ 。

为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如表。请回答:
(1)孔雀石首先要粉碎,其目的是
(2) “除杂”时先加入足量H2O2,目的是
(3)操作X包括
(4)请设计一种实验方案检验溶液中Fe3+是否完全除去(写出操作步骤、现象和结论)
您最近一年使用:0次
解题方法
5 . 某化学兴趣小组发现实验室有多件表面呈灰绿色的金属制品, 经了解其来源并查阅相关资料(如下表),初步确认为铜制品。
针对铜制品表面的灰绿色物质究竟是什么,同学们提出了多种猜想并展开实验探究。
【猜想假设】
(1)小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[ Cu2(OH)2CO3];
除上述猜想外,其他合理的猜想是____________________ (只写一个)。
【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
(2)小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆。 其判断依据是________________________ 。
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧。将表面刮净后的铜制品也投入盐酸中,并无气体产生。由此证明该铜制品不是青铜,理由是__________________ 。
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[ Cu2(OH)2CO3]。于是按图5所示装置进行实验。
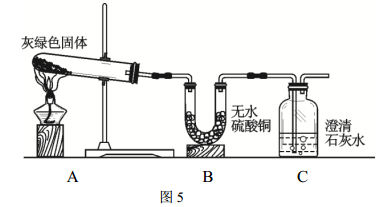
实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了___________ 的现象, C中观察到了_____________ 的现象。B中所发生反应的化学方程式为:__________________ 。
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是______________ 。
【实验拓展】
(5)小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为:___________________________ 。
| 紫铜 | 青铜 | 铜绿 | |
| 主要成分 | 纯铜 | 铜锡合金 | Cu2(OH)2CO3 |
| 性质与用途 | 紫红色, 质软,导电性能良好;主要用作电线电缆。 | 多呈灰绿色, 熔点低、硬度大、 可塑性强;可铸造成各种器具。 | 不溶于水的灰绿色粉末,溶于酸, 加热易分解;可作颜料、杀虫剂。 |
针对铜制品表面的灰绿色物质究竟是什么,同学们提出了多种猜想并展开实验探究。
【猜想假设】
(1)小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[ Cu2(OH)2CO3];
除上述猜想外,其他合理的猜想是
【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
(2)小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆。 其判断依据是
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧。将表面刮净后的铜制品也投入盐酸中,并无气体产生。由此证明该铜制品不是青铜,理由是
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[ Cu2(OH)2CO3]。于是按图5所示装置进行实验。

实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是
【实验拓展】
(5)小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为:
您最近一年使用:0次
6 . 胆矾(CuSO4·5H2O)是铜的重要化合物,有着广泛的应用,如用来配制农药波尔多液。以下是CuSO4·5H2O的实验室制备流程图。

根据题意完成下列填空:
(1)向含有铜粉的稀硫酸中滴加硝酸,在铜粉溶解时最终可以观察到的实验现象:_____________ 、______________ 。
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是_________ (填化学式)。
(3)将CuSO4·5H2O与NaHCO3按一定的比例共同投入到150mL沸水中,剧烈搅拌,冷却后,有绿色晶体析出。该晶体的化学组成为Cux (OH) y (CO3) z·nH2O。实验所得的绿色晶体需充分洗涤,检验是否洗涤干净的方法是_______________ 。
(4)为了确定晶体的化学式,某实验小组进行如下实验:a.称取3.640g晶体,加入足量的稀盐酸使固体完全溶解,收集到标准状况下的气体448.0 mL;b.称取等质量的晶体,灼烧至完全分解,得到2.400g残余固体。通过计算确定晶体的化学式(写出计算过程)。

根据题意完成下列填空:
(1)向含有铜粉的稀硫酸中滴加硝酸,在铜粉溶解时最终可以观察到的实验现象:
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是
(3)将CuSO4·5H2O与NaHCO3按一定的比例共同投入到150mL沸水中,剧烈搅拌,冷却后,有绿色晶体析出。该晶体的化学组成为Cux (OH) y (CO3) z·nH2O。实验所得的绿色晶体需充分洗涤,检验是否洗涤干净的方法是
(4)为了确定晶体的化学式,某实验小组进行如下实验:a.称取3.640g晶体,加入足量的稀盐酸使固体完全溶解,收集到标准状况下的气体448.0 mL;b.称取等质量的晶体,灼烧至完全分解,得到2.400g残余固体。通过计算确定晶体的化学式(写出计算过程)。
您最近一年使用:0次
名校
7 . 硝酸铜晶体[Cu(NO3)2·6H2O],是一种重要的化工原料,常用于农药、镀铜、搪瓷等工业。以辉铜矿(主要成分为Cu2S,含少量Fe2O3,、SiO2等杂质)为原料制备硝酸铜晶体的某工艺如图所示:

回答下列问题:
(1)“浸取”时,为了提高浸取率可采取的措施有___________ (任写一点)
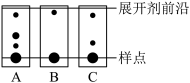
(2)薄层层析法是利用溶液各成分对同一吸附剂吸附能力不同,在溶液流过吸附剂时,使各成分互相分离的方法。某实验小组利用薄层层析法监控滤液1加入铁粉过程中溶液的组成,实验结果如下,则还需继续加入Fe粉的是___________ (选填编号)。
(3)滤渣2的主要成分是___________ ,滤渣2与稀硝酸反应时,需向装置内通入适量空气,这样做的目的是___________ 。
(4)调节溶液pH时选用的物质a可以是___________ ,几种金属离子沉淀的pH范围如下图所示,"调pH”时应将溶液pH调至___________ 。

(5)操作X主要包括___________ 、___________ 、过滤、洗涤、干燥。

回答下列问题:
(1)“浸取”时,为了提高浸取率可采取的措施有
(2)薄层层析法是利用溶液各成分对同一吸附剂吸附能力不同,在溶液流过吸附剂时,使各成分互相分离的方法。某实验小组利用薄层层析法监控滤液1加入铁粉过程中溶液的组成,实验结果如下,则还需继续加入Fe粉的是

(3)滤渣2的主要成分是
(4)调节溶液pH时选用的物质a可以是

(5)操作X主要包括
您最近一年使用:0次
8 . 以印刷线路板的碱性蚀刻废液(主要成分为[Cu(NH3)4]Cl2)或焙烧过的铜精炼炉渣(主要成分为CuO、SiO2少量Fe2O3)为原料均能制备CuSO4·5H2O晶体。
(1)取一定量蚀刻废液和稍过量的NaOH溶液加入到如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气,待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体;所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。_______ 。
②检验CuO固体是否洗净的实验操作是_______ 。
③装置图中装置X的作用是_______ 。
(2)以焙烧过的铜精炼炉渣为原料制备CuSO4·5H2O晶体时,请补充完整相应的实验方案:取一定量焙烧过的铜精炼炉渣,_______ ,加热浓缩、冷却结晶、过滤、晾干,得到CuSO4·5H2O晶体。已知:①该实验中pH=3.2时,Fe3+完全沉淀;pH=4.7时,Cu2+开始沉淀。②实验中可选用的试剂:1.0 mol/L H2SO4、1.0 mol/L HCl、1.0 mol/L NaOH。
(3)通过下列方法测定产品纯度:准确称取0.5000g CuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1000 mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.48mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2S2O +I2= S4O
+I2= S4O +2I-。计算CuSO4·5H2O样品的纯度:
+2I-。计算CuSO4·5H2O样品的纯度:_______ 。
(1)取一定量蚀刻废液和稍过量的NaOH溶液加入到如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气,待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体;所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。
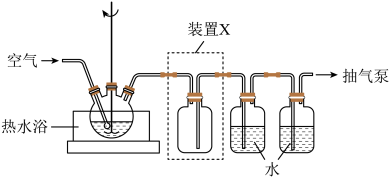
②检验CuO固体是否洗净的实验操作是
③装置图中装置X的作用是
(2)以焙烧过的铜精炼炉渣为原料制备CuSO4·5H2O晶体时,请补充完整相应的实验方案:取一定量焙烧过的铜精炼炉渣,
(3)通过下列方法测定产品纯度:准确称取0.5000g CuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1000 mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.48mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2S2O
 +I2= S4O
+I2= S4O +2I-。计算CuSO4·5H2O样品的纯度:
+2I-。计算CuSO4·5H2O样品的纯度:
您最近一年使用:0次
2021-07-15更新
|
866次组卷
|
10卷引用:黑龙江省哈尔滨师范大学附属中学2020-2021学年高二下学期期末考试化学试题
黑龙江省哈尔滨师范大学附属中学2020-2021学年高二下学期期末考试化学试题江苏省苏州实验中学2021-2022学年高二下学期期中考试化学试题江苏省2021年普通高中学业水平选择考适应性测试化学试题(已下线)大题03 无机制备类实验题-【考前抓大题】备战2021年高考化学(全国通用)(已下线)培优01 无机制备类实验 基础训练-2021年高考化学大题培优练(新高考地区专用)江苏省苏州市姑苏区第十中学2020-2021学年高一下学期期初化学考试山东省济南大学城实验高级中学2021届高三4月阶段性测试化学试题江苏省淮安市高中校协作体2021-2022学年高三上学期期中考试化学试题江苏省苏州市张家港市2021-2022学年高三下学期开学考试化学试题湖南省常宁市第一中学2021-2022学年高三下学期期中考试化学试题



