1 . 以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4·H2O,其主要实验流程如下:

已知:砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85 ℃条件下进行,适宜的加热方式为_________ 。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为_________ 。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是______________ 。
(3)滤液1和滤液2中含一定量的Cu2+、Zn2+。为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的________ (填化学式)。
(4)某化学兴趣小组要以硫酸锌溶液(含少量硫酸亚铁杂质)制备氧化锌。已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)
实验中可选用的试剂:30% H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1 NaOH。实验步骤依次为:_______ ;过滤;_______ ;过滤、洗涤、干燥;900℃煅烧,得到氧化锌。

已知:砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85 ℃条件下进行,适宜的加热方式为
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为
NaOH溶液浓度对脱氯率和其他元素浸出率的影响 | ||||
NaOH浓度/mol•L-1 | 脱氯率/% | 元素浸出率/% | ||
Cl | Zn | Cu | As | |
1.0 | 51.20 | 0.51 | 0.04 | 0.00 |
2.0 | 80.25 | 0.89 | 0.06 | 58.87 |
3.0 | 86.58 | 7.39 | 0.26 | 78.22 |
(4)某化学兴趣小组要以硫酸锌溶液(含少量硫酸亚铁杂质)制备氧化锌。已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
您最近一年使用:0次
名校
解题方法
2 . 现有 与
与 的混合溶液,为了分析混合溶液中
的混合溶液,为了分析混合溶液中 与
与 的质量分数,设计如下实验方案:取四份混合溶液各
的质量分数,设计如下实验方案:取四份混合溶液各 ,分别缓慢加入到
,分别缓慢加入到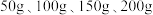 某
某 溶液中,测得四组实验数据如表:
溶液中,测得四组实验数据如表:
(1) 混合溶液与
混合溶液与 溶液完全反应生成沉淀的质量为
溶液完全反应生成沉淀的质量为______ g。
(2)试求出混合溶液中 的溶质质量分数是
的溶质质量分数是______ ?(写出计算过程)
(3)混合溶液中 的溶质质量分数为
的溶质质量分数为______ 。
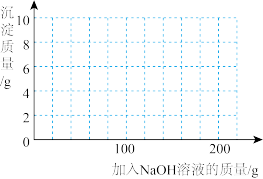
(4)若在 混合溶液中不断加入上述
混合溶液中不断加入上述 的溶液,请画出加入
的溶液,请画出加入 溶液的质量与所产生沉淀质量的关系图
溶液的质量与所产生沉淀质量的关系图______ 。(在答题卡的坐标图中作图)
 与
与 的混合溶液,为了分析混合溶液中
的混合溶液,为了分析混合溶液中 与
与 的质量分数,设计如下实验方案:取四份混合溶液各
的质量分数,设计如下实验方案:取四份混合溶液各 ,分别缓慢加入到
,分别缓慢加入到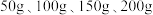 某
某 溶液中,测得四组实验数据如表:
溶液中,测得四组实验数据如表: | 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 | |
 溶液的质量 溶液的质量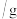 | 50 | 100 | 150 | 200 |
生成沉淀的质量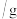 | 0 | 2.45 | 7.35 | 9.8 |
(1)
 混合溶液与
混合溶液与 溶液完全反应生成沉淀的质量为
溶液完全反应生成沉淀的质量为(2)试求出混合溶液中
 的溶质质量分数是
的溶质质量分数是(3)混合溶液中
 的溶质质量分数为
的溶质质量分数为(4)若在
 混合溶液中不断加入上述
混合溶液中不断加入上述 的溶液,请画出加入
的溶液,请画出加入 溶液的质量与所产生沉淀质量的关系图
溶液的质量与所产生沉淀质量的关系图
您最近一年使用:0次
名校
3 . 实验室以海绵铜(主要成分为Cu和CuO)为原料制取CuCl的主要流程如图所示。
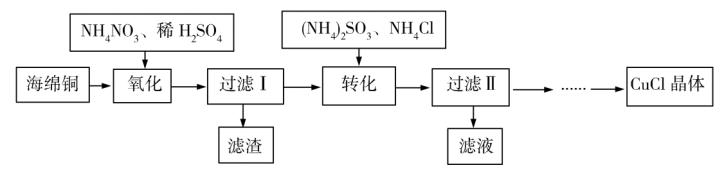
已知:①CuCl微溶于水,不溶于乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl露置于潮湿的空气中易被氧化。
回答下列问题。
(1)“氧化”时温度应控制在60℃~70℃,原因是___ 。
(2)写出“转化”过程中的离子方程式___ 。
(3)“过滤Ⅱ”所得滤液经蒸发浓缩、降温结晶、过滤等操作获得(NH4)2SO4晶体,可用作化学肥料。“过滤Ⅱ”所得滤渣主要成分为CuCl,用乙醇洗涤的优点是___ 。
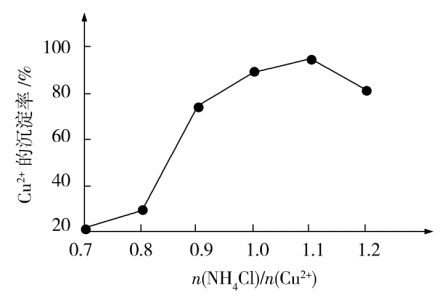
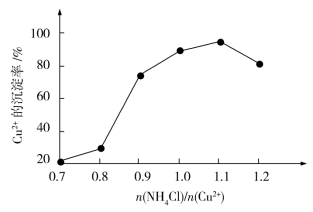
(4)氯化铵用量 与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是
与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是___ 。
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:___ 。(实验中可选试剂:0.1mol·L-1盐酸、10mol·L-1盐酸、蒸馏水、无水乙醇)

已知:①CuCl微溶于水,不溶于乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl露置于潮湿的空气中易被氧化。
回答下列问题。
(1)“氧化”时温度应控制在60℃~70℃,原因是
(2)写出“转化”过程中的离子方程式
(3)“过滤Ⅱ”所得滤液经蒸发浓缩、降温结晶、过滤等操作获得(NH4)2SO4晶体,可用作化学肥料。“过滤Ⅱ”所得滤渣主要成分为CuCl,用乙醇洗涤的优点是
(4)氯化铵用量
 与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是
与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:
您最近一年使用:0次
2020·江苏·模拟预测
解题方法
4 . 实验室以海绵铜(主要成分为Cu和CuO)为原料制取CuCl的主要流程如图所示。
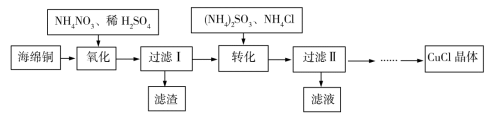
已知:①CuCl微溶于水,不溶于乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl露置于潮湿的空气中易被氧化。
回答下列问题。
(1)“氧化”时温度应控制在60~70℃,原因是____________________ 。
(2)写出“转化”过程中的离子方程式____________________ 。
(3)“过滤Ⅱ”所得滤液经__________ 、__________ 、过滤等操作获得(NH4)2SO4晶体,可用作化学肥料。“过滤Ⅱ”所得滤渣主要成分为CuCl,用乙醇洗涤的优点是________________ 。
(4)氯化铵用量[ ]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是
]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是__________ 。
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:__________ 。(实验中可选试剂:0.1 mol·L−1盐酸、10 mol·L−1盐酸、蒸馏水、无水乙醇)

已知:①CuCl微溶于水,不溶于乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl露置于潮湿的空气中易被氧化。
回答下列问题。
(1)“氧化”时温度应控制在60~70℃,原因是
(2)写出“转化”过程中的离子方程式
(3)“过滤Ⅱ”所得滤液经
(4)氯化铵用量[
 ]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是
]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:
您最近一年使用:0次
名校
5 . 将1.60gCuSO4固体在高温下加热,得到0.72g红色固体(纯净物,不含S元素),同时有气体X生成,X可能是SO2、SO3、O2中的两种或三种。下列说法正确的是
| A.所得红色固体是铜 |
| B.将X通入氢氧化钡溶液,若溶液变浑浊,则X中含有SO3 |
| C.X的物质的量最少为0.01mol |
| D.将X缓慢通过足量NaOH溶液,若溶液增重0.72g,则X中含0.005molO2 |
您最近一年使用:0次
名校
6 . 为探究某铜的硫化物组成,取一定量硫化物在氧气中充分灼烧,将生成的气体全部通入盛有足量的H2O2和BaCl2的混合液中,得到白色沉淀 4.66 g;将灼烧后的固体(仅含铜与氧2种元素)完全溶于100 mL 1 mol/LH2SO4中,过滤,得到0.64 g 红色固体,将滤液稀释至 200 mL,测得c(Cu2+)=0.1 mol/L。已知:Cu2O+ H2SO4 =CuSO4+Cu+H2O。
下列说法正确的是
下列说法正确的是
| A.得到白色沉淀亚硫酸钡 |
| B.原铜的硫化物中n(Cu)∶n(S)=2∶3 |
| C.最后所得的溶液最多可以溶解铁1.12 g |
| D.灼烧后的固体中n(Cu2O)∶n(CuO)=1∶1 |
您最近一年使用:0次
2019-03-06更新
|
876次组卷
|
7卷引用:江苏省扬州市2018-2019学年高二第二学期学业水平测试(必修)调研(二)化学试题
7 . 胆矾(CuSO4·5H2O)是铜的重要化合物,在工业生产中应用广泛。实验室制备胆矾的流程如下:

(1) 稀硫酸、稀硝酸与铜粉反应生成一种无色气体,该气体是_____ (写化学式),制得的胆矾晶体中可能存在的杂质是_____ (写名称)。
(2) 实验室可采用沉淀法测定所得胆矾晶体中CuSO4·5H2O的含量,步骤如下:
①取样、称量;②加水充分溶解;③加入BaCl2溶液;④过滤、洗涤、干燥;⑤称量、计算。在过滤前,需要检验SO42-是否沉淀完全,检验方法是____________________________________________
(3) 若改变反应条件可获得化学式为Cux(OH)y(SO4)z·nH2O的晶体,用热重分析仪对Cux(OH)y(SO4)z·nH2O晶体进行分析并推断该晶体的化学式。取3.30 g晶体样品进行热重分析,所得固体质量的变化曲线如下图所示。已知:体系温度在650 ℃及以下时,放出的气体只有水蒸气;实验测得温度在650 ℃时,残留固体的组成可视为aCuO·bCuSO4;温度在1 000 ℃以上时,得到的固体为Cu2O。
请回答下列问题:
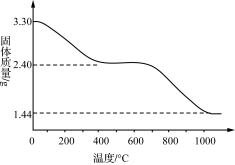
①温度650~1 000 ℃产生的气体中,n(O)∶n(S)____ (填“>”“<”或“=”)3。
②通过计算推断Cux(OH)y(SO4)z·nH2O晶体的化学式:__________ 。

(1) 稀硫酸、稀硝酸与铜粉反应生成一种无色气体,该气体是
(2) 实验室可采用沉淀法测定所得胆矾晶体中CuSO4·5H2O的含量,步骤如下:
①取样、称量;②加水充分溶解;③加入BaCl2溶液;④过滤、洗涤、干燥;⑤称量、计算。在过滤前,需要检验SO42-是否沉淀完全,检验方法是
(3) 若改变反应条件可获得化学式为Cux(OH)y(SO4)z·nH2O的晶体,用热重分析仪对Cux(OH)y(SO4)z·nH2O晶体进行分析并推断该晶体的化学式。取3.30 g晶体样品进行热重分析,所得固体质量的变化曲线如下图所示。已知:体系温度在650 ℃及以下时,放出的气体只有水蒸气;实验测得温度在650 ℃时,残留固体的组成可视为aCuO·bCuSO4;温度在1 000 ℃以上时,得到的固体为Cu2O。
请回答下列问题:

①温度650~1 000 ℃产生的气体中,n(O)∶n(S)
②通过计算推断Cux(OH)y(SO4)z·nH2O晶体的化学式:
您最近一年使用:0次
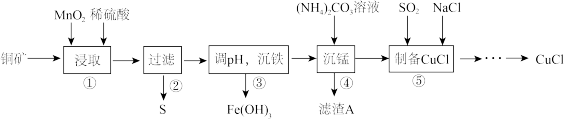
8 . 用某铜矿(含CuS以及少量FeO和Fe2O3)制备CuCl的主要流程如下:
已知Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH如下表所示:
(1)浸取时,CuS被浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O,该反应的氧化剂是________ (填化学式),Fe2O3被浸取的离子方程式为________________ 。
(2)步骤③调整pH的范围为______ ,滤渣A的成分为________ (填化学式)。
(3)“沉铁”时,需要检验Fe3+是否沉淀完全,所用的试剂为________ (填化学式)。
(4)准确称取所制备的氯化亚铜样品1.600 g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.100 0 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00 mL,反应中Cr2O72-被还原为Cr3+,计算样品中CuCl的质量分数(写出计算过程)______ 。
已知Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH如下表所示:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 7.1 | 10.1 |
| Cu(OH)2 | 4.7 | 6.7 |
(2)步骤③调整pH的范围为
(3)“沉铁”时,需要检验Fe3+是否沉淀完全,所用的试剂为
(4)准确称取所制备的氯化亚铜样品1.600 g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.100 0 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00 mL,反应中Cr2O72-被还原为Cr3+,计算样品中CuCl的质量分数(写出计算过程)
您最近一年使用:0次
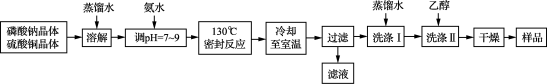
9 . 锂/磷酸氧铜电池是一种以磷酸氧铜作为正极材料的锂离子电池,其正极的活性物质是Cu4O(PO4)2,制备流程如下:
主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1) 实验室进行“过滤”操作使用的玻璃仪器主要有____________________ 。
(2) 流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是__________________ 。
(3) 准确称取上述流程所得的样品38.56 g [假定样品中只含Cu4O(PO4)2和CuO两种物质],使其完全溶于一定量的硝酸中,再加入氢氧化钠溶液,使铜完全沉淀,将沉淀灼烧使其转变为黑色氧化铜,最终称得残留固体质量为27.20 g。计算所得样品中磷酸氧铜的质量分数_______ 。(写出计算过程)
主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1) 实验室进行“过滤”操作使用的玻璃仪器主要有
(2) 流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是
(3) 准确称取上述流程所得的样品38.56 g [假定样品中只含Cu4O(PO4)2和CuO两种物质],使其完全溶于一定量的硝酸中,再加入氢氧化钠溶液,使铜完全沉淀,将沉淀灼烧使其转变为黑色氧化铜,最终称得残留固体质量为27.20 g。计算所得样品中磷酸氧铜的质量分数
您最近一年使用:0次
10 . 将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的稀硝酸中,固体完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论错误的是
| A.纯净无色气体Y与0.75VmL(标准状况)O2混合后通入水中,气体可被完全吸收 |
| B.若固体与硝酸恰好完全反应,当V=1680时,Cu2O与Cu的物质的量之比为8∶1 |
| C.原混合粉末的总质量可能为9.8 g |
| D.向溶液中加入NaOH溶液,使Cu2+恰好完全沉淀,消耗NaOH的物质的量为(0.325-V/22400)mol |
您最近一年使用:0次



