9-10高二下·广东湛江·期中
名校
解题方法
1 . 下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是
①金属钠在纯氧中燃烧
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用酒精中
①金属钠在纯氧中燃烧
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用酒精中
| A.②③①④ | B.③②①④ | C.③①②④ | D.①②③④ |
您最近一年使用:0次
2022-01-13更新
|
1234次组卷
|
83卷引用:2013-2014学年江苏省宿迁市高一上学期第二次月考化学试卷
(已下线)2013-2014学年江苏省宿迁市高一上学期第二次月考化学试卷(已下线)2010年广东省湛江二中高二第二学期期中考试化学(文)试题(已下线)2010年湖南省浏阳一中高一上学期第三次阶段性测试化学卷(已下线)2010—2011学年湖北省沙市中学高一上学期期末考试化学试卷(已下线)2011-2012学年黑龙江省庆安三中高一上学期期末考试化学试卷(已下线)2012-2013学年山东省济宁市汶上一中高一3月质量检测化学试卷(已下线)2012-2013学年广东省佛山市佛山一中高一下学期期中考试化学试卷(已下线)2012-2013学年广东省佛山市佛山一中高一下学期期中考试化学试卷(已下线)2012-2013学年山西省晋中市昔阳中学高二下学期期末考试化学试卷(已下线)2012-2013学年辽宁省铁岭市六校第一次联合考试化学试卷(已下线)2015届甘肃省天水市秦安县二中高三上学期期中考试化学试卷2014-2015黑龙江省哈尔滨六中高一12月月考化学试卷2014-2015湖南省浏阳一中等三校高一12月联考化学试卷2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷14-15内蒙古北方重工业集团三中高一上学期期末化学试卷2014-2015广东省深圳市南山区上学期高一化学期末试卷陕西省咸阳市西藏民族学院附属中学2015-2016学年高一上期末化学卷2015-2016学年广东省肇庆市高一上学期期末考试化学试卷2015-2016学年黑龙江省绥棱一中高二6月月考化学试卷2015-2016学年甘肃省甘谷一中高一上期末化学试卷2017届辽宁省铁岭市高三上学期第一次联考化学试卷2016-2017学年河南省南阳一中高一上月考二化学卷2016-2017学年河南省南阳一中高一月考二化学卷2016-2017学年江西省南昌市第二中学高一上学期期末考试化学试卷2016-2017学年黑龙江省鸡西市第十九中学高一上学期期末考试化学试卷辽宁省大石桥市第二高级中学2016-2017学年高二学业水平模拟测试化学试题青海省西宁市第四高级中学2017-2018学年高一上学期第二次月考化学试题1湖北省荆州中学2017-2018学年高一12月月考化学试题湖南省醴陵市第一中学2017-2018学年高一上学期第二次月考(12月)化学试题湖北省宜昌市葛洲坝中学2017-2018学年高一12月月考化学试题湖北省宜昌市长阳县第一高级中学2017-2018学年高一12月月考化学试题安徽省淮南市第二中学2017-2018学年高一上学期第二次月考化学试题新疆昌吉市2017-2018学年高一上学期期末考试化学试题天津市红桥区2017-2018学年高一上学期期末考试化学试题宁夏银川一中2017-2018学年高一上学期期末考试化学试题湖北省宜昌市示范高中协作体2017-2018学年高一上学期期末化学试题湖南省师范大学附属中学2017-2018学年高一上学期期末考试化学试题黑龙江省伊春中学2017-2018学年高一化学上学期期末考试题【全国百强校】青海省平安县第一高级中学2017-2018学年高一下学期期中考试(A卷)化学试题人教版2017-2018学年高一化学必修1:3.2 几种重要的金属化合物 同步测试2【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(文)上学期10月月考化学试题河南省封丘县一中2018-2019学年高一上学期12月月考化学试题河南省信阳市第六高级中学2018-2019学年高一上学期第三次(1月)月考化学试题山西省晋中市平遥县第二中学2018-2019学年高一上学期12月月考化学试题陕西省黄陵中学2018-2019学年高一(普通班)上学期期末考试化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高一上学期期末考试化学试题新疆石河子第二中学2018-2019学年高一上学期期末考试化学试题内蒙古开来中学2018-2019学年高二下学期期末考试化学试题辽宁省实验中学东戴河分校2020届高三上学期期初摸底考试化学试题黑龙江省佳木斯市汤原高级中学2018-2019学年高二下学期期末考试化学试题江西省赣州市会昌中学2019-2020学年高一上学期第二次月考化学试题河北省安平中学2019-2020学年高一上学期第四次月考化学试题山西省晋中市平遥县第二中学2019-2020学年高一12月月考化学试题北京市昌平区新学道临川学校2019-2020学年高一上学期期末考试化学试题福建省泉州第五中学苏教版高中化学必修1专题3 单元综合练习云南省大理市下关第一中学2019-2020学年高一上学期期末考试化学试题安徽省六安市第一中学2019-2020学年高一下学期疫情防控延期开学期间辅导测试(二)化学试题四川省南充市阆中中学2020届高三化学选择题专项训练(15)江西省上饶市2019-2020学年高一上学期期末考试 化学(自招班)试题天津市西青区2019-2020学年高一上学期期末考试化学试题(已下线)专题3.2 铁及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》陕西省咸阳市实验中学2019-2020学年高一上学期第三次月考化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期第六次综合测试化学试题人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题黑龙江省鸡东县第二中学2020-2021学年高一上学期中考试化学试卷宁夏石嘴山市平罗中学2020-2021学年高一上学期第三次月考化学试题吉林省长春市第二十中学2020-2021学年高一上学期第三次考试化学试题云南省大理白族自治州实验中学2020-2021学年高一上学期12月月考化学试题天津市东丽区2020-2021学年高一上学期期末考试化学试题广西南宁市英华学校2020-2021学年高一上学期期末考试化学试题(已下线)专题3.1.3 铁盐与亚铁盐(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)吉林省长春市农安县2021-2022学年高一上学期期末考试化学试题新疆哈密市第八中学2021-2022学年高一上学期期末考试化学试题陕西省西安市阎良区关山中学2021-2022学年高一上学期第三次质量检测化学(理科)试题安徽省宿州市北方中学2021-2022学年高一上学期期末测试化学试题2023年广东省普通高中学业水平合格性考试化学科模拟测试卷(四)2023年广东省普通高中学业水平合格性考试化学科模拟仿真卷(一)天津市新华中学2022-2023学年高一上学期期末考试化学试题 云南省玉溪第一中学2022-2023学年高一下学期期中考试化学试题(已下线)专题九 铁及其化合物(已下线)合格考真题汇编8金属元素及其化合物二天津北京师范大学静海附属学校2023-2024学年高一上学期第三次月考化学试题
2 . 某同学通过如下流程制备氧化亚铜:

已知: 难溶于水和稀硫酸,
难溶于水和稀硫酸,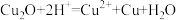
下列说法不正确的是

已知:
 难溶于水和稀硫酸,
难溶于水和稀硫酸,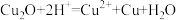
下列说法不正确的是
A.步骤② 可用 可用 替换 替换 |
B.步骤③中为防止 被氧化,可用 被氧化,可用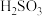 溶液洗涤 溶液洗涤 |
C.步骤④发生反应的离子方程式为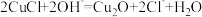 |
D.如果 试样中混有 试样中混有 和 和 杂质,用足量稀硫酸与 杂质,用足量稀硫酸与 试样充分反应,根据反应前、后固体质量可计算试样纯度 试样充分反应,根据反应前、后固体质量可计算试样纯度 |
您最近一年使用:0次
2021-11-17更新
|
1528次组卷
|
26卷引用:【全国市级联考】四川省广安市2017-2018学年高一下学期期末考试化学试题
【全国市级联考】四川省广安市2017-2018学年高一下学期期末考试化学试题辽宁省盘锦市高级中学2017-2018学年高二下学期期末考试化学试题浙江省普通高校招生选考科目2018年4月考试化学试题【全国百强校】广东省深圳市高级中学2018-2019学年高二上学期期中考试化学试题海南省儋州市第一中学2020届高三上学期第一次月考化学试卷上海市奉贤区2019届高三高考一模化学试题第八章 化学与可持续发展 模拟高考——C挑战区 夯实基础(人教版(2019)第二册)第四章 化学与自然资源的开发利用 模拟高考——C挑战区 夯实基础(人教版必修2)四川省成都经济技术开发区实验中学2021届高三上学期入学考试化学试题四川省泸县第二中学2019-2020学年高一下学期期末模拟考试化学试题高一必修第一册(鲁科2019)考试帮 4 核心考点突破必修第二册RJ第八章 C挑战区 模拟高考陕西省西安中学2021届高三第二次月考化学试题北京市精华学校2021届高三上学期12月月考化学试题江苏省苏州市南京航空航天大学苏州附属中学2020-2021学年高一下学期二月月考化学试题重庆市第七中学2021届高三上学期期中化学试题广东省广州市天河中学2021届高三上学期1月月考化学试题山东省聊城市高唐县第一中学2021-2022学年高三上学期开学考试化学试题(已下线)专题17.基础实验设计与评价-十年(2012-2021)高考化学真题分项汇编(浙江专用)广东实验中学2021-2022学年高三上学期11月月考化学试题(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)宁夏石嘴山市平罗中学2021-2022学年高三上学期期中考试化学试题(已下线)专题18 无机实验计算-2022年高考化学二轮复习重点专题常考点突破练宁夏回族自治区石嘴山市第三中学2022-2023学年高三上学期第一次月考化学试题新疆疏附县第一中学2021-2022学年高三上学期第二次月考化学试题辽宁省沈阳市第二中学2023-2024学年高三上学期开学暑假阶段验收化学测试题
3 . 从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
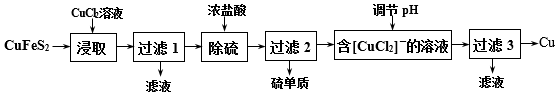
(1)“浸取”时,将黄铜矿进行粉碎的目的是___ 。
(2)“浸取”时,反应生成CuCl、FeCl2和S,该反应化学方程式为____ 。
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是____ 。
(4)“过滤3”所得滤液中可以循环使用的物质有___ 和____ ;为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为___ mol。
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,化学方程式为:6CuFeS2+13O2 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2 2Cu+SO2,此工艺与上述工艺相比,主要缺点有
2Cu+SO2,此工艺与上述工艺相比,主要缺点有_____ 。

(1)“浸取”时,将黄铜矿进行粉碎的目的是
(2)“浸取”时,反应生成CuCl、FeCl2和S,该反应化学方程式为
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是
(4)“过滤3”所得滤液中可以循环使用的物质有
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,化学方程式为:6CuFeS2+13O2
 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2 2Cu+SO2,此工艺与上述工艺相比,主要缺点有
2Cu+SO2,此工艺与上述工艺相比,主要缺点有
您最近一年使用:0次
4 . 已知A~K均为中学化学中常见的物质,它们之间有如图所示的转化关系,其中A为两种物质组成的混合物,H、I、K为单质,H是气体,G是红褐色沉淀。(反应过程中生成的水及其他产物没有列出)
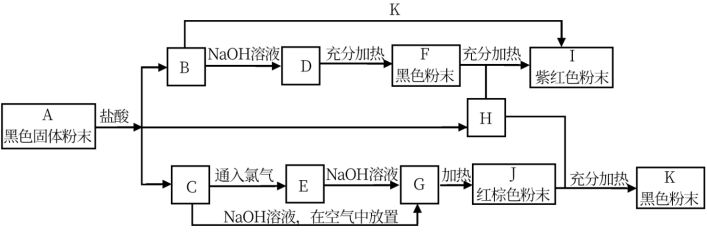
请回答以下问题:
(1)写出下列物质的化学式: H_______ ,J_______ 。
(2)写出A跟盐酸反应生成B的化学方程式:_______ 。
(3)写出C跟氯气反应生成E的化学方程式:._______ 。

请回答以下问题:
(1)写出下列物质的化学式: H
(2)写出A跟盐酸反应生成B的化学方程式:
(3)写出C跟氯气反应生成E的化学方程式:.
您最近一年使用:0次
5 . 某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
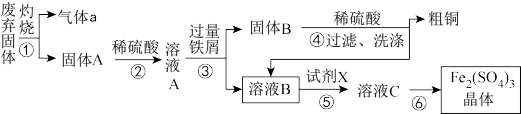
已知:铁屑能将Fe3+还原为Fe2+。
(1)Cu2S中Cu元素的化合价为_______ ,①中涉及的反应有:Cu2S+O2 2Cu+SO2,该反应的氧化剂是
2Cu+SO2,该反应的氧化剂是_______ 。
(2)③的实验操作中用到的玻璃仪器有_______ 。
(3)①试剂X通常选择H2O2,在反应中用作_______ (填氧化剂或还原剂)。
②试剂X若用Cl2,缺点是_______ 。(写出两个)
(4)灼烧过程中会有少量Cu2O生成,已知Cu2O与稀硫酸反应,得到蓝色溶液和红色固体单质,有关离子方程式为_______ 。

已知:铁屑能将Fe3+还原为Fe2+。
(1)Cu2S中Cu元素的化合价为
 2Cu+SO2,该反应的氧化剂是
2Cu+SO2,该反应的氧化剂是(2)③的实验操作中用到的玻璃仪器有
(3)①试剂X通常选择H2O2,在反应中用作
②试剂X若用Cl2,缺点是
(4)灼烧过程中会有少量Cu2O生成,已知Cu2O与稀硫酸反应,得到蓝色溶液和红色固体单质,有关离子方程式为
您最近一年使用:0次
6 . 碱式氯化铜(不溶于水的绿色晶体)是一种农药,分子式:CuCl2·3Cu(OH)2·XH2O(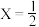 ,1,2).为验证其组成并确定X值,某学生设计了以下几步实验:
,1,2).为验证其组成并确定X值,某学生设计了以下几步实验:
①取a g的晶体研成粉末
②晶体在空气中加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g
③另取a g的晶体,溶于足量稀硝酸中充分溶解得到溶液
④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c g。
若以上操作均正确,试回答下列问题:
(1)以上实验中用到玻璃棒的步骤有_______ (填序号)。
(2)步骤②中晶体应放在_______ (填仪器名称)中灼烧。
(3)步骤④主要包括:加入足量硝酸银溶液→_______ →_______ →晾干→称量。
(4)碱式氯化铜的摩尔质量为_______ (用含a、c的代数式表示。)
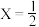 ,1,2).为验证其组成并确定X值,某学生设计了以下几步实验:
,1,2).为验证其组成并确定X值,某学生设计了以下几步实验:①取a g的晶体研成粉末
②晶体在空气中加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g
③另取a g的晶体,溶于足量稀硝酸中充分溶解得到溶液
④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c g。
若以上操作均正确,试回答下列问题:
(1)以上实验中用到玻璃棒的步骤有
(2)步骤②中晶体应放在
(3)步骤④主要包括:加入足量硝酸银溶液→
(4)碱式氯化铜的摩尔质量为
您最近一年使用:0次
7 . 某工业废渣中主要含有Cu2O及少量杂质(Al2O3、Fe2O3、SiO2等),从该工业废渣中提取铜的工艺流程如图所示[已知Al3+与足量NaOH溶液反应生成NaAlO2,最终不会有Al(OH)3沉淀]:
试回答下列问题。
(1)滤液A中的金属阳离子为Cu2+、Al3+、_______ ,固体混合物D中含有的物质是_______ (写化学式)。
(2)操作X为常见的实验操作,其操作名称是_______ ,在实验室,该操作中使用的玻璃仪器有_______ 。
(3)上述方法制备的铜可用来制备铜合金,某铜合金中可能含有Mg、Zn中的一种,采用下列方法可测定该铜合金的组成。
实验方法:
取10.0g铜合金粉末样品放入烧杯中,将56.0g 14.0%的稀硫酸(密度为1.092g∙cm-3)平均分四次依次加入该烧杯中,每次均充分反应。
实验数据记录如下表:
①稀硫酸的物质的量浓度为_______ mol•L-1 。(结果保留两位小数)
②该铜合金中另一种金属是_______ (填化学式)。
③该铜合金中铜的质量分数为_______ 。

试回答下列问题。
(1)滤液A中的金属阳离子为Cu2+、Al3+、
(2)操作X为常见的实验操作,其操作名称是
(3)上述方法制备的铜可用来制备铜合金,某铜合金中可能含有Mg、Zn中的一种,采用下列方法可测定该铜合金的组成。
实验方法:
取10.0g铜合金粉末样品放入烧杯中,将56.0g 14.0%的稀硫酸(密度为1.092g∙cm-3)平均分四次依次加入该烧杯中,每次均充分反应。
实验数据记录如下表:
实验编号 | a | b | c | d |
加入稀硫酸的质量/g | 14.0 | 14.0 | 14.0 | 14.0 |
剩余固体的质量/g | 8.7 | 7.4 | 6.1 | 6.0 |
①稀硫酸的物质的量浓度为
②该铜合金中另一种金属是
③该铜合金中铜的质量分数为
您最近一年使用:0次
名校
8 . 下列常见物质的俗名与化学式相对应的是
| A.纯碱-NaOH | B.漂白粉-NaClO |
| C.胆矾-CuSO4·5H2O | D.大理石-Ca(OH)2 |
您最近一年使用:0次
2021-01-14更新
|
76次组卷
|
2卷引用:江苏省盐城市2020-2021学年高二学业水平合格性考试模拟卷(一)(12月) 化学试题
名校
解题方法
9 . 从铬铜废催化剂(主要含CuO·Cr2O3、少量有机物及水)中回收铬和铜的实验流程如下:
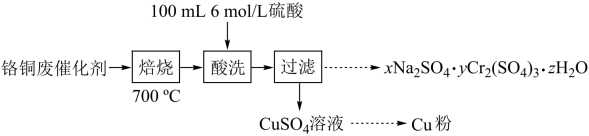
(1)700℃“焙烧”可使Cr2O3不溶于酸,焙烧的另一目的是_______
(2)配制“酸洗”所用100mL6mol·L-1硫酸需要的玻璃仪器有:量筒、烧杯、100mL容量瓶、_______ 和_______ ;为使研碎的烧渣中CuO充分溶解,应采取的措施是_______
(3)为确定xNa2SO4·yCr2(SO4)3·zH2O的组成,进行下列实验:
①称取样品1.9320g溶于水,加入足量盐酸酸化的BaCl2溶液,得到1.8640g沉淀。
②另称取样品1.9320g溶于水,经H2O2在碱性条件下氧化、煮沸、酸化得Na2Cr2O7和Na2SO4的混合酸性溶液;加入稍过量的KI溶液( +6I-+14H+ = 2Cr3++3I2+7H2O),暗处静置5min,立刻用0.5000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至溶液呈浅黄色,再加入1mL淀粉溶液,继续滴定至溶液蓝色刚好消失,消耗Na2S2O3溶液24.00mL。
+6I-+14H+ = 2Cr3++3I2+7H2O),暗处静置5min,立刻用0.5000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至溶液呈浅黄色,再加入1mL淀粉溶液,继续滴定至溶液蓝色刚好消失,消耗Na2S2O3溶液24.00mL。
根据上述实验数据,确定xNa2SO4·yCr2(SO4)3·zH2O的化学式(写出计算过程)___________ 。

(1)700℃“焙烧”可使Cr2O3不溶于酸,焙烧的另一目的是
(2)配制“酸洗”所用100mL6mol·L-1硫酸需要的玻璃仪器有:量筒、烧杯、100mL容量瓶、
(3)为确定xNa2SO4·yCr2(SO4)3·zH2O的组成,进行下列实验:
①称取样品1.9320g溶于水,加入足量盐酸酸化的BaCl2溶液,得到1.8640g沉淀。
②另称取样品1.9320g溶于水,经H2O2在碱性条件下氧化、煮沸、酸化得Na2Cr2O7和Na2SO4的混合酸性溶液;加入稍过量的KI溶液(
 +6I-+14H+ = 2Cr3++3I2+7H2O),暗处静置5min,立刻用0.5000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至溶液呈浅黄色,再加入1mL淀粉溶液,继续滴定至溶液蓝色刚好消失,消耗Na2S2O3溶液24.00mL。
+6I-+14H+ = 2Cr3++3I2+7H2O),暗处静置5min,立刻用0.5000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至溶液呈浅黄色,再加入1mL淀粉溶液,继续滴定至溶液蓝色刚好消失,消耗Na2S2O3溶液24.00mL。根据上述实验数据,确定xNa2SO4·yCr2(SO4)3·zH2O的化学式(写出计算过程)
您最近一年使用:0次
10 . 氯化铜在工农业生产中具有重要的用途。某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。回答下列问题:
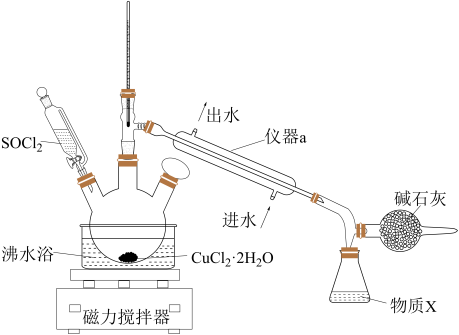
已知:①SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2 CuCl2+2SO2↑+4HCl↑
CuCl2+2SO2↑+4HCl↑
(1)仪器a的名称是______ ,锥形瓶中得到的物质X的化学式为______ 。
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是______ 。
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2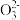 =S4
=S4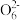 +2I-)。
+2I-)。
①滴定到终点时的现象是______ 。
②该试样中铜元素的百分含量为______ 。

已知:①SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2
 CuCl2+2SO2↑+4HCl↑
CuCl2+2SO2↑+4HCl↑(1)仪器a的名称是
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2
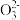 =S4
=S4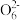 +2I-)。
+2I-)。①滴定到终点时的现象是
②该试样中铜元素的百分含量为
您最近一年使用:0次
2020-12-30更新
|
187次组卷
|
3卷引用:江苏省海安高级中学2020-2021学年高二上学期高中合格性考试化学试题



