名校
1 . C 和 CuO 在高温下反应可能生成 Cu、Cu2O、CO2、CO。现将 1g 碳粉跟 8gCuO 混合,在硬质试管中隔绝空气高温加热,生成的气体全部通过足量 NaOH 溶液,收集残余气体。测得溶液增重 1.1g,残余气体在标准状况下的体积为 0.025L。下列说法不正确的是
| A.在硬质试管中高温加热固体混合物时,有 0.6g 碳参加了反应 |
| B.试管中的所有氧化还原反应共转移电子 0.15mol |
| C.反应生成铜和氧化亚铜的总物质的量为 0.1mol |
| D.反应后的试管中固体混合物总质量为 7.2g |
您最近一年使用:0次
解题方法
2 . 下列说法正确的是( )
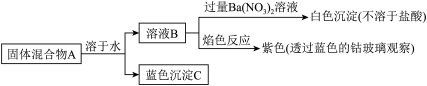

| A.固体混合物A是CuSO4和NaOH |
| B.固体混合物A是CuSO4和KOH |
| C.固体混合物A是CuCl2和KOH |
| D.固体混合物A是CuSO4和Ba(OH)2 |
您最近一年使用:0次
解题方法
3 . 有Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL某浓度的盐酸溶液中,混合物恰好全部溶解,当再加入250ml 2.00 mol·L-1的NaOH溶液时,得到的沉淀最多。上述盐酸的物质的量浓度是
| A.0.50 mol·L-1 | B.1.00 mol·L-1 | C.2.00 mol·L-1 | D.3.00 mol·L-1 |
您最近一年使用:0次
2020-10-09更新
|
215次组卷
|
2卷引用:广东省湛江市2017-2018学年高一上学期期末考试化学试题
名校
解题方法
4 . 下列有关物质性质与用途具有对应关系的是( )
| A.Na2S溶液具有碱性,可用于脱除废水中的Hg2+ |
| B.铝具有良好的导热性,可用铝槽车贮运浓硝酸 |
| C.NaHCO3能与碱反应,可用作食品疏松剂 |
| D.CuSO4能使蛋白质变性,可用于游泳池水的消毒 |
您最近一年使用:0次
10-11高一上·浙江绍兴·期中
5 . 取一定量的CuO粉末与0.5 L稀硫酸充分反应后,将一根50 g铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24 g, 并收集到224 mL气体(标准状况)。求此CuO粉末的质量____ 。
您最近一年使用:0次
名校
6 . 氯化亚铜(CuCl)常用作催化剂、杀菌剂等。
(1)将Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量浓盐酸混匀,得到CuCl沉淀。写出该反应的离子方程式____________________________ 。
(2)为测定制得CuCl样品的纯度,进行下列实验:
a.称取0.5000 g样品,放入盛有20 mL过量FeCl3 溶液和玻璃珠的锥形瓶中,不断摇动;
b.待样品溶解后,加水50 mL;
c.立即用0.2000 mol/LCe(SO4)2标准溶液滴至反应完全,记录消耗标准溶液的体积;
d.重复步骤a至c操作2次,记录消耗标准溶液的平均体积为25.00 mL。已知:CuC1+Fe3+=Cu2++Fe2++Cl-、 Fe2++Ce4+=Fe3++Ce3+
①配制100 mL 0.2000 mol/L的Ce(SO4)2标准溶液时,需要的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管,还需要______________ 。
②进行步骤c时若操作缓慢,则测得CuCl的纯度________ (填“偏大”、“偏小”或“无影响”)。
③通过计算确定该样品中CuCl的纯度_____________ (写出计算过程)。
(1)将Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量浓盐酸混匀,得到CuCl沉淀。写出该反应的离子方程式
(2)为测定制得CuCl样品的纯度,进行下列实验:
a.称取0.5000 g样品,放入盛有20 mL过量FeCl3 溶液和玻璃珠的锥形瓶中,不断摇动;
b.待样品溶解后,加水50 mL;
c.立即用0.2000 mol/LCe(SO4)2标准溶液滴至反应完全,记录消耗标准溶液的体积;
d.重复步骤a至c操作2次,记录消耗标准溶液的平均体积为25.00 mL。已知:CuC1+Fe3+=Cu2++Fe2++Cl-、 Fe2++Ce4+=Fe3++Ce3+
①配制100 mL 0.2000 mol/L的Ce(SO4)2标准溶液时,需要的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管,还需要
②进行步骤c时若操作缓慢,则测得CuCl的纯度
③通过计算确定该样品中CuCl的纯度
您最近一年使用:0次
7 . (1)称量一定质量表面含油污的纯铜屑(铜含量为99.84%),置于坩埚中灼烧,将油污充分氧化后除去,直至铜屑表面均呈黑色。冷却后称量,固体质量比灼烧前增加了3.2 %,固体中铜与氧化铜的质量之比为_______。(请将结果化为小数,且保留至小数点后两位)
(2)向1000克未知溶质质量分数的硫酸铜溶液中加入一定量的氢氧化钠溶液,过滤、干燥后得到蓝色固体19.6克。在所得滤液中加入过量铁粉,充分反应后,再加入足量盐酸,最后得到6.4克固体,求原溶液中硫酸铜的质量分数。(请写出计算过程)
(2)向1000克未知溶质质量分数的硫酸铜溶液中加入一定量的氢氧化钠溶液,过滤、干燥后得到蓝色固体19.6克。在所得滤液中加入过量铁粉,充分反应后,再加入足量盐酸,最后得到6.4克固体,求原溶液中硫酸铜的质量分数。(请写出计算过程)
您最近一年使用:0次
名校
解题方法
8 . 实验室利用下列实验装置来测定铜的氧化物CuXO的组成。
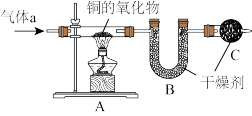
(1)若气体a为纯净的氢气,在点燃A装置中酒精灯以前,要将氢气通过整个装置一段时间,其目的是__ 。
(2)若气体a为纯净的氢气,当铜的氧化物CuXO完全被还原为Cu时,称得Cu的质量为6.4g,同时称得B装置的质量增加了0.9克,则这种铜的氧化物中铜元素和氧元素的原子个数之比的原始计算式为_____ ,该铜的氧化物的化学式为____ 。
(3)若气体a为混有少量H2O(g)的氢气,而又未经干燥处理直接通至装置A中,当铜的氧化物CuXO完全被还原为Cu时,仍然利用称量Cu的质量和B装置增加的质量的方法来完成这个实验,将使测定结果中铜元素与氧元素质量之比的值(选填“偏大”、“偏小”或“不受影响”)_____ 。
(4)若气体a为混有少量H2O(g)的氢气,不增加任何其他实验装置也不改动上述装置的连接顺序,仍用其来测定CuXO的组成,必须测得哪些数据才能得到x的值?___

(1)若气体a为纯净的氢气,在点燃A装置中酒精灯以前,要将氢气通过整个装置一段时间,其目的是
(2)若气体a为纯净的氢气,当铜的氧化物CuXO完全被还原为Cu时,称得Cu的质量为6.4g,同时称得B装置的质量增加了0.9克,则这种铜的氧化物中铜元素和氧元素的原子个数之比的原始计算式为
(3)若气体a为混有少量H2O(g)的氢气,而又未经干燥处理直接通至装置A中,当铜的氧化物CuXO完全被还原为Cu时,仍然利用称量Cu的质量和B装置增加的质量的方法来完成这个实验,将使测定结果中铜元素与氧元素质量之比的值(选填“偏大”、“偏小”或“不受影响”)
(4)若气体a为混有少量H2O(g)的氢气,不增加任何其他实验装置也不改动上述装置的连接顺序,仍用其来测定CuXO的组成,必须测得哪些数据才能得到x的值?
您最近一年使用:0次
9 . 加强废旧金属的回收和再利用,是合理开发和利用金属资源的主要途径之一。下图是从镀铜废电路板中回收金属铜的一种工艺流程(各过程需控制适宜条件)。
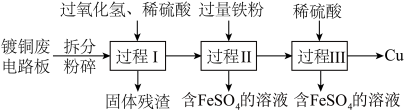
(1)上述流程中,为加快化学反应速率而采取的措施是______ 。
(2)过程Ⅰ中,Cu溶解,过氧化氢的作用是______ 。
(3)过程Ⅱ中,获得Cu的反应的离子方程式为______ 。
(4)过程Ⅲ的目的是______ 。

(1)上述流程中,为加快化学反应速率而采取的措施是
(2)过程Ⅰ中,Cu溶解,过氧化氢的作用是
(3)过程Ⅱ中,获得Cu的反应的离子方程式为
(4)过程Ⅲ的目的是
您最近一年使用:0次
2020-08-04更新
|
300次组卷
|
5卷引用:江苏省宿迁市泗阳县桃州中学2020-2021学年高二上学期第一次调研考试化学试题
解题方法
10 . 某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等。利用该固体废渣制取Cu(NO3)2的部分工艺流程如图所示:
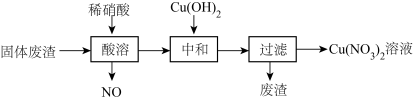
(1)写出CuO、Cu2O分别与稀硝酸反应的离子方程式为:______ 、______ 。
(2)酸溶时,反应温度不宜超过70℃,其主要原因是______ ,若保持反应温度为70℃,欲加快反应速率可采取的措施为______ (写出一种即可)。
(3)过滤后所得废渣的主要成分的化学式为______ 。
(4)Cu(NO3)2晶体受热易分解成CuO,同时产生NO2和O2,该反应的化学方程式为______ 。由Cu(NO3)2溶液制Cu(NO3)2·6H2O晶体的操作方法是:蒸发浓缩、______ 、过滤、冰水洗涤、______ 。

(1)写出CuO、Cu2O分别与稀硝酸反应的离子方程式为:
(2)酸溶时,反应温度不宜超过70℃,其主要原因是
(3)过滤后所得废渣的主要成分的化学式为
(4)Cu(NO3)2晶体受热易分解成CuO,同时产生NO2和O2,该反应的化学方程式为
您最近一年使用:0次



