2020高三·全国·专题练习
名校
解题方法
1 . K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]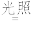 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为___ 。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。

①通入氮气的目的是____ 。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有____ 、___ 。
③为防止倒吸,停止实验时应进行的操作是___ 。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是____ 。
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]
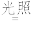 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为(2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。

①通入氮气的目的是
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
③为防止倒吸,停止实验时应进行的操作是
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是
您最近一年使用:0次
2020-12-09更新
|
637次组卷
|
5卷引用:专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测
(已下线)专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测专题9 第一~三单元综合拔高练-高中化学必修第二册苏教版2019四川省绵阳市南山中学实验学校2022届高三上学学期开学考试化学试题四川省泸县第四中学2021-2022学年高三上学期第二次月考理综化学试题(已下线)专题讲座(十)化学实验设计与探究(练) — 2022年高考化学一轮复习讲练测(新教材新高考)
名校
2 . 我国宋代沈括在《梦溪笔谈》中记载:信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾。熬胆矾铁釜,久之亦化为铜”。某化学兴趣小组为探究胆矾(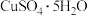 )的热分解产物,设计如图所示装置进行实验:
)的热分解产物,设计如图所示装置进行实验:

已知: 的熔点为16.8℃,沸点为46.8℃;
的熔点为16.8℃,沸点为46.8℃; 的熔点为-72℃,沸点为-10℃.
的熔点为-72℃,沸点为-10℃.
请回答下列问题:
(1)仪器a的名称是____ ,a中的棒香能复燃,说明热分解产物含有_____ (填化学式)。
(2)A中固体由蓝色变为黑色,B中的现象是____ 。
(3)C中冰水的作用是_____ 。
(4)D中品红溶液褪色,E中有 、
、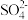 生成,写出E中生成
生成,写出E中生成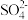 的总的离子方程式:
的总的离子方程式:____ 。
(5)若生成 和
和 的物质的量之比为1:1,则胆矾热分解的化学方程式为
的物质的量之比为1:1,则胆矾热分解的化学方程式为_____ 。
(6)小组同学用滴定法测定某胆矾样品中 的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(
的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(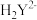 )标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应:
)标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应: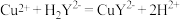 )。
)。
①样品中 的质量分数为
的质量分数为____ %(用含m、V的代数式表示)。
②下列操作会导致 含量的测定结果偏高的是
含量的测定结果偏高的是____ (填选项字母)。
a.未润洗锥形瓶
b.滴定终点时仰视读数
c.滴定终点时滴定管尖嘴中有气泡
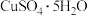 )的热分解产物,设计如图所示装置进行实验:
)的热分解产物,设计如图所示装置进行实验:
已知:
 的熔点为16.8℃,沸点为46.8℃;
的熔点为16.8℃,沸点为46.8℃; 的熔点为-72℃,沸点为-10℃.
的熔点为-72℃,沸点为-10℃.请回答下列问题:
(1)仪器a的名称是
(2)A中固体由蓝色变为黑色,B中的现象是
(3)C中冰水的作用是
(4)D中品红溶液褪色,E中有
 、
、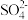 生成,写出E中生成
生成,写出E中生成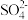 的总的离子方程式:
的总的离子方程式:(5)若生成
 和
和 的物质的量之比为1:1,则胆矾热分解的化学方程式为
的物质的量之比为1:1,则胆矾热分解的化学方程式为(6)小组同学用滴定法测定某胆矾样品中
 的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(
的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(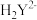 )标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应:
)标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应: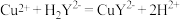 )。
)。①样品中
 的质量分数为
的质量分数为②下列操作会导致
 含量的测定结果偏高的是
含量的测定结果偏高的是a.未润洗锥形瓶
b.滴定终点时仰视读数
c.滴定终点时滴定管尖嘴中有气泡
您最近一年使用:0次
2019-04-26更新
|
773次组卷
|
3卷引用:山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题
山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)【市级联考】湖南省益阳市2019届高三下学期4月模考理科综合化学试题
3 . 氯化亚铜(CuCl)广泛应用于有机合成、染料、颜料、催化剂等工业。它是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸,可溶于氨水、浓盐酸,并生成配合物NH4[CuCl2];能在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是实验室制备氯化亚铜的流程图及实验装置图。
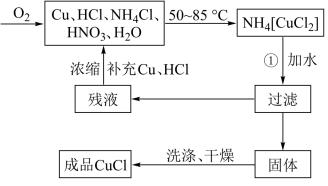
实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
(1)请写出①的化学方程式____________________________________ 。
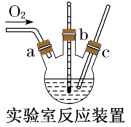
(2)本实验中通入O2的速率不宜过大,宜选择下图中的____ (填字母序号)方案,并说明选择该装置的理由__________________________________________ 。
(3)电炉加热升温至50℃时停止加热,反应快速进行,当烧瓶中液面上方的现象为_____ 时,停止通入氧气,打开瓶塞,沿C口倾出反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出。
(4)关于该实验过程中,下列说法正确的是_________________ 。
A 实验开始时,温度计显示反应液温度可能低于室温。
B 流程中过滤操作,可以采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C 该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D 反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(5)氯化亚铜的定量分析:
①称取成品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2,Fe2+ + Ce4+ = Fe3+ + Ce3+)
④数据处理:计算得CuCl的纯度为__________ 。


实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
(1)请写出①的化学方程式
(2)本实验中通入O2的速率不宜过大,宜选择下图中的

(3)电炉加热升温至50℃时停止加热,反应快速进行,当烧瓶中液面上方的现象为
(4)关于该实验过程中,下列说法正确的是
A 实验开始时,温度计显示反应液温度可能低于室温。
B 流程中过滤操作,可以采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C 该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D 反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(5)氯化亚铜的定量分析:
①称取成品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2,Fe2+ + Ce4+ = Fe3+ + Ce3+)
| 实验序号 | 1 | 2 | 3 |
| 滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
| 滴定终点读数(mL) | 24.70 | 24.95 | 24.85 |
您最近一年使用:0次
2019-08-10更新
|
853次组卷
|
3卷引用:专题13 实验题大题不丢分-2021年高考化学必做热点专题
解题方法
4 . 现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
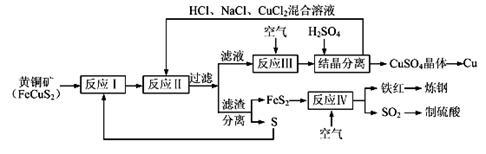
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2[CuCl2]-+S
请回答下列问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是_____________ 、_____________ 。
(2)反应Ⅰ的产物为(填化学式)_____________ 。
(3)反应Ⅲ的离子方程式为_____________ 。
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是_____________ 。
(5)黄铜矿中Fe的化合价为+2,对于反应:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是
8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是_____________ (填字母)。
(6)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:Cr2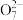 + Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为_____________ 。
②反应Ⅳ所得气体中SO2的体积分数为_____________ 。

注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2[CuCl2]-+S
请回答下列问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是
(2)反应Ⅰ的产物为(填化学式)
(3)反应Ⅲ的离子方程式为
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是
(5)黄铜矿中Fe的化合价为+2,对于反应:8CuFeS2+21O2
 8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是
8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是| A.反应中被还原的元素只有氧 |
| B.反应生成的SO2直接排放会污染环境 |
| C.SO2既是氧化产物又是还原产物 |
| D.当有8mol铜生成时,转移电子数目为100NA |
已知:Cr2
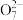 + Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为
②反应Ⅳ所得气体中SO2的体积分数为
您最近一年使用:0次
真题
名校
5 . 氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

回答下列问题:
(1)步骤①中得到的氧化产物是_________ ,溶解温度应控制在60~70度,原因是__________ 。
(2)写出步骤③中主要反应的离子方程式___________ 。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_________ (写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是______________________________ 。
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有__________ (填字母)
(6)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________ 。

回答下列问题:
(1)步骤①中得到的氧化产物是
(2)写出步骤③中主要反应的离子方程式
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是
(4)上述工艺中,步骤⑥不能省略,理由是
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有
| A.分馏塔 | B.离心机 | C.反应釜 | D.框式压滤机 |
(6)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为
您最近一年使用:0次
2015-06-24更新
|
4975次组卷
|
6卷引用:2015年全国普通高等学校招生统一考试化学(新课标I卷)



