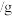名校
1 . 纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,以主要成分为CuFeS2的黄铜矿(含有杂质SiO2)为原料制取纳米Cu2O的一种工艺流程如图所示:

请回答下列问题:
(1)“滤渣1”中含有硫单质及___________ 。
(2)“调pH”的过程中也能用___________ (写出一种物质即可)来代替CuO,要使Fe3+完全沉淀,则溶液的pH至少为___________ (已知该工艺条件下Ksp[Fe(OH)3]≈8×10-38,Kw≈1×10-14,lg2≈0.3,化学上认为当离子浓度小于1×10-5mol·L-1时沉淀完全)。
(3)现代工业也可用铜作电极,电解食盐水制备Cu2O,写出:a.阴极的电极反应式为___________ ;b.制备氧化亚铜的化学方程式为___________ ;c.电解过程中Cl-的浓度___________ 。(填“变小”“变大”“不变”)

请回答下列问题:
(1)“滤渣1”中含有硫单质及
(2)“调pH”的过程中也能用
(3)现代工业也可用铜作电极,电解食盐水制备Cu2O,写出:a.阴极的电极反应式为
您最近一年使用:0次
2021高三·全国·专题练习
2 . 氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
(1)炉气中的有害气体成分是___________ ,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________ 。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:___________ 。当试剂X是___________ 时,更有利于降低生产成本。
(3)写出用N2H4制备Cu2O的化学方程式:___________ ,操作X包括___________ 、洗涤、烘干,其中烘干时要隔绝空气,其目的是___________ 。

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀 | 7.5 | 2.7 | 4.8 |
| 完全沉淀 | 9.0 | 3.7 | 6.4 |
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:
(3)写出用N2H4制备Cu2O的化学方程式:
您最近一年使用:0次
解题方法
3 . 铜在自然界中多以硫化物存在,氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以黄铜矿(主要成分为CuFeS2)为原料制取Cu2O的一种工艺流程如图:

常温下几种金属阳离子开始沉淀与完全沉淀时的pH如表:
(1)把矿石粉碎的目的是_______ ;为了减少炉气污染,可用炉气生产_______ (写化学式),再用于上述工艺。
(2)试剂a可选_______ (填序号);“调pH”应调控的pH范围为_______ 。
A.Cu B.CuO C.CuCO3 D.Cu(OH)2 E.Cu2 (OH)2CO3
(3)“焙烧”后,若Cu、Fe分别呈+2价+3价,写出CuFeS2与O2反应的化学方程式_______ 。
(4)“还原(90℃)”过程发生反应的离子方程式为_______ ;“操作A”包括_______ 、洗涤、隔绝空气烘干。
(5)若用10.00吨含30.00% CuFeS2的矿石生产,假设其它杂质不含铜元素,最后得到Cu2O 0.9504吨,则其产率为_______ (保留四位有效数字)。

常温下几种金属阳离子开始沉淀与完全沉淀时的pH如表:
| Fe2+ | Fe3+ | Cu 2+ | |
| 开始沉淀 | 7.5 | 2.6 | 4.8 |
| 完全沉淀 | 9.5 | 3.3 | 6.4 |
(2)试剂a可选
A.Cu B.CuO C.CuCO3 D.Cu(OH)2 E.Cu2 (OH)2CO3
(3)“焙烧”后,若Cu、Fe分别呈+2价+3价,写出CuFeS2与O2反应的化学方程式
(4)“还原(90℃)”过程发生反应的离子方程式为
(5)若用10.00吨含30.00% CuFeS2的矿石生产,假设其它杂质不含铜元素,最后得到Cu2O 0.9504吨,则其产率为
您最近一年使用:0次
解题方法
4 . 某工业废渣中主要含有 及少量杂质(
及少量杂质( 、
、 、
、 等),从该工业废渣中提取铜的工艺流程如图所示[已知
等),从该工业废渣中提取铜的工艺流程如图所示[已知 与足量
与足量 溶液反应生成
溶液反应生成 ,最终不会有
,最终不会有 ]:
]:
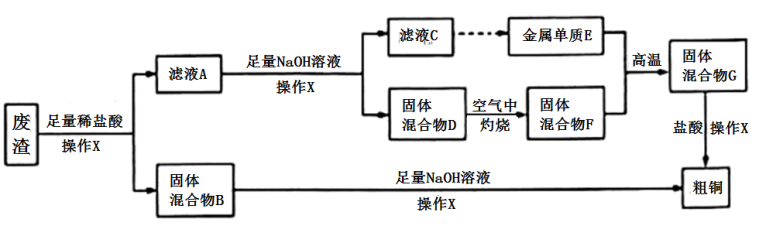
试回答下列问题。
(1)废渣中加入稀盐酸时, 发生
发生 元素自身的氧化还原反应,该反应的离子方程式为
元素自身的氧化还原反应,该反应的离子方程式为____________________________________ 。
(2)滤液 中的金属阳离子为
中的金属阳离子为 、
、 、
、___________ ,固体混合物 中含有的物质是
中含有的物质是____________ (写化学式)。
(3)操作 为常见的实验操作,其操作名称是
为常见的实验操作,其操作名称是_________________ ,在实验室,该操作中使用的玻璃仪器有________________________________________ 。
(4)金属单质 与固体混合物
与固体混合物 的反应常称为
的反应常称为________________ 反应,列举该反应的一种用途:____________________________________ 。
(5)上述方法制备的铜可用来制备铜合金,某铜合金中可能含有 、
、 中的一种,采用下列方法可测定该铜合金的组成。
中的一种,采用下列方法可测定该铜合金的组成。
实验方法:取 铜合金粉末样品放入烧杯中,将
铜合金粉末样品放入烧杯中,将 14.0%的稀硫酸(密度为
14.0%的稀硫酸(密度为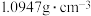 )平均分四次依次加入该烧杯中,每次均充分反应。
)平均分四次依次加入该烧杯中,每次均充分反应。
实验数据记录如下表:
①稀硫酸的物质的量浓度为_____________  。(结果保留两位小数)
。(结果保留两位小数)
②该铜合金中另一种金属是_____________ (填化学式)。
 及少量杂质(
及少量杂质( 、
、 、
、 等),从该工业废渣中提取铜的工艺流程如图所示[已知
等),从该工业废渣中提取铜的工艺流程如图所示[已知 与足量
与足量 溶液反应生成
溶液反应生成 ,最终不会有
,最终不会有 ]:
]:
试回答下列问题。
(1)废渣中加入稀盐酸时,
 发生
发生 元素自身的氧化还原反应,该反应的离子方程式为
元素自身的氧化还原反应,该反应的离子方程式为(2)滤液
 中的金属阳离子为
中的金属阳离子为 、
、 、
、 中含有的物质是
中含有的物质是(3)操作
 为常见的实验操作,其操作名称是
为常见的实验操作,其操作名称是(4)金属单质
 与固体混合物
与固体混合物 的反应常称为
的反应常称为(5)上述方法制备的铜可用来制备铜合金,某铜合金中可能含有
 、
、 中的一种,采用下列方法可测定该铜合金的组成。
中的一种,采用下列方法可测定该铜合金的组成。实验方法:取
 铜合金粉末样品放入烧杯中,将
铜合金粉末样品放入烧杯中,将 14.0%的稀硫酸(密度为
14.0%的稀硫酸(密度为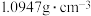 )平均分四次依次加入该烧杯中,每次均充分反应。
)平均分四次依次加入该烧杯中,每次均充分反应。实验数据记录如下表:
实验编号 |
|
|
|
|
加入稀硫酸的质量 | 14.0 | 14.0 | 14.0 | 14.0 |
剩余固体的质量 | 8.7 | 7.4 | 6.1 | 6.0 |
①稀硫酸的物质的量浓度为
 。(结果保留两位小数)
。(结果保留两位小数)②该铜合金中另一种金属是
您最近一年使用:0次
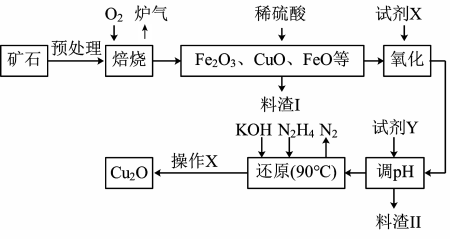
5 . 氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
(1)炉气中的有害气体成分是________ ,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为______ 。
(2)试剂X是H2O2溶液,当试剂X是___________ 时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________ 。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________ (填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________ 。

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
| Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀 | 7.5 | 2.7 | 4.8 |
| 完全沉淀 | 9.0 | 3.7 | 6.4 |
(2)试剂X是H2O2溶液,当试剂X是
(3)加入试剂Y调pH时,pH的调控范围是
(4)“还原”步骤中为提高N2H4转化率可采取的措施有
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是
您最近一年使用:0次
6 . 碱式碳酸铜是一种用途广泛的化工原料,其化学式一般可表示为Cu(OH)2•xCuCO3。某实验小组设计如下几个实验方案,测定碱式碳酸铜的组成,完成下列填空。
[方案一]用如图实验装置进行实验(夹持仪器省略),先通一段时间氮气,然后加热,加热完毕,再通一段时间氮气。

加热完毕再通一段时间氮气的作用是___ 。
若实验取14.200g样品,B装置增重0.900g,C装置增重3.300g,则x=___ 。
[方案二]用如图装置测定碱式碳酸铜与足量稀硫酸反应生成CO2的体积。

为了减小实验误差,量气管中液体M的选择原则是___ 。
通过实验,测得该试样中x值偏低,产生这种现象的原因可能是___
a.CO2气体中含有水蒸气
b.测定气体体积时未冷却至室温
c.Y形管中留有反应生成的气体
d.测定气体体积时水准管的液面高于量气管的液面
[方案三]该小组同学又用如下方案测定碱式碳酸铜的组成。
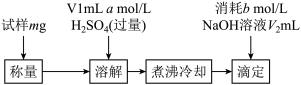
煮沸的目的主要是___ 。
若滴定时NaOH加入过量,则x值___ (填“偏大”、“偏小”或“不变”)
[方案一]用如图实验装置进行实验(夹持仪器省略),先通一段时间氮气,然后加热,加热完毕,再通一段时间氮气。

加热完毕再通一段时间氮气的作用是
若实验取14.200g样品,B装置增重0.900g,C装置增重3.300g,则x=
[方案二]用如图装置测定碱式碳酸铜与足量稀硫酸反应生成CO2的体积。

为了减小实验误差,量气管中液体M的选择原则是
通过实验,测得该试样中x值偏低,产生这种现象的原因可能是
a.CO2气体中含有水蒸气
b.测定气体体积时未冷却至室温
c.Y形管中留有反应生成的气体
d.测定气体体积时水准管的液面高于量气管的液面
[方案三]该小组同学又用如下方案测定碱式碳酸铜的组成。

煮沸的目的主要是
若滴定时NaOH加入过量,则x值
您最近一年使用:0次
7 . 碱式碳酸铜[Cu(OH)2•CuCO3]是一种用途广泛的化工产品,实验室制备碱式碳酸铜的反应原理为:2CuSO4+2Na2CO3+H2O=Cu(OH)2•CuCO3↓+CO2↑+2Na2SO4。回答下列问题:
(1)配制100mL浓度均为0.50mol•L-1的CuSO4溶液和Na2CO3溶液,需要用到的玻璃仪器有量筒、烧杯、胶头滴管和___ 。
(2)取50mL0.50mol•L-1CuSO4溶液加入50mL0.50mol•L-1Na2CO3溶液中,反应后烧杯底部出现大量蓝绿色沉淀。设计实验证明蓝绿色沉淀中混有难溶于水的碱式硫酸铜[Cu2(OH)2SO4],实验步骤是:过滤,___ 。
(3)按最佳配比 n(CuSO4)︰n(Na2CO3)=1︰1.2进行实验,反应15min,所得实验结果如下:
分析75℃时沉淀量最多的原因:___ 。
(4)查阅资料可知碱式碳酸铜的组成有多种,可用xCu(OH)2•yCuCO3表示。某小组利用以下装置测定某碱式碳酸铜样品的组成:

①A中发生反应的化学方程式是___ 。
②加热时持续通入N2的目的是___ 。
③称取32.0g样品,充分反应后得到24.0g残留物,B增重3.6g,C增重4.4g。该样品的化学式为___ 。若对调B和C装置的位置,___ (填“能”或“不能”)测算出该样品的化学式。
(1)配制100mL浓度均为0.50mol•L-1的CuSO4溶液和Na2CO3溶液,需要用到的玻璃仪器有量筒、烧杯、胶头滴管和
(2)取50mL0.50mol•L-1CuSO4溶液加入50mL0.50mol•L-1Na2CO3溶液中,反应后烧杯底部出现大量蓝绿色沉淀。设计实验证明蓝绿色沉淀中混有难溶于水的碱式硫酸铜[Cu2(OH)2SO4],实验步骤是:过滤,
(3)按最佳配比 n(CuSO4)︰n(Na2CO3)=1︰1.2进行实验,反应15min,所得实验结果如下:
| 温度/℃ | 60 | 65 | 75 | 80 | 90 |
| 沉淀量/g | 1.295 | 1.303 | 1.451 | 1.340 | 1.292 |
分析75℃时沉淀量最多的原因:
(4)查阅资料可知碱式碳酸铜的组成有多种,可用xCu(OH)2•yCuCO3表示。某小组利用以下装置测定某碱式碳酸铜样品的组成:

①A中发生反应的化学方程式是
②加热时持续通入N2的目的是
③称取32.0g样品,充分反应后得到24.0g残留物,B增重3.6g,C增重4.4g。该样品的化学式为
您最近一年使用:0次
解题方法
8 . 铜单质及其化合物在很多领域有重要的用途.
(一)如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
(1)超细铜粉的某制备方法如下:

 中所含的化学键有
中所含的化学键有 ______ .
(2)氯化亚铜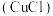 的制备过程是:向
的制备过程是:向 溶液中通入一定量
溶液中通入一定量 ,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为
,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
(二)波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知 的部分结构可表示如下:
的部分结构可表示如下:
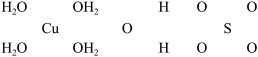
(1)写出铜原子价电子层的电子排布式______ ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有 ______  填元素符号
填元素符号 .
.
(2)请在上图中把 结构中的化学键用短线“--”表示出来.
结构中的化学键用短线“--”表示出来.______
(3)往浓 溶液中加入过量较浓的
溶液中加入过量较浓的 直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的
直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的 并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色
并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色 晶体.实验中所加
晶体.实验中所加 的作用是
的作用是 ______ .
(4) 晶体中呈正四面体的原子团是
晶体中呈正四面体的原子团是 ______ ,杂化轨道类型是 杂化的原子是
杂化的原子是 ______ .
(一)如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和
 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等. (1)超细铜粉的某制备方法如下:

 中所含的化学键有
中所含的化学键有 (2)氯化亚铜
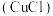 的制备过程是:向
的制备过程是:向 溶液中通入一定量
溶液中通入一定量 ,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为
,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 (二)波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知
 的部分结构可表示如下:
的部分结构可表示如下: 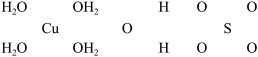
(1)写出铜原子价电子层的电子排布式
 填元素符号
填元素符号 .
.(2)请在上图中把
 结构中的化学键用短线“--”表示出来.
结构中的化学键用短线“--”表示出来.(3)往浓
 溶液中加入过量较浓的
溶液中加入过量较浓的 直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的
直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的 并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色
并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色 晶体.实验中所加
晶体.实验中所加 的作用是
的作用是 (4)
 晶体中呈正四面体的原子团是
晶体中呈正四面体的原子团是  杂化的原子是
杂化的原子是
您最近一年使用:0次
2020-02-26更新
|
95次组卷
|
2卷引用:2020届高三化学二轮复习实验题必练-铜及其化合物