1 . 已知水合肼(N2H4·H2O)为无色透明的油状液体,沸点为120.1℃,有毒且不稳定,在300℃时分解成N2、NH3、H2和H2O,有淡氨味,具有强碱性、强还原性和吸湿性。某小组为探究其性质进行以下实验。
Ⅰ.水合肼的实验室制备。
用NaClO碱性溶液与尿素[CO(NH2)2]水溶液在40℃时反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼,装置如图所示(加热及夹持装置略)。

(1)反应时应向三颈烧瓶中逐滴滴加NaClO碱性溶液,防止其过量,其原因是_______ 。
(2)三颈烧瓶中反应的离子方程式为_______ 。
Ⅱ.探究水合肼的分解产物。
该小组成员利用下列装置(夹持装置略)热分解水合肼,并对分解产物( N2、H2、NH3、H2O)进行探究。
(3)C中盛放的试剂为_______ 。E中少量铜粉的作用是_______ 。
(4)检查装置气密性后,加热装置E前需要进行的操作是_______ 。
(5)实验过程中观察到的现象:G中无现象,H中_______ ,Ⅰ中_______ 。
(6)N中当_______ 时开始收集气体,若最后检验所收集的气体为N2,能否说明是水合肼热分解产生的?并说明理由:_______ 。
Ⅰ.水合肼的实验室制备。
用NaClO碱性溶液与尿素[CO(NH2)2]水溶液在40℃时反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼,装置如图所示(加热及夹持装置略)。

(1)反应时应向三颈烧瓶中逐滴滴加NaClO碱性溶液,防止其过量,其原因是
(2)三颈烧瓶中反应的离子方程式为
Ⅱ.探究水合肼的分解产物。
该小组成员利用下列装置(夹持装置略)热分解水合肼,并对分解产物( N2、H2、NH3、H2O)进行探究。

(3)C中盛放的试剂为
(4)检查装置气密性后,加热装置E前需要进行的操作是
(5)实验过程中观察到的现象:G中无现象,H中
(6)N中当
您最近一年使用:0次
21-22高三上·全国·阶段练习
2 . 某化学兴趣小组用氧化铜制备配位化合物[Cu(NH3)x]SO4·H2O(亮蓝色),并测定该配合物的配位数。
Ⅰ.制备[Cu(NH3)x]SO4·H2O的过程:
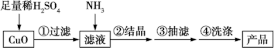
已知:2CuSO4+2NH3·H2O=(NH4)2SO4 +Cu2(OH)2SO4↓(蓝色)
Cu2(OH)2SO4+2xNH3 2[Cu(NH3)x]2++
2[Cu(NH3)x]2++ +2OH−
+2OH−
回答下列问题:
(1)为加快氧化铜的溶解速率,可采用的方法是___________ (回答两种)。
(2)所用的氨气可采用下列装置中的___________ (填字母)制备,相应的制备原理为
___________ (写化学方程式)。
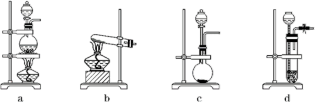
(3)当出现___________  现象时,停止通入氨气。
现象时,停止通入氨气。
(4)在步骤②中,倒入95%酒精,静置一段时间,出现大量蓝色晶体,原因是___________ 。
(5)在步骤④中,加入浓氨水洗涤沉淀的目的是___________ 。
Ⅱ.测定[Cu(NH3)x]SO4·H2O的配位数,装置如下:
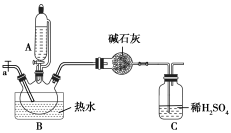
实验操作:称量反应前装置C的质量为327.65 g;取12.30 g产品加入三颈瓶中,加入氢氧化钠溶液,并加热;反应过程中从a通入空气;一段时间后装置C的质量为恒重331.05 g。
(6)根据上述数据计算该配合物的配位数x=___________ ,若反应过程中没有通入空气,则会造成所测结果___________ (填“偏高”“偏低”或“无影响”)。
Ⅰ.制备[Cu(NH3)x]SO4·H2O的过程:
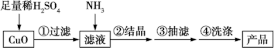
已知:2CuSO4+2NH3·H2O=(NH4)2SO4 +Cu2(OH)2SO4↓(蓝色)
Cu2(OH)2SO4+2xNH3
 2[Cu(NH3)x]2++
2[Cu(NH3)x]2++ +2OH−
+2OH−回答下列问题:
(1)为加快氧化铜的溶解速率,可采用的方法是
(2)所用的氨气可采用下列装置中的
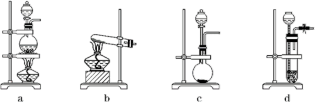
(3)当出现
 现象时,停止通入氨气。
现象时,停止通入氨气。(4)在步骤②中,倒入95%酒精,静置一段时间,出现大量蓝色晶体,原因是
(5)在步骤④中,加入浓氨水洗涤沉淀的目的是
Ⅱ.测定[Cu(NH3)x]SO4·H2O的配位数,装置如下:

实验操作:称量反应前装置C的质量为327.65 g;取12.30 g产品加入三颈瓶中,加入氢氧化钠溶液,并加热;反应过程中从a通入空气;一段时间后装置C的质量为恒重331.05 g。
(6)根据上述数据计算该配合物的配位数x=
您最近一年使用:0次
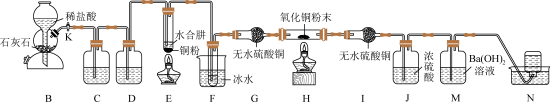
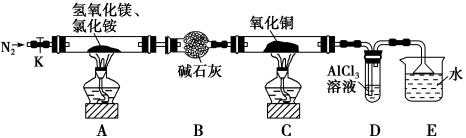
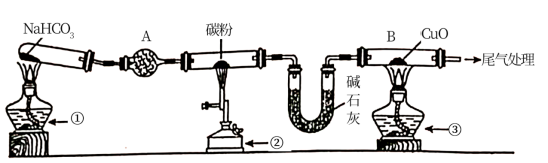
3 . 碱式氯化镁(MgOHCl)常用作塑料添加剂,工业上制备方法较多,其中利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁的工艺属于我国首创。某中学科研小组根据该原理设计如下装置图进行相关实验,装置C中CuO的质量为8.0 g。
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为:_____________________________ 。
(2)装置D中生成沉淀,发生反应的离子方程式为_________________________________ 。
(3)反应过程中持续通入N2的作用有两点:一是: 将装置A中产生的氨气完全导出,二是:_______________________________ 。
(4)若测得碱石灰的质量增加了a g,则得到碱式氯化镁的质量为_______ g。
(5)反应完毕,装置C中的氧化铜全部由黑色变为红色,称其质量为6.8 g,且生成的气体可直接排放到大气中,则红色固体是_______ ,该反应中转移电子的物质的量为_______ mol。
(6)请你设计一个实验方案证明装置C中的氧化铜反应完全后得到的红色固体中含有氧化亚铜。已知:①Cu2O+2H+===Cu2++Cu+H2O
②限选试剂:2 mol·L-1H2SO4溶液、浓硫酸、2 mol·L-1HNO3溶液、10 mol·L-1 HNO3溶液

请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为:
(2)装置D中生成沉淀,发生反应的离子方程式为
(3)反应过程中持续通入N2的作用有两点:一是: 将装置A中产生的氨气完全导出,二是:
(4)若测得碱石灰的质量增加了a g,则得到碱式氯化镁的质量为
(5)反应完毕,装置C中的氧化铜全部由黑色变为红色,称其质量为6.8 g,且生成的气体可直接排放到大气中,则红色固体是
(6)请你设计一个实验方案证明装置C中的氧化铜反应完全后得到的红色固体中含有氧化亚铜。已知:①Cu2O+2H+===Cu2++Cu+H2O
②限选试剂:2 mol·L-1H2SO4溶液、浓硫酸、2 mol·L-1HNO3溶液、10 mol·L-1 HNO3溶液
| 实验步骤 | 预期现象和结论 |
| 步骤1:取反应后装置C中的少许固体于试管中 | |
| 步骤2: |
您最近一年使用:0次
2018-12-05更新
|
380次组卷
|
4卷引用:微专题16 镁及其化合物的性质与海水提取镁的工艺流程-备战2022年高考化学考点微专题
(已下线)微专题16 镁及其化合物的性质与海水提取镁的工艺流程-备战2022年高考化学考点微专题【全国百强校】山东省济南市第一中学2019届高三上学期期中考试化学试题山东省德州市夏津县第一中学2019届高三上学期12月月考化学试题【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题
名校
解题方法
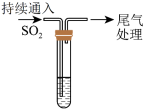
4 . 某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如下:
已知:CuCl为白色固体,难溶于水,能溶于浓盐酸。下列说法不正确的是
| 装置 |
| |
| 序号 | 试管中的药品 | 现象 |
| 实验Ⅰ | 1.5mL1mol·L-1CuSO4溶液和3.5mL1mol·L-1NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| 实验Ⅱ | 1.5mL1mol·L-1CuCl2溶液和3.5mL1mol·L-1NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
| A.取少量Cu2O固体于试管中,加入5mL0.1mol·L-1NaOH溶液,持续通入SO2,若试管底部有少量紫红色固体,溶液呈绿色,证明实验Ⅰ中砖红色沉淀为Cu2O |
| B.将实验Ⅱ中白色沉淀洗涤干净后,加入浓盐酸,沉淀溶解,然后加入蒸馏水,产生白色沉淀,证明白色沉淀为CuCl |
| C.实验Ⅱ与实验Ⅰ现象不同是因为阴离子不同造成的 |
D.实验Ⅰ、Ⅱ中不一定生成了SO |
您最近一年使用:0次
5 . 硫酸亚铁铵是一种重要的化工原料,用途十分广泛。在无机化学工业中,它是制取其它铁化合物的原料,如用于制造氧化铁系颜料、磁性材料、黄血盐和其他铁盐等。
[查阅资料]隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气。某化学小组选用如图所示部分装置进行实验(夹持装置略),验证分解产物中含有氨气和水蒸气。
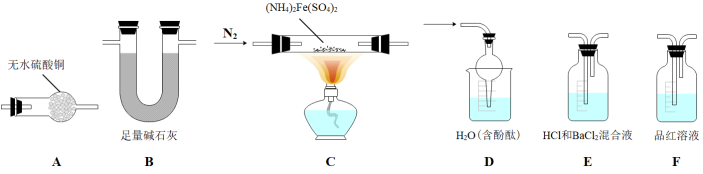
(1)加热之前应该先通氮气,防止空气中的_______ 干扰实验。
(2)所选用装置的正确连接顺序为_______ (填装置序号)。
(3)证明有水蒸气生成的实验现象为_______ 。
(4)证明有氨气生成的实验现象为_______ 。
(5)经检验C 中分解后只有红棕色粉末,用试管取少许与氢碘酸混合后,再加入少量的四氯化碳振荡,下层出现的现象为_______ ,该反应的离子方程式为_______ 。
(6)写出该实验中硫酸亚铁铵受热分解的化学方程式_______ 。
[查阅资料]隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气。某化学小组选用如图所示部分装置进行实验(夹持装置略),验证分解产物中含有氨气和水蒸气。

(1)加热之前应该先通氮气,防止空气中的
(2)所选用装置的正确连接顺序为
(3)证明有水蒸气生成的实验现象为
(4)证明有氨气生成的实验现象为
(5)经检验C 中分解后只有红棕色粉末,用试管取少许与氢碘酸混合后,再加入少量的四氯化碳振荡,下层出现的现象为
(6)写出该实验中硫酸亚铁铵受热分解的化学方程式
您最近一年使用:0次
名校
解题方法
6 . 在实验室制取乙烯时,其反应为CH3CH2OH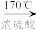 CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。
CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。
(1)仪器a的名称为___ 。
(2)请根据实验的要求完成下列填空:
①B中可观察到的现象为___ 。
②D中的试剂为___ 。
③E中的试剂为__ ,其作用为___ 。
④F中的试剂为___ ,可能的实验现象为___ 。
(3)简述装置B置于装置A、C之间的理由:___ 。
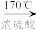 CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。
CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。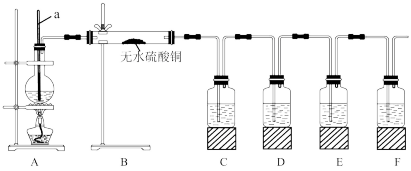
(1)仪器a的名称为
(2)请根据实验的要求完成下列填空:
①B中可观察到的现象为
②D中的试剂为
③E中的试剂为
④F中的试剂为
(3)简述装置B置于装置A、C之间的理由:
您最近一年使用:0次
2021-10-29更新
|
491次组卷
|
3卷引用:【石家庄新东方】河北省沧衡八校联盟2020-2021学年高一下学期期中考试化学试题
7 . 某实验小组对 溶液分别与
溶液分别与 、
、 溶液的反应进行探究。
溶液的反应进行探究。
已知:Ⅰ.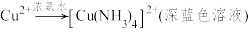
Ⅱ.
回答下列问题:
(1)推测实验Ⅰ中的无色气体为 ,实验验证:用湿润的品红试纸接近试管口,视察到
,实验验证:用湿润的品红试纸接近试管口,视察到___________ ,将品红试纸在烘箱中低温烘干又观察到___________ 。
(2)推测实验Ⅰ中的白色沉淀为 ,实验验证步骤如下:
,实验验证步骤如下:
①实验Ⅰ完成后,立即过滤、洗涤。
②取少量已洗净的白色沉淀于试管中,滴加足量浓氨水,先观察到___________ ,反应的离子方程式为___________ ;露置一段时间,又观察到___________ 。
(3)对比实验Ⅰ、Ⅱ,提出假设, 增强了
增强了 的氧化性。
的氧化性。
①若假设合理,实物Ⅰ反应的离子方程式为___________ 和 。
。
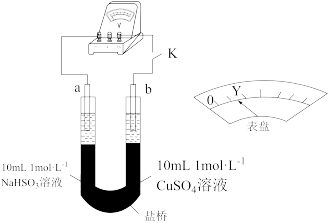
②用以下实验来验证假设合理,装置如图所示。实验方案:闭合K,电压表的指针偏转至“Y”处;向U形管___________ (补全实验操作及现象)。
(4)将实验Ⅱ的溶液静置24h或加热后,得到红色沉淀。经检验,红色沉淀中含有 、
、 和
和 。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有
。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有 和
和 。
。
实验Ⅲ:
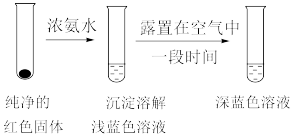
①甲同学认为红色沉淀中含有 ,他判断的理由是
,他判断的理由是___________ 。
②乙同学认为实验Ⅲ不足以证实红色沉淀中含有 ,理由是
,理由是___________ 。
 溶液分别与
溶液分别与 、
、 溶液的反应进行探究。
溶液的反应进行探究。| 实验 | 装置 | 试剂a | 操作及现象 |
| I |   溶液 溶液 |  溶液 溶液 | 加入 溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
| Ⅱ |  溶液 溶液 | 加入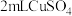 溶液,得到绿色溶液, 溶液,得到绿色溶液, 未见明显变化。 未见明显变化。 |
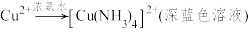
Ⅱ.

回答下列问题:
(1)推测实验Ⅰ中的无色气体为
 ,实验验证:用湿润的品红试纸接近试管口,视察到
,实验验证:用湿润的品红试纸接近试管口,视察到(2)推测实验Ⅰ中的白色沉淀为
 ,实验验证步骤如下:
,实验验证步骤如下:①实验Ⅰ完成后,立即过滤、洗涤。
②取少量已洗净的白色沉淀于试管中,滴加足量浓氨水,先观察到
(3)对比实验Ⅰ、Ⅱ,提出假设,
 增强了
增强了 的氧化性。
的氧化性。①若假设合理,实物Ⅰ反应的离子方程式为
 。
。②用以下实验来验证假设合理,装置如图所示。实验方案:闭合K,电压表的指针偏转至“Y”处;向U形管

(4)将实验Ⅱ的溶液静置24h或加热后,得到红色沉淀。经检验,红色沉淀中含有
 、
、 和
和 。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有
。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有 和
和 。
。实验Ⅲ:
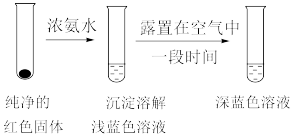
①甲同学认为红色沉淀中含有
 ,他判断的理由是
,他判断的理由是②乙同学认为实验Ⅲ不足以证实红色沉淀中含有
 ,理由是
,理由是
您最近一年使用:0次
8 . 为探究CO还原CuO的固体产物成分,某同学用以下装置(夹持装置已省略)进行有关实验:
已知:Cu2O+H2SO4=CuSO4+Cu+H2O
请回答:
(1)装置A的作用是___ 。
(2)点燃①、②、③的先后顺序是①→____ →____ 。
(3)反应一段时间后,取仪器B中少量固体,加入稀H2SO4,溶液变蓝色且有红色不溶性固体。据此现象能否说明反应产物中含Cu2O?___ (填“能”或“不能”),理由是___ 。

已知:Cu2O+H2SO4=CuSO4+Cu+H2O
请回答:
(1)装置A的作用是
(2)点燃①、②、③的先后顺序是①→
(3)反应一段时间后,取仪器B中少量固体,加入稀H2SO4,溶液变蓝色且有红色不溶性固体。据此现象能否说明反应产物中含Cu2O?
您最近一年使用:0次
2021-05-21更新
|
325次组卷
|
5卷引用:【浙江新东方】高中化学20210513-022【2021】【高一下】
(已下线)【浙江新东方】高中化学20210513-022【2021】【高一下】(已下线)【浙江新东方】双师304高一下浙江省2020年7月普通高中学业水平考试化学试题浙江省上海外国语大学附属宏达高级中学2020-2021学年高二10月月考化学试题浙江省平阳县万全综合高级中学2021-2022学年高一下学期期中考试化学试题
9 . 胆矾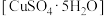 可做游泳池的消毒剂,其在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在
可做游泳池的消毒剂,其在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在 时隔绝空气加热A,至胆矾分解完全,确定分解产物的成分(试剂均足量)。
时隔绝空气加热A,至胆矾分解完全,确定分解产物的成分(试剂均足量)。
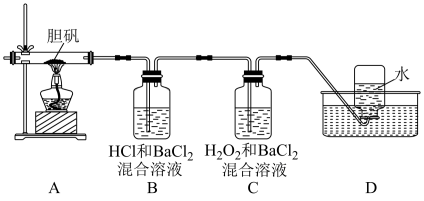
(1)B装置中 的作用是
的作用是___________ 。
(2)实验中,观察到B中有白色沉淀生成,C中无明显变化,可确定产物中一定有___________ 气体产生,写出B中发生反应的离子方程式___________ 。
(3)推测D中收集到的气体是___________ ,其检验方法为___________ 。
(4)A中固体完全分解后变为红色粉末,某同学设计实验验证固体残留物仅为 ,而不含
,而不含 ,请帮他完成表中内容。已知:
,请帮他完成表中内容。已知: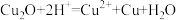 (试剂,仪器和用品自选)。
(试剂,仪器和用品自选)。
(5)结合上述实验现象,写出胆矾在 时隔绝空气加热完全分解的化学方程式
时隔绝空气加热完全分解的化学方程式____ 。
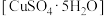 可做游泳池的消毒剂,其在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在
可做游泳池的消毒剂,其在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在 时隔绝空气加热A,至胆矾分解完全,确定分解产物的成分(试剂均足量)。
时隔绝空气加热A,至胆矾分解完全,确定分解产物的成分(试剂均足量)。
(1)B装置中
 的作用是
的作用是(2)实验中,观察到B中有白色沉淀生成,C中无明显变化,可确定产物中一定有
(3)推测D中收集到的气体是
(4)A中固体完全分解后变为红色粉末,某同学设计实验验证固体残留物仅为
 ,而不含
,而不含 ,请帮他完成表中内容。已知:
,请帮他完成表中内容。已知: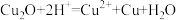 (试剂,仪器和用品自选)。
(试剂,仪器和用品自选)。| 实验步骤 | 实验预期 | 实验结论 |
准确称取 红色固体,加入足量 红色固体,加入足量 | 固体残留物仅为 |
 时隔绝空气加热完全分解的化学方程式
时隔绝空气加热完全分解的化学方程式
您最近一年使用:0次
名校
解题方法
10 . CuCl可用作有机合成的催化剂。工业上用黄铜矿(主要成分是CuFeS2,还含有少量SiO2)制备CuCl的工艺流程如下:
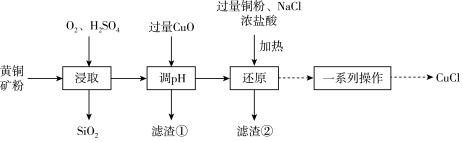
回答下列问题:
(1) 的电子排布式是:
的电子排布式是:_______ 。
(2)“浸取”时,硫元素转化为硫酸根离子,则反应的离子方程式为_______ 。
(3)“滤渣①”的成分是_______ (填化学式)
(4)已知在水溶液中存在平衡: (无色)。“还原”时使用浓盐酸和
(无色)。“还原”时使用浓盐酸和 固体的原因是
固体的原因是_______ ;当出现_______ 现象时,表明“还原”进行完全。
(5)制备 。请补充由还原所得的滤液液制备
。请补充由还原所得的滤液液制备 的操作步骤:
的操作步骤:_______ ,真空干燥。[已知 是一种难溶于水和乙醇的白色固体,潮湿时易被氧化。实验中必须使用的试剂:水、
是一种难溶于水和乙醇的白色固体,潮湿时易被氧化。实验中必须使用的试剂:水、 、
、 、
、 ]。
]。

回答下列问题:
(1)
 的电子排布式是:
的电子排布式是:(2)“浸取”时,硫元素转化为硫酸根离子,则反应的离子方程式为
(3)“滤渣①”的成分是
(4)已知在水溶液中存在平衡:
 (无色)。“还原”时使用浓盐酸和
(无色)。“还原”时使用浓盐酸和 固体的原因是
固体的原因是(5)制备
 。请补充由还原所得的滤液液制备
。请补充由还原所得的滤液液制备 的操作步骤:
的操作步骤: 是一种难溶于水和乙醇的白色固体,潮湿时易被氧化。实验中必须使用的试剂:水、
是一种难溶于水和乙醇的白色固体,潮湿时易被氧化。实验中必须使用的试剂:水、 、
、 、
、 ]。
]。
您最近一年使用:0次
2021-09-15更新
|
383次组卷
|
2卷引用:江苏省如东高级中学2022届高三第一次学情检测化学试题