名校
解题方法
1 . 已知①有些离子带颜色,如 (紫色)、Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色);
(紫色)、Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色);
②常温下,pH<7的溶液显酸性;pH=7的溶液显中性;pH>7的溶液显碱性;
③碳酸氢钠溶液既能和盐酸、又能和氢氧化钠溶液发生离子反应: +H+=CO2↑+H2O、
+H+=CO2↑+H2O、 +OH-=
+OH-= +H2O。
+H2O。
在pH=1的无色溶液中,可以大量共存的离子组是
 (紫色)、Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色);
(紫色)、Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色);②常温下,pH<7的溶液显酸性;pH=7的溶液显中性;pH>7的溶液显碱性;
③碳酸氢钠溶液既能和盐酸、又能和氢氧化钠溶液发生离子反应:
 +H+=CO2↑+H2O、
+H+=CO2↑+H2O、 +OH-=
+OH-= +H2O。
+H2O。在pH=1的无色溶液中,可以大量共存的离子组是
A.Cu2+、 、H+、Cl- 、H+、Cl- | B.Fe3+、 、OH-、K+ 、OH-、K+ |
C. 、 、 、Na+、Ba2+ 、Na+、Ba2+ | D. 、K+、Cl-、 、K+、Cl-、 |
您最近一年使用:0次
2022-11-04更新
|
240次组卷
|
2卷引用:北京市怀柔区第一中学2023-2024学年高一上学期期中考试化学试题
解题方法
2 . 回答下列问题:
(1)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即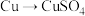 ;
;
方案乙:由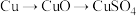 。
。
这两种方案,你认为哪一种方案更合理?_______ ,理由是_______ 。
(2)氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:
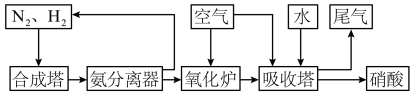
①合成塔中发生反应的化学方程式为_______ 。
②向吸收塔中通入空气的作用是_______ 。
③氧化炉中发生反应的化学方程式为_______ 。标准状况下,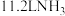 被氧化为
被氧化为 时转移电子的数目为
时转移电子的数目为_______ 。
④吸收塔中出来的尾气 可用具有碱性的
可用具有碱性的 溶液吸收,其中
溶液吸收,其中 既是氧化剂又是还原剂,且三种产物的物质的量之比为1∶1∶1,写出反应的化学方程式:
既是氧化剂又是还原剂,且三种产物的物质的量之比为1∶1∶1,写出反应的化学方程式:_______ 。
(1)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即
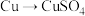 ;
;方案乙:由
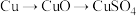 。
。这两种方案,你认为哪一种方案更合理?
(2)氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:

①合成塔中发生反应的化学方程式为
②向吸收塔中通入空气的作用是
③氧化炉中发生反应的化学方程式为
 被氧化为
被氧化为 时转移电子的数目为
时转移电子的数目为④吸收塔中出来的尾气
 可用具有碱性的
可用具有碱性的 溶液吸收,其中
溶液吸收,其中 既是氧化剂又是还原剂,且三种产物的物质的量之比为1∶1∶1,写出反应的化学方程式:
既是氧化剂又是还原剂,且三种产物的物质的量之比为1∶1∶1,写出反应的化学方程式:
您最近一年使用:0次
3 . 经检测某工厂的酸性废水中所含离子及其浓度如表所示:
(1)c(H+)=_______ mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如图流程,回收铜和绿矾(FeSO4·7H2O)。

①工业废水中加入铁粉生成固体C时发生反应的离子方程为:_______ 。
②试剂B的化学式是_______ 。
③上述100L废水经处理,可获得FeSO4·7H2O的物质的量是_______ mol。
④在含有4molFeSO4的溶液中加入4molNa2O2现象是_______ ;已知反应物恰好完全反应且反应转移6mol电子,生成的气体标况下的体积为_______ L。
| 离子 | Fe3+ | Cu2+ | SO | Na+ | H+ |
| 浓度/(mol/L) | 2×10-2 | 1×10-2 | 1×10-1 | 2×10-2 |
(2)为了减少污染并变废为宝,工程师们设计了如图流程,回收铜和绿矾(FeSO4·7H2O)。

①工业废水中加入铁粉生成固体C时发生反应的离子方程为:
②试剂B的化学式是
③上述100L废水经处理,可获得FeSO4·7H2O的物质的量是
④在含有4molFeSO4的溶液中加入4molNa2O2现象是
您最近一年使用:0次
4 . 工业上由含铜废料(含有 、
、 、
、 等)制备硝酸铜晶体的流程如图:
等)制备硝酸铜晶体的流程如图:
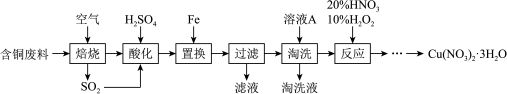
(1)写出CuS“焙烧”生成SO2和CuO的化学反应方程式:_______
(2)“过滤”后需洗涤沉淀,请设计实验证明已洗涤干净_______
(3)“淘洗”所用的溶液A应选用_______ (填序号)a.稀硫酸b.浓硫酸c.稀硝酸d.浓硝酸
(4)“反应”步骤加10%H2O2可以避免污染性气体的产生,写出该反应的离子方程式:_______ ,也可以用气体_______ (填化学式)代替双氧水
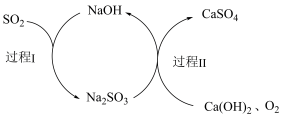
(5)大量排放SO2容易造成酸雨等环境问题,工业上可用双碱脱硫法处理废气,过程如图所示,写出双碱脱硫法的总反应方程式:_______
(6)已知:混合气体为SO2与N2的混合气体,为测定SO2在混合气体中的体积分数,实验小组设计了如图实验方案:
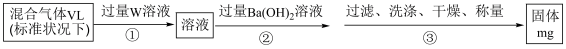
①W溶液可以是_______ (填标号)。
a.H2O2溶液 b.酸性KMnO4溶液 c.氯水
②该混合气体中气体SO2的体积分数为_______ (用含V、m的式子表示)
 、
、 、
、 等)制备硝酸铜晶体的流程如图:
等)制备硝酸铜晶体的流程如图:
(1)写出CuS“焙烧”生成SO2和CuO的化学反应方程式:
(2)“过滤”后需洗涤沉淀,请设计实验证明已洗涤干净
(3)“淘洗”所用的溶液A应选用
(4)“反应”步骤加10%H2O2可以避免污染性气体的产生,写出该反应的离子方程式:
(5)大量排放SO2容易造成酸雨等环境问题,工业上可用双碱脱硫法处理废气,过程如图所示,写出双碱脱硫法的总反应方程式:

(6)已知:混合气体为SO2与N2的混合气体,为测定SO2在混合气体中的体积分数,实验小组设计了如图实验方案:
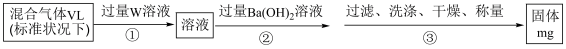
①W溶液可以是
a.H2O2溶液 b.酸性KMnO4溶液 c.氯水
②该混合气体中气体SO2的体积分数为
您最近一年使用:0次
5 . 某小组设计实验证明乙醇和钠反应产生氢气,并探究氧化铜的还原产物。
已知:① 。
。
②红色粉末 在酸性条件下发生歧化反应:
在酸性条件下发生歧化反应: 。
。
装置如图所示:
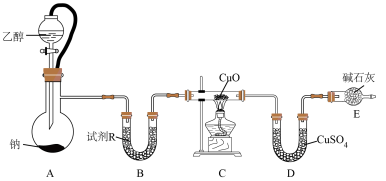
回答下列问题:
(1)试剂R最好选择__________(填字母)。
(2)装置E的作用是__________ 。
(3)实验完毕后,为了探究C中红色粉末是否含有 ,设计下列两种方案:
,设计下列两种方案:
方案1:取少量红色粉末于试管,加入足量溶液M,充分振荡,若溶液变蓝色,则红色粉末一定含 ;
;
方案2:取ag红色粉末,在加热条件下通入足量氢气,充分反应后,冷却、称重,红色固体质量为xg。
①方案1中M可能是__________ 。
A.稀硝酸 B.稀硫酸 C.浓硫酸 D.浓硝酸
②方案2中,当
__________ 时,红色粉末全部是 。
。
(4)分析与讨论。
①CuO被 、
、 、CO等还原可能生成
、CO等还原可能生成 或Cu,生成
或Cu,生成 的可能原因是
的可能原因是__________ 。
A.通入 量不足 B.
量不足 B. 与CuO接触充分
与CuO接触充分
C.温度较低 D.温度过高
②若缺少装置B,C中黑色粉末变红色,D中白色粉末变蓝色,不能肯定A中一定生成了 ,用化学方程式表达其理由
,用化学方程式表达其理由__________ 。
已知:①
 。
。②红色粉末
 在酸性条件下发生歧化反应:
在酸性条件下发生歧化反应: 。
。装置如图所示:

回答下列问题:
(1)试剂R最好选择__________(填字母)。
| A.碱石灰 | B.无水氯化钙 | C.五氧化二磷 | D.硫酸镁 |
(3)实验完毕后,为了探究C中红色粉末是否含有
 ,设计下列两种方案:
,设计下列两种方案:方案1:取少量红色粉末于试管,加入足量溶液M,充分振荡,若溶液变蓝色,则红色粉末一定含
 ;
;方案2:取ag红色粉末,在加热条件下通入足量氢气,充分反应后,冷却、称重,红色固体质量为xg。
①方案1中M可能是
A.稀硝酸 B.稀硫酸 C.浓硫酸 D.浓硝酸
②方案2中,当

 。
。(4)分析与讨论。
①CuO被
 、
、 、CO等还原可能生成
、CO等还原可能生成 或Cu,生成
或Cu,生成 的可能原因是
的可能原因是A.通入
 量不足 B.
量不足 B. 与CuO接触充分
与CuO接触充分C.温度较低 D.温度过高
②若缺少装置B,C中黑色粉末变红色,D中白色粉末变蓝色,不能肯定A中一定生成了
 ,用化学方程式表达其理由
,用化学方程式表达其理由
您最近一年使用:0次
名校
解题方法
6 . 在实验室制取乙烯时,其反应为CH3CH2OH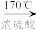 CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。
CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。
(1)仪器a的名称为___ 。
(2)请根据实验的要求完成下列填空:
①B中可观察到的现象为___ 。
②D中的试剂为___ 。
③E中的试剂为__ ,其作用为___ 。
④F中的试剂为___ ,可能的实验现象为___ 。
(3)简述装置B置于装置A、C之间的理由:___ 。
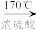 CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。
CH2=CH2↑+H2O。该实验常因温度控制不当而发生副反应生成SO2、CO2、水蒸气等。实验室设计如下实验装置以验证上述反应生成的混合气体中含乙烯、SO2和水蒸气。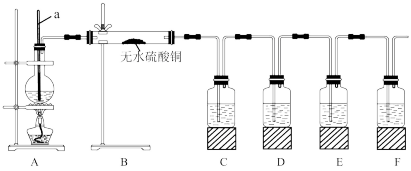
(1)仪器a的名称为
(2)请根据实验的要求完成下列填空:
①B中可观察到的现象为
②D中的试剂为
③E中的试剂为
④F中的试剂为
(3)简述装置B置于装置A、C之间的理由:
您最近一年使用:0次
2021-10-29更新
|
665次组卷
|
3卷引用:湖南省邵东市第三中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
7 . 氧化亚铜(Cu2O)是船舶防污剂的首选,可利用印刷电路板酸性蚀刻液( 、Cl-、H+)和碱性蚀刻液[Cu(NH3)4]2+、NH4+、NH3、Cl-]来制备,工艺流程如下:
、Cl-、H+)和碱性蚀刻液[Cu(NH3)4]2+、NH4+、NH3、Cl-]来制备,工艺流程如下:
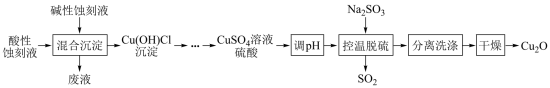
已知:强酸条件下,2Cu+=Cu+Cu2+
(1)不同pH下“混合沉淀”实验结果见下表。由表可知,pH应控制在______ 左右。
(2)“混合沉淀”中废液的主要成分为______________ (填化学式)
(3)“控温脱硫”生成 Cu2O的离子方程式为_________ ;该过程产生的SO2经_____ (填化学式)处理后生成可循环物质Na2SO3。
(4)“控温脱硫”过程中温度对 Cu2O的产率影响及SO2在水中溶解度随温度变化如图所示:
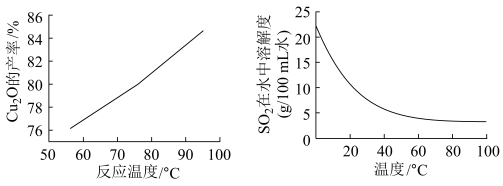
下列说法正确的是_____
a.在60℃以下,温度越高,SO2越易逸出,有利于提高生产中硫原子利用率
b.反应温度的变化是影响Cu2O产率的主要因素
c.结合工业生产实际,温度应控制在溶液呈沸腾状态
d.低温时,Cu2O产率较低与SO2低温时的溶解度较大有关
(5)检验Cu2O是否洗涤干净的方法是______________________________ 。
(6)某工厂用V1 L含铜量120 g·L-1的酸性蚀刻液和V2 L含铜量160 g·L-1的碱性蚀刻液制备Cu2O,最终得到产品m g,产率为____ % 。
 、Cl-、H+)和碱性蚀刻液[Cu(NH3)4]2+、NH4+、NH3、Cl-]来制备,工艺流程如下:
、Cl-、H+)和碱性蚀刻液[Cu(NH3)4]2+、NH4+、NH3、Cl-]来制备,工艺流程如下:
已知:强酸条件下,2Cu+=Cu+Cu2+
(1)不同pH下“混合沉淀”实验结果见下表。由表可知,pH应控制在
| pH | 4.00 | 4.50 | 5.40 | 6.20 | 6.50 | 7.00 | 8.00 | 8.50 |
| 废液含铜量/g. L-1 | 19.5 | 2.4 | 2.0 | 0.3 | 0.2 | 2.0 | 8.3 | 17. 0 |
(3)“控温脱硫”生成 Cu2O的离子方程式为
(4)“控温脱硫”过程中温度对 Cu2O的产率影响及SO2在水中溶解度随温度变化如图所示:

下列说法正确的是
a.在60℃以下,温度越高,SO2越易逸出,有利于提高生产中硫原子利用率
b.反应温度的变化是影响Cu2O产率的主要因素
c.结合工业生产实际,温度应控制在溶液呈沸腾状态
d.低温时,Cu2O产率较低与SO2低温时的溶解度较大有关
(5)检验Cu2O是否洗涤干净的方法是
(6)某工厂用V1 L含铜量120 g·L-1的酸性蚀刻液和V2 L含铜量160 g·L-1的碱性蚀刻液制备Cu2O,最终得到产品m g,产率为
您最近一年使用:0次
2018-07-18更新
|
191次组卷
|
2卷引用:福建省泉州市永春第一中学2022-2023学年高一下学期6月月考化学试题



