1 . 胆矾(CuSO4·5H2O)是一种重要化工原料。某研究小组以生锈的铜屑为原料(主要成分是Cu,含有少量的油污、CuO、CuCO3、Cu(OH)2)制备胆矾流程如图,下列说法不正确的是
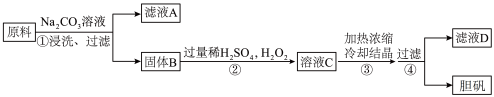

| A.步骤②中包含了氧化还原反应,氧化剂与还原剂的物质的量比为1∶1 |
| B.步骤③④得到的胆矾晶体,可以用水进行洗涤干燥 |
| C.往滤液D中加入淀粉-KI溶液,无明显现象 |
| D.将25g胆矾晶体与75g水混合,配制得到质量分数为16%的硫酸铜溶液 |
您最近一年使用:0次
名校
解题方法
2 . 宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料[主要成分为Cu(OH)2∙ CuCO3],青色来自蓝铜矿颜料[主要成分为Cu(OH)2∙2CuCO3]。下列说法正确的是
| A.孔雀石、蓝铜矿颜料热稳定性较好 |
| B.孔雀石、蓝铜矿颜料在空气中易被氧化 |
| C.孔雀石、蓝铜矿颜料耐酸耐碱 |
| D.Cu(OH)2∙ CuCO3中铜的质量分数高于Cu(OH)2∙2CuCO3 |
您最近一年使用:0次
2024-01-08更新
|
72次组卷
|
3卷引用:辽宁省阜新市高级中学2023-2024学年高一上学期12月月考化学试题
名校
3 . 学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
(1)铜与浓硝酸反应的装置如图,A中反应的离子方程式为______ ,装置B的作用为______ 。
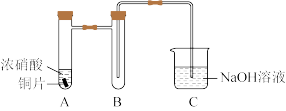
(2)铜与过量 反应的探究如下:
反应的探究如下:

实验②中Cu溶解的离子方程式为______ ;产生的气体为______ 。比较实验①和②,从氧化还原角度说明H⁺的作用是______ 。
(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,m g X完全分解为n g黑色氧化物Y,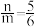 。X的化学式为
。X的化学式为______ 。
(4)取含X粗品0.0500 g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用0.1000 mol⋅L
 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液15.00 mL。(已知:
标准溶液15.00 mL。(已知: ,
, )粗品中X的百分含量
)粗品中X的百分含量______ %。
(1)铜与浓硝酸反应的装置如图,A中反应的离子方程式为

(2)铜与过量
 反应的探究如下:
反应的探究如下:
实验②中Cu溶解的离子方程式为
(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,m g X完全分解为n g黑色氧化物Y,
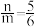 。X的化学式为
。X的化学式为(4)取含X粗品0.0500 g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用0.1000 mol⋅L

 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液15.00 mL。(已知:
标准溶液15.00 mL。(已知: ,
, )粗品中X的百分含量
)粗品中X的百分含量
您最近一年使用:0次
4 . Ⅰ.印刷线路板废液(主要含有 、
、 、
、 、
、 、
、 等)可用来制备碱式碳酸铜,其化学式为
等)可用来制备碱式碳酸铜,其化学式为 ,过程可表示为
,过程可表示为
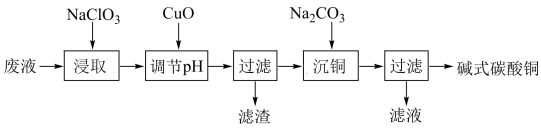
(1)已知滤渣的成分为氢氧化铁,“浸取”过程中发生了氧化还原反应,则“浸取”的离子方程式为:___________ 。
(2)下列物质中可以代替 “调节
“调节 ”且不影响滤液组成的是___。
”且不影响滤液组成的是___。
(3)“沉铜”需要一定温度的水浴加热,水浴加热所需的玻璃仪器有酒精灯、________ 、_________ 。
(4)铜在潮湿的空气中被腐蚀生成“铜绿”,其主要成分即为碱式碳酸铜。相应的化学方程式为:____ 。
Ⅱ.回收利用粉煤灰是解决工业废渣污染的重要途径。
粉煤灰(主要含 、
、 )可用于制备碱式硫酸铝
)可用于制备碱式硫酸铝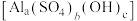 溶液。
溶液。
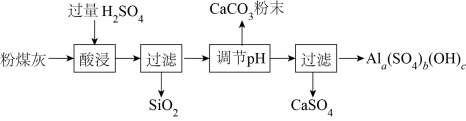
(5)加入 调节溶液
调节溶液 的目的有两个:①
的目的有两个:①_____________ 、②使硫酸铝转化为碱式硫酸铝。
(6)若 偏高,会导致溶液中的铝元素含量降低,其可能的原因是:加入的
偏高,会导致溶液中的铝元素含量降低,其可能的原因是:加入的 粉末使部分硫酸铝中的铝元素转化为:
粉末使部分硫酸铝中的铝元素转化为:_____________ (填化学式),同时产生 沉淀和无色无味的气体,其离子方程式为:
沉淀和无色无味的气体,其离子方程式为:________ 。
 、
、 、
、 、
、 、
、 等)可用来制备碱式碳酸铜,其化学式为
等)可用来制备碱式碳酸铜,其化学式为 ,过程可表示为
,过程可表示为
(1)已知滤渣的成分为氢氧化铁,“浸取”过程中发生了氧化还原反应,则“浸取”的离子方程式为:
(2)下列物质中可以代替
 “调节
“调节 ”且不影响滤液组成的是___。
”且不影响滤液组成的是___。A. | B.. | C.KOH | D. |
(4)铜在潮湿的空气中被腐蚀生成“铜绿”,其主要成分即为碱式碳酸铜。相应的化学方程式为:
Ⅱ.回收利用粉煤灰是解决工业废渣污染的重要途径。
粉煤灰(主要含
 、
、 )可用于制备碱式硫酸铝
)可用于制备碱式硫酸铝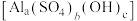 溶液。
溶液。
(5)加入
 调节溶液
调节溶液 的目的有两个:①
的目的有两个:①(6)若
 偏高,会导致溶液中的铝元素含量降低,其可能的原因是:加入的
偏高,会导致溶液中的铝元素含量降低,其可能的原因是:加入的 粉末使部分硫酸铝中的铝元素转化为:
粉末使部分硫酸铝中的铝元素转化为: 沉淀和无色无味的气体,其离子方程式为:
沉淀和无色无味的气体,其离子方程式为:
您最近一年使用:0次
名校
解题方法
5 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备ZnSO4·7H2O和CuSO4·5H2O的部分实验步骤如下:
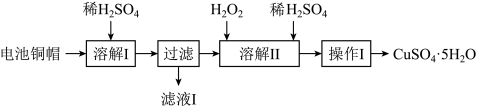
下列说法正确的是

下列说法正确的是
| A.滤液I中存在的主要阳离子有Zn2+、H+、Cu2+ |
| B.操作I为了尽可能多的得到CuSO4·5H2O晶体,应该将溶液蒸干 |
| C.溶解II过程发生反应的离子方程式为:Cu + H2O2 + 2H+ = Cu2+ + 2H2O |
| D.不可用操作I的方法从滤液I中提取ZnSO4·7H2O |
您最近一年使用:0次
6 . 宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料(主要成分为Cu(OH)2·CuCO3),青色来自蓝铜矿颜料(主要成分为Cu(OH)2·2CuCO3)。下列说法错误的是
| A.保存《千里江山图》需控制温度和湿度 |
| B.孔雀石、蓝铜矿颜料不易被空气氧化 |
| C.孔雀石、蓝铜矿颜料耐酸耐碱 |
| D.Cu(OH)2·CuCO3中铜的质量分数高于Cu(OH)2·2CuCO3 |
您最近一年使用:0次
2020-07-09更新
|
18112次组卷
|
76卷引用:陕西省咸阳市实验中学2023-2024学年高一上学期段性检测(一)化学试题
陕西省咸阳市实验中学2023-2024学年高一上学期段性检测(一)化学试题陕西省延安市延川县中学2023-2024学年高一上学期第一次月考化学试题(已下线)第01章 物质及其变化(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)(已下线)【南昌新东方】3. 南昌一中 余贞梅(已下线)【浙江新东方】32重庆市万州新田中学2020-2021学年高一上学期第二次月考化学试题河南省洛阳市第一高级中学2020-2021学年高一上学期12月月考化学试题广西桂林市第十八中学2020-2021学年高一下学期期中考试化学试题湖南省益阳市箴言中学2021-2022学年高一上学期10月月考化学试题 黑龙江省哈尔滨师范大学附属中学2021-2022学年高一上学期第一次月考化学试题河南省信阳高级中学2021-2022学年高一下学期期末考试化学试题云南省昆明第一中学2022-2023学年高一上学期入学考试化学试题重庆南开中学2022-2023学年高一上学期入学考试化学试题安徽省安庆市第一中学2022-2023学年高一上学期期中考试化学试题甘肃省张掖市2022-2023学年高一上学期适应性模拟考试化学试题(已下线)专题01 物质的组成与分类 传统文化-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题7 化学与传统文化第三章 金属及其化合物 第15讲 金属材料 金属冶炼(已下线)题型37 含铜化合物的性质及其之间的转化流程(已下线)题型1 传统文化-高考必备50个题型(已下线)考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)江西省宜春市上高二中2023-2024学年高三上学期第一次月考化学试题2020年全国统一考试化学试题(新课标Ⅲ)(已下线)专题01 STSE 化学用语-2020年高考真题和模拟题化学分项汇编(已下线)小题必刷15 铁、铜及其化合物——2021年高考化学一轮复习小题必刷(通用版)广东惠州市华罗庚中学2021届高三9月月考化学试题河南省三门峡市第一高级中学2021届高三8月开学考试化学试题四川省绵阳南山中学2020-2021学年高二上学期开学考试化学试题黑龙江省哈尔滨市尚志市尚志中学2021届高三10月月考化学试题山东省临沂市莒南第二中学2021届高三10月月考化学试题福建省厦门实验中学2021届高三上学期十月份月考化学试题北京首都师范大学第二附属中学2021届高三9月月考化学试题吉林省汪清县第六中学2021届高三第三次月考模拟化学试题福建省福州市第一中学2021届高三上学期开学质检化学试题河北省尚义县第一中学2021届高三上学期期中考试化学试题山东省泰安市宁阳一中2021届高三上学期模块考试化学试题湖南省宁乡市第一高级中学2021届高三上学期11月摸底考试化学试题重庆市第七中学2021届高三上学期期中化学试题(已下线)热点2 化学与传统文化-2021年高考化学专练【热点·重点·难点】(已下线)热点2 化学与传统文化-2021年高考化学【热点·重点·难点】专练(山东专用)宁夏海原县第一中学2021届高三上学期期末考试化学试题河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题(已下线)专题01 物质的组成、性质和分类——备战2021年高考化学纠错笔记(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练广东省梅州市五华县五华中学2021届高三2月测练化学试题(已下线)小题01 化学与传统文化——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)押山东卷第01题 化学与STSE、传统文化-备战2021年高考化学临考题号押题(山东卷)(已下线)押全国卷理综第7题 化学与社会生产生活-备战2021年高考化学临考题号押题(课标全国卷)陕西省西安市庆华中学2020-2021学年高三上学期第二次月考化学试题河南省三门峡市实验高中2020-2021学年高二下学期6月月考化学试题(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)山东省青岛莱西市2020-2021学年高二下学期期末考试(第四次考试)化学试题江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题(已下线)专题讲座(七) STSE与 化学可持续发展(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题01 化学与STSE—2022年高考化学二轮复习讲练测-讲义(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)2020年全国卷Ⅲ化学真题变式题(已下线)卷01 化学与传统文化-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)押全国卷理综第7题 化学与社会生产生活及传统文化-备战2022年高考化学临考题号押题(课标全国卷)(已下线)回归教材重难点01 化学与STSE与传统文化-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题01STSE化学用语-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题01STSE化学用语-五年(2018~2022)高考真题汇编(全国卷)(已下线)第01练 化学与科技社会生产生活、传统文化-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)微专题01 “话”中有“化”—化学与传统文化-备战2023年高考化学一轮复习考点微专题(已下线)微专题15 铜及其化合物的性质、制备与实验探究-备战2023年高考化学一轮复习考点微专题(已下线)第10讲 金属材料及金属矿物的开发利用(练)-2023年高考化学一轮复习讲练测(全国通用)陕西省榆林市神木中学、府谷中学和绥德中学2021-2022学年高二下学期期末考试化学试题福建省厦门集美中学2022-2023学年高三上学期期中考试化学试题(已下线)专题二 化学与STSE-实战高考·二轮复习核心突破福建省厦门市国祺中学2021-2022学年高三上学期期中考试化学试题宁夏石嘴山市平罗中学2022-2023学年高三上学期11月期中考试化学试题上海市华东师范大学第二附属中学(紫竹校区)2023-2024学年高三下学期三模考试 化学试题重庆十八中两江实验中学校2022-2023学年高二上学期第一次月考化学试题
名校
解题方法
7 . 已知:Cu2O+H2SO4 = Cu+CuSO4 +H2O 。某红色粉末样品可能含有 Fe2O3 和 Cu2O 中的一种或两种,为探究其组成,取少量样品加入过量稀硫酸。下列有关说法正确的是
| A.若固体全部溶解,则发生的离子反应只有:Fe2O3+6H+=2Fe3+ +3H2O |
| B.若固体部分溶解,则样品中一定含有 Cu2O,一定不含有 Fe2O3 |
| C.若固体全部溶解,再滴加 KSCN 溶液,溶液不变红色,则样品中 n(Fe2O3):n(Cu2O)为 2:1 |
| D.另取 ag 样品在空气中充分加热至质量不再变化,称其质量为 b g(b>a),则混合物中 Cu2O 的质量分数为 9(b-a)/a |
您最近一年使用:0次
2020-02-17更新
|
1831次组卷
|
14卷引用:甘肃省庆阳市2022-2023学年高一上学期期末考试化学试题
甘肃省庆阳市2022-2023学年高一上学期期末考试化学试题湖南省湘潭市2022-2023学年高一上学期1月期末考试化学试题浙江省温州市2019-2020学年高一上学期期末教学质量统一检测化学试题(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00146】浙江省吴兴高级中学2021-2022学年高一下学期返校学情检测化学试题河南省新乡市2022-2023学年高一上学期选科调研第二次测试化学试题河南省新乡市第一中学2022-2023学年高一上学期12月期中考试化学试题(已下线)【新东方】2020-91辽宁省实验中学东戴河校区2021届高三上学期第一次月考化学试题辽宁省沈阳辽宁省实验中学2021届高三上学期月考化学试题湖南省长沙市长郡中学2021届高三上学期第5次月考化学试题(已下线)专题讲座(一) 阿伏加德罗常数的突破(练) — 2022年高考化学一轮复习讲练测(新教材新高考)安徽省合肥市(五中、七中、十中)2021-2022学年高三上学期联考化学试题内蒙古包钢第一中学2022-2023学年高三上学期11月月考化学试题
名校
8 . Fe2O3、Cu2O都是红色粉末,常用作颜料。某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O 溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3
假设2:______ .
假设3:红色粉末是Cu2O和Fe2O3
(1)设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液。
(2)若假设1成立,则实验现象是______ .
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?______ .简述你的理由______ .
(4)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明假设______ 成立
(5)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为______ .
查阅资料:Cu2O 溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3
假设2:
假设3:红色粉末是Cu2O和Fe2O3
(1)设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液。
(2)若假设1成立,则实验现象是
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?
(4)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明假设
(5)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为
您最近一年使用:0次
2020-06-06更新
|
237次组卷
|
2卷引用:专题9 本专题达标检测-高中化学必修第二册苏教版2019



