名校
解题方法
1 . 某小组探究 和
和 的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
【实验探究】
实验i:向装有0.5g 的烧杯中加入20mL30%
的烧杯中加入20mL30% 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊, 片表面附着少量蓝色固体。
片表面附着少量蓝色固体。
(1)写出该反应的化学方程式:_______ 。
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
(2)实验ii中:溶液变蓝的原因是_______ (用离子反应方程式表示);经检验产生的气体为氧气,产生氧气的原因是_______ 。
(3)对比实验i和iii,为探究氨水对 的还原性或
的还原性或 氧化性的影响,该同学利用如图装置继续实验。
氧化性的影响,该同学利用如图装置继续实验。
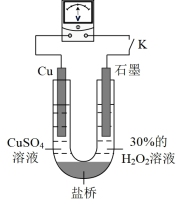
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
①利用电极反应解释该实验的结论:_______ 。
②利用该方法也可证明酸性增强可提高 的氧化性,与上述实验操作不同的是
的氧化性,与上述实验操作不同的是_______ 。
(4)总结:物质氧化性和还原性变化的一般规律是_______ 。
(5)应用: 分别与
分别与 的盐酸、氢溴酸、氢碘酸混合,
的盐酸、氢溴酸、氢碘酸混合, 只与氢碘酸发生置换反应,试解释原因
只与氢碘酸发生置换反应,试解释原因_______ 。
 和
和 的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
的反应的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。【实验探究】
实验i:向装有0.5g
 的烧杯中加入20mL30%
的烧杯中加入20mL30% 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊, 片表面附着少量蓝色固体。
片表面附着少量蓝色固体。(1)写出该反应的化学方程式:
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
| 装置 | 序号 | 试剂a | 现象 |
 | ii | 20mL30% 与4mL 与4mL5mol/L  混合液 混合液 |  表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
| iii | 20mL30% 与4mL 与4mL5mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡, 表面有少量蓝色不溶物 表面有少量蓝色不溶物 |
(3)对比实验i和iii,为探究氨水对
 的还原性或
的还原性或 氧化性的影响,该同学利用如图装置继续实验。
氧化性的影响,该同学利用如图装置继续实验。
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
①利用电极反应解释该实验的结论:
②利用该方法也可证明酸性增强可提高
 的氧化性,与上述实验操作不同的是
的氧化性,与上述实验操作不同的是(4)总结:物质氧化性和还原性变化的一般规律是
(5)应用:
 分别与
分别与 的盐酸、氢溴酸、氢碘酸混合,
的盐酸、氢溴酸、氢碘酸混合, 只与氢碘酸发生置换反应,试解释原因
只与氢碘酸发生置换反应,试解释原因
您最近一年使用:0次
2022-06-03更新
|
538次组卷
|
4卷引用:北京市和平街第一中学2021-2022学年高三下学期保温化学试题
北京市和平街第一中学2021-2022学年高三下学期保温化学试题(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题(已下线)微专题 物质性质综合实验探究北京市东直门中学2023-2024学年高三上学期12月阶段测试化学试题
2022·福建漳州·一模
名校
解题方法
2 . 某研究性学习小组设计下列实验探究Zn和FeCl3溶液的反应,回答下列问题:
(1)由FeCl3固体配制未酸化的250mL0.5mol·L-1FeCl3溶液(pH=1.3),不需要使用的实验仪器有___________ (从下列图中选择,写出名称)。

(2)将Zn投入到未酸化的0.5mol·L-1FeCl3溶液(pH=1.3)中,在不同的实验条件下,实验现象如表:
①实验中产生的气体为___________ ,实验ii中产生气体的速率明显快于实验i,可能的原因是___________ (答出两点)。
②“滴加铁氰化钾溶液后,可见蓝色沉淀”说明混合溶液中存在Fe2+。生成Fe2+的离子方程式为___________ 。
(3)实验i和ii均先有气体生成,后有溶液颜色的变化。研究性学习小组猜想,可能是此实验条件下,氧化性:H+>Fe3+。
①为了检验上述猜想是否正确,查阅资料:可利用标准电极电势(用φθ表示)判断氧化性、还原性强弱,且电极电势越小,还原剂的还原性越强,已知(溶液中离子浓度的影响在此忽略不计):φθ(Fe3+ /Fe2+)=0.77 V,φθ (2H+ /H2)=0 V,φθ (Fe2+ /Fe)=—0.417 V,φθ (Zn2+ /Zn) =—0.76 V。则Fe3+、H+、Zn2+、Fe2+的氧化性大小关系为___________ 。
②研究小组进一步分析后,将锌粒改为锌粉,继续进行实验:
对比实验iii和iv,实验iv中“气泡不明显,红褐色褪色明显”的原因可能为___________ 。
③结合实验探究过程及现象分析,影响Zn与FeCl3溶液反应的条件有___________ (答两点即可的)。
(1)由FeCl3固体配制未酸化的250mL0.5mol·L-1FeCl3溶液(pH=1.3),不需要使用的实验仪器有

(2)将Zn投入到未酸化的0.5mol·L-1FeCl3溶液(pH=1.3)中,在不同的实验条件下,实验现象如表:
| 实验编号 | 条件 | 现象 |
| i | 锌粒18℃ | 刚开始无明显气泡,0.5min后有气体产生,一段时间后,溶液颜色加深。向反应后的溶液中滴加铁氰化钾溶液后,可见蓝色沉淀 |
| ii | 锌粒65℃ | 产生气泡较快,大约12 s后,气泡非常明显,溶液很快转为红棕色。较长时间后发现红棕色基本消失,最后产生红棕色沉淀 |
②“滴加铁氰化钾溶液后,可见蓝色沉淀”说明混合溶液中存在Fe2+。生成Fe2+的离子方程式为
(3)实验i和ii均先有气体生成,后有溶液颜色的变化。研究性学习小组猜想,可能是此实验条件下,氧化性:H+>Fe3+。
①为了检验上述猜想是否正确,查阅资料:可利用标准电极电势(用φθ表示)判断氧化性、还原性强弱,且电极电势越小,还原剂的还原性越强,已知(溶液中离子浓度的影响在此忽略不计):φθ(Fe3+ /Fe2+)=0.77 V,φθ (2H+ /H2)=0 V,φθ (Fe2+ /Fe)=—0.417 V,φθ (Zn2+ /Zn) =—0.76 V。则Fe3+、H+、Zn2+、Fe2+的氧化性大小关系为
②研究小组进一步分析后,将锌粒改为锌粉,继续进行实验:
| 实验编号 | 条件 | 现象 |
| iii | 锌粉18℃ 不振荡 | 大约3min可以看到明显的气泡,溶液颜色逐渐变深。向反应后的溶液中滴加铁氰化钾溶液后,可见蓝色沉淀 |
| iv | 锌粉65℃ 振荡 | 气泡不明显,红褐色褪色明显。向反应后的溶液中滴加铁氰化钾溶液后,可见蓝色沉淀 |
③结合实验探究过程及现象分析,影响Zn与FeCl3溶液反应的条件有
您最近一年使用:0次
2022-01-19更新
|
1219次组卷
|
5卷引用:一轮巩固卷8-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)
(已下线)一轮巩固卷8-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)(已下线)易错点06 铁及其化合物-备战2023年高考化学考试易错题(已下线)专题六 金属元素及其化合物-实战高考·二轮复习核心突破福建省漳州市2022届高三毕业班第一次质量检测化学试题福建省永安第九中学2022-2023学年高三上学期期中考试化学试题
解题方法
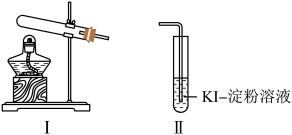
3 . 资料显示“ 的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究
的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究 与KI溶液发生反应的条件。
与KI溶液发生反应的条件。
供选试剂: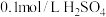 溶液、
溶液、 固体、
固体、 固体。
固体。
该小组同学设计 、
、 两组实验,记录如下:
两组实验,记录如下:
(1)选择Ⅰ装置用 固体制取
固体制取 ,为避免
,为避免 固体随
固体随 进入Ⅱ试管对实验造成干扰,应进行的改进是
进入Ⅱ试管对实验造成干扰,应进行的改进是________ , 组实验中
组实验中 与KI溶液反应的离子方程式是
与KI溶液反应的离子方程式是________ 。
(2)对比 、
、 两组实验可知,
两组实验可知, 与KI溶液发生反应的适宜条件是
与KI溶液发生反应的适宜条件是________ 。为进一步探究该条件对反应速率的影响,可采取的实验措施是________ 。
(3)为进一步探究碱性条件下KI与 能否反应,用上图中的装置继续进行实验:
能否反应,用上图中的装置继续进行实验:
对于实验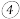 的现象,小明同学提出猜想“
的现象,小明同学提出猜想“ 时
时 不能氧化
不能氧化 ”,设计了下列装置进行实验,验证猜想。
”,设计了下列装置进行实验,验证猜想。
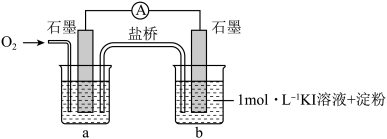
(i)烧杯a中的溶液为________ 。
(ii)实验结果表明,此猜想不成立。支持该结论的实验现象是通入 后
后________ 。
(iii)小刚同学向 的KOH溶液
的KOH溶液 含淀粉
含淀粉 中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有
中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有 ,褪色的原因是
,褪色的原因是________  用离子方程式表示
用离子方程式表示 。
。
(4)该小组同学对实验过程进行了反思:实验 的现象产生的原因可能是
的现象产生的原因可能是________ 。
 的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究
的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究 与KI溶液发生反应的条件。
与KI溶液发生反应的条件。 
供选试剂:
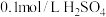 溶液、
溶液、 固体、
固体、 固体。
固体。该小组同学设计
 、
、 两组实验,记录如下:
两组实验,记录如下:| 实验操作 | 实验现象 | |
 | 向Ⅰ试管中加入  固体,连接装置Ⅰ、Ⅱ,点燃酒精灯 固体,连接装置Ⅰ、Ⅱ,点燃酒精灯 | Ⅱ试管中有气泡冒出,溶液不变蓝 |
 | 向Ⅰ试管中加入  固体, 固体,Ⅱ试管中加入适量 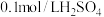 溶液,连接装置Ⅰ、Ⅱ,点燃酒精灯 溶液,连接装置Ⅰ、Ⅱ,点燃酒精灯 | Ⅱ试管中有气泡冒出,溶液变蓝 |
 固体制取
固体制取 ,为避免
,为避免 固体随
固体随 进入Ⅱ试管对实验造成干扰,应进行的改进是
进入Ⅱ试管对实验造成干扰,应进行的改进是 组实验中
组实验中 与KI溶液反应的离子方程式是
与KI溶液反应的离子方程式是(2)对比
 、
、 两组实验可知,
两组实验可知, 与KI溶液发生反应的适宜条件是
与KI溶液发生反应的适宜条件是(3)为进一步探究碱性条件下KI与
 能否反应,用上图中的装置继续进行实验:
能否反应,用上图中的装置继续进行实验:| 实验操作 | 实验现象 | |
 | 向Ⅰ试管中加入  固体,Ⅱ试管中滴加 KOH 溶液控制 固体,Ⅱ试管中滴加 KOH 溶液控制  , 连接装置Ⅰ、Ⅱ,点燃酒精灯 , 连接装置Ⅰ、Ⅱ,点燃酒精灯 | 溶液略变蓝 |
 | 向Ⅰ试管中加入  固体,Ⅱ试管中滴加 KOH 溶液控制 固体,Ⅱ试管中滴加 KOH 溶液控制  , 连接装置Ⅰ、Ⅱ,点燃酒精灯 , 连接装置Ⅰ、Ⅱ,点燃酒精灯 | 无明显变化 |
 的现象,小明同学提出猜想“
的现象,小明同学提出猜想“ 时
时 不能氧化
不能氧化 ”,设计了下列装置进行实验,验证猜想。
”,设计了下列装置进行实验,验证猜想。 
(i)烧杯a中的溶液为
(ii)实验结果表明,此猜想不成立。支持该结论的实验现象是通入
 后
后(iii)小刚同学向
 的KOH溶液
的KOH溶液 含淀粉
含淀粉 中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有
中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有 ,褪色的原因是
,褪色的原因是 用离子方程式表示
用离子方程式表示 。
。(4)该小组同学对实验过程进行了反思:实验
 的现象产生的原因可能是
的现象产生的原因可能是
您最近一年使用:0次
名校
4 . 某兴趣小组同学探究KMnO4溶液与草酸(H2C2O4)溶液反应速率的影响因素。配制1.0×10−3 mol·L−1 KMnO4溶液、0.40 mol·L−1草酸溶液。将KMnO4溶液与草酸溶液按如下比例混合。
【设计实验】
(1)实验①和②的目的是___________ 。
(2)甲认为上述实验应控制pH相同,可加入的试剂是___________ (填序号)。
a. 盐酸 b. 硫酸 c. 草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成 两个阶段:
i. 紫色溶液变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a) Mn2+在溶液中无色,在草酸中不能形成配合物;
(b) Mn3+无色,有强氧化性,发生反应Mn3++2C2O
 [Mn(C2O4)2]−(青绿色)后氧化性减弱;
[Mn(C2O4)2]−(青绿色)后氧化性减弱;
(c)MnO 呈绿色,在酸性条件下不稳定,迅速分解产生MnO
呈绿色,在酸性条件下不稳定,迅速分解产生MnO 和MnO2。
和MnO2。
(3)乙同学从氧化还原角度推测阶段i中可能产生了MnO 。你认为该观点是否合理,并说明理由:
。你认为该观点是否合理,并说明理由:___________ 。
【继续探究】
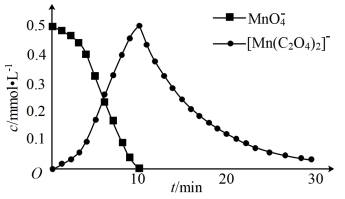
进一步实验证明溶液中含有[Mn(C2O4)2]−,反应过程中MnO 和[Mn(C2O4)2]−浓度随时间的变化如下图。
和[Mn(C2O4)2]−浓度随时间的变化如下图。

(4)第i阶段中检测到有CO2气体产生,反应的离子方程式为___________ 。
(5)据此推测,若在第ii阶段将c(H+)调节至0.2 mol/L,溶液褪至无色的时间会___________ (填“增加”“减少”或“不变”)。
【结论与反思】
(6)上述实验涉及的反应中,草酸的作用是___________ 。
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
【设计实验】
| 序号 | V(KMnO4) / mL | V(草酸) /mL | V(H2O) /mL | 反应温度/ oC |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | 1.0 | 20 |
(2)甲认为上述实验应控制pH相同,可加入的试剂是
a. 盐酸 b. 硫酸 c. 草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成 两个阶段:
i. 紫色溶液变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a) Mn2+在溶液中无色,在草酸中不能形成配合物;
(b) Mn3+无色,有强氧化性,发生反应Mn3++2C2O

 [Mn(C2O4)2]−(青绿色)后氧化性减弱;
[Mn(C2O4)2]−(青绿色)后氧化性减弱;(c)MnO
 呈绿色,在酸性条件下不稳定,迅速分解产生MnO
呈绿色,在酸性条件下不稳定,迅速分解产生MnO 和MnO2。
和MnO2。(3)乙同学从氧化还原角度推测阶段i中可能产生了MnO
 。你认为该观点是否合理,并说明理由:
。你认为该观点是否合理,并说明理由:【继续探究】
进一步实验证明溶液中含有[Mn(C2O4)2]−,反应过程中MnO
 和[Mn(C2O4)2]−浓度随时间的变化如下图。
和[Mn(C2O4)2]−浓度随时间的变化如下图。
(4)第i阶段中检测到有CO2气体产生,反应的离子方程式为
(5)据此推测,若在第ii阶段将c(H+)调节至0.2 mol/L,溶液褪至无色的时间会
【结论与反思】
(6)上述实验涉及的反应中,草酸的作用是
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
您最近一年使用:0次
5 . 某兴趣小组同学探究 酸性溶液与草酸
酸性溶液与草酸 溶液反应速率的影响因素。将
溶液反应速率的影响因素。将 的
的 酸性溶液与
酸性溶液与 草酸溶液按如下比例混合。
草酸溶液按如下比例混合。
【设计实验】
(1)补全 酸性溶液与草酸溶液反应的离子方程式:
酸性溶液与草酸溶液反应的离子方程式:_______ 。

(2)实验①和②的目的是_______ 。
【进行实验】
小组同学进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
Ⅰ.紫色溶液变为青色溶液;Ⅱ.青色溶液逐渐褪至无色溶液。
【查阅资料】
a. 酸性溶液与草酸溶液的反应主要包含如下几个过程:
酸性溶液与草酸溶液的反应主要包含如下几个过程:
反应ⅰ.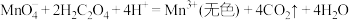
反应ⅱ.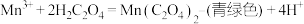
反应ⅲ。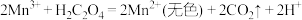
b. 的氧化性较弱,在本实验条件下不能氧化
的氧化性较弱,在本实验条件下不能氧化 。
。
c. 呈绿色,在酸性条件下不稳定,迅速分解为
呈绿色,在酸性条件下不稳定,迅速分解为 和
和 。
。
【继续探究】
进一步实验证明溶液中含有 ,实验①反应过程中
,实验①反应过程中 和
和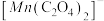 的浓度随时间的变化如下图。
的浓度随时间的变化如下图。
【解释与反思】
(3)本实验中,化学反应速率:反应ⅱ_______ 反应ⅲ(填“>”、“=”或“<”)。
(4)小组同学认为反应ⅱ的离子方程式应该改为: ,结合实验现象,说明其理由
,结合实验现象,说明其理由_______ 。
 酸性溶液与草酸
酸性溶液与草酸 溶液反应速率的影响因素。将
溶液反应速率的影响因素。将 的
的 酸性溶液与
酸性溶液与 草酸溶液按如下比例混合。
草酸溶液按如下比例混合。【设计实验】
| 序号 | V( 酸性溶液)/ 酸性溶液)/ | V(草酸溶液)/ | 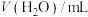 | 反应温度/ |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | 1.0 | 20 |
 酸性溶液与草酸溶液反应的离子方程式:
酸性溶液与草酸溶液反应的离子方程式:
(2)实验①和②的目的是
【进行实验】
小组同学进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
Ⅰ.紫色溶液变为青色溶液;Ⅱ.青色溶液逐渐褪至无色溶液。
【查阅资料】
a.
 酸性溶液与草酸溶液的反应主要包含如下几个过程:
酸性溶液与草酸溶液的反应主要包含如下几个过程:反应ⅰ.
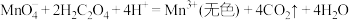
反应ⅱ.
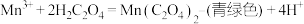
反应ⅲ。
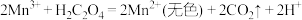
b.
 的氧化性较弱,在本实验条件下不能氧化
的氧化性较弱,在本实验条件下不能氧化 。
。c.
 呈绿色,在酸性条件下不稳定,迅速分解为
呈绿色,在酸性条件下不稳定,迅速分解为 和
和 。
。【继续探究】
进一步实验证明溶液中含有
 ,实验①反应过程中
,实验①反应过程中 和
和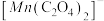 的浓度随时间的变化如下图。
的浓度随时间的变化如下图。
【解释与反思】
(3)本实验中,化学反应速率:反应ⅱ
(4)小组同学认为反应ⅱ的离子方程式应该改为:
 ,结合实验现象,说明其理由
,结合实验现象,说明其理由
您最近一年使用:0次
名校
解题方法
6 . 某兴趣小组同学探究KMnO4溶液与草酸(H2C2O4)溶液反应速率的影响因素。配制1.0×10-3mol/LKMnO4溶液、0.40mol/L草酸溶液。将KMnO4溶液与草酸溶液按如下比例混合。
【设计实验】
(1)实验①和②的目的是___________ 。
(2)甲认为上述实验应控制pH相同,可加入的试剂是___________ (填序号)。
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液转变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a) 无色,在草酸中不能形成配合物;
无色,在草酸中不能形成配合物;
(b) 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;
(c) 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。
(3)乙同学从氧化还原角度推测阶段i中可能产生 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:___________ 。
【继续探究】
进一步实验证明溶液中含有 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
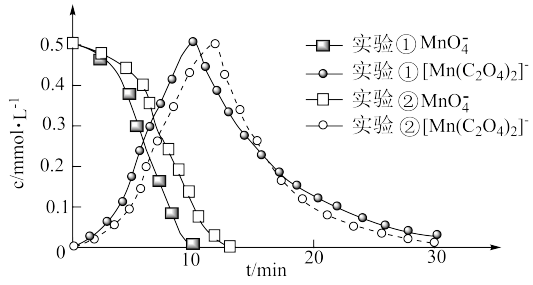
(4)第i阶段中检测到有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为___________ 。
(5)实验②在第ii阶段的反应速率较大,可能的原因是___________ 。
(6)据此推测,若在第ii阶段将 调节至
调节至 ,溶液褪至无色的时间会
,溶液褪至无色的时间会___________ (填“增加”“减少”或“不变”)。
【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是___________ 。
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
【设计实验】
| 序号 | 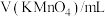 | 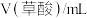 | 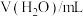 | 反应温度/℃ |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | 1.0 | 20 |
(2)甲认为上述实验应控制pH相同,可加入的试剂是
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液转变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a)
 无色,在草酸中不能形成配合物;
无色,在草酸中不能形成配合物;(b)
 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;(c)
 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。(3)乙同学从氧化还原角度推测阶段i中可能产生
 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:【继续探究】
进一步实验证明溶液中含有
 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
(4)第i阶段中检测到有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为(5)实验②在第ii阶段的反应速率较大,可能的原因是
(6)据此推测,若在第ii阶段将
 调节至
调节至 ,溶液褪至无色的时间会
,溶液褪至无色的时间会【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
您最近一年使用:0次
2022-04-01更新
|
1359次组卷
|
8卷引用:北京市海淀区2022届高三一模化学试题
北京市海淀区2022届高三一模化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(河北专用)北京市第二中学2022-2023学年高二上学期10月月考化学试题北京第一零一中学2023届高三10月月考化学试题北京市第二十中学2022-2023学年高三上学期12月月考化学试题超重点8 碳酸盐、草酸盐的创新考查(已下线)北京市海淀区2022届高三一模(实验探究题)北京师范大学附属中学2022-2023学年高二上学期10月月考化学试题
2023高三·全国·专题练习
解题方法
7 . 研究氮及其化合物的制备性质具有重要的意义。回答下列问题:
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略),制取干燥的氨气并验证 的性质。
的性质。
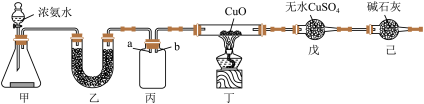
(1)装置甲中盛放浓氨水的仪器名称是________ ,锥形瓶中的药品是________ 。
(2)装置乙装有________ ,其作用是________ ;装置丙用于收集 ,应将导管
,应将导管________ (填“a”或“b”)延长至集气瓶底部。
(3)实验中观察到丁中CuO粉末变红,戊中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为__________ ,证明氨气具有________ (填“氧化性”或“还原性”)。
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是________ (填标号)。
a. b.
b. c.
c.  d.
d.
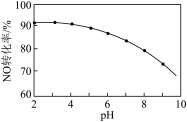
II.工业制备硝酸的尾气中往往含有NO、 ,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。
,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。
(5)在酸性NaClO溶液中,HClO氧化NO生成 和
和 ,反应的离子反应方程式为
,反应的离子反应方程式为_____________ 。
(6)NaClO溶液的初始pH越小,NO转化率越高,其原因是________________ 。
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略),制取干燥的氨气并验证
 的性质。
的性质。
(1)装置甲中盛放浓氨水的仪器名称是
(2)装置乙装有
 ,应将导管
,应将导管(3)实验中观察到丁中CuO粉末变红,戊中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是
a.
 b.
b. c.
c.  d.
d.
II.工业制备硝酸的尾气中往往含有NO、
 ,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。
,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。
(5)在酸性NaClO溶液中,HClO氧化NO生成
 和
和 ,反应的离子反应方程式为
,反应的离子反应方程式为(6)NaClO溶液的初始pH越小,NO转化率越高,其原因是
您最近一年使用:0次
21-22高一上·安徽安庆·期末
名校
8 . 铁元素的“价—类”二维图如图所示:
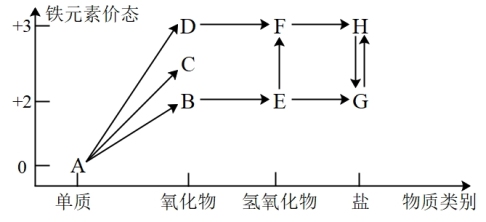
(1)C的化学式是_______ , 反应的化学方程式是
反应的化学方程式是_______ ,反应过程的现象为_______ 。
(2)维生素C可将H转化为G,维生素C具有_______ (填“酸性”、“氧化性”或“还原性”)。
(3)在指定条件下,下列铁及其化合物之间的转化不能实现的是_______ 。
A. B.
B.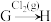 C.
C.
(4)某小组同学设计如下实验,研究亚铁盐与 溶液的反应。
溶液的反应。
试剂:酸化的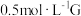 溶液,
溶液, 溶液
溶液
①上述实验中 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是_______ 。
②产生气泡的原因是_______ 。

(1)C的化学式是
 反应的化学方程式是
反应的化学方程式是(2)维生素C可将H转化为G,维生素C具有
(3)在指定条件下,下列铁及其化合物之间的转化不能实现的是
A.
 B.
B.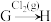 C.
C.
(4)某小组同学设计如下实验,研究亚铁盐与
 溶液的反应。
溶液的反应。试剂:酸化的
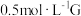 溶液,
溶液, 溶液
溶液| 操作 | 现象 |
取 酸化的G溶液于试管中,加入5滴 酸化的G溶液于试管中,加入5滴 溶液 溶液 | 溶液立即变为棕黄色,稍后,产生气泡。 |
向反应后的溶液中加入 溶液 溶液 | 溶液变红 |
 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是②产生气泡的原因是
您最近一年使用:0次
2022-01-23更新
|
803次组卷
|
8卷引用:3.1.2 铁盐和亚铁盐-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)
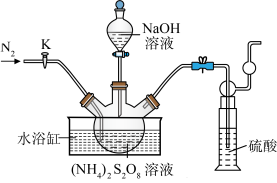
9 . 过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).
已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH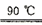 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___ ,反应过程中持续通入氮气的目的是___ 。
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:___ 。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:___ 。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4•H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
①在___ (填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为___ 。
③若用0.1mol•L-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___ ;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为___ g(用含V1的代数式表示,5H2O2~2 )。
)。

已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH
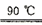 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2(1)图中装有NaOH溶液的仪器的名称为
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4•H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
| 环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
| 中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
| 碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
| 酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
①在
②中性氧化时,会产生大量气泡,其原因为
③若用0.1mol•L-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
 )。
)。
您最近一年使用:0次
2020-06-06更新
|
478次组卷
|
3卷引用:河北省邯郸市2020届高三第一次模拟考试理科综合化学试题
10 . 已知铁离子、氯气、溴均为常见的氧化剂,某化学兴趣小组设计了如图实验探究其氧化性强弱:
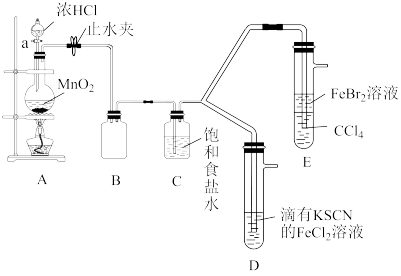
(1)装置A中发生反应的离子方程式是_______ 。
(2)整套实验装置存在一处明显的不足,请指出:_______ 。
(3)用改正后的装置进行实验,实验过程如表:
(4)因忙于观察和记录,没有及时停止反应,D、E中均发生新的变化。
D装置中:血红色慢慢褪去。
E装置中: 层颜色逐渐加深,直至变成红色。
层颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料为:
①请用平衡移动原理(结合上述资料)解释 过量时D中溶液血红色褪去的原因:
过量时D中溶液血红色褪去的原因:_______ 。
②现设计简单实验证明上述解释:取少量褪色后的溶液,滴加_______ 溶液,若溶液颜色_______ ,则上述解释是合理的。
小组同学另查得资料为:
③欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入 溶液,结果观察到有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀的原因:
溶液,结果观察到有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀的原因:_______ 。

(1)装置A中发生反应的离子方程式是
(2)整套实验装置存在一处明显的不足,请指出:
(3)用改正后的装置进行实验,实验过程如表:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变血红色; E装置中:水层溶液变黄,振荡后,  层明显变化;一段时间后 层明显变化;一段时间后 | 氧化性由强到弱的顺序为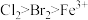 |
D装置中:血红色慢慢褪去。
E装置中:
 层颜色逐渐加深,直至变成红色。
层颜色逐渐加深,直至变成红色。为探究上述实验现象的本质,小组同学查得资料为:
ⅰ.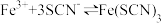 是一个可逆反应。 是一个可逆反应。ⅱ.  性质与卤素单质类似。氧化性: 性质与卤素单质类似。氧化性: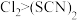 。 。 |
 过量时D中溶液血红色褪去的原因:
过量时D中溶液血红色褪去的原因:②现设计简单实验证明上述解释:取少量褪色后的溶液,滴加
小组同学另查得资料为:
ⅲ. 和 和 反应生成 反应生成 , , 呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。ⅳ.  、 、 均可溶于水。 均可溶于水。 |
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入
 溶液,结果观察到有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀的原因:
溶液,结果观察到有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀的原因:
您最近一年使用:0次



