1 . 下列实验操作、现象及结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将铁锈溶于浓盐酸,再滴入KMnO4溶液 | 紫色褪去 | 铁锈中含有二价铁 |
| B | 向淀粉溶液中加入稀硫酸,加热一段时间后,再滴加银氨溶液,水浴加热 | 未产生银镜 | 淀粉未发生水解 |
| C | 向盛有10滴0.1mol/L AgNO3溶液的试管中滴加15滴0.1mol/L NaCl溶液,观察现象,再滴加2滴0.1mol/L KI溶液 | 先产生白色沉淀,后产生黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 向一体积可变的密闭容器中充入NO2,发生反应:2NO2(g) N2O4(g),将容器体积压缩至原来的一半 N2O4(g),将容器体积压缩至原来的一半 | 相比压缩体积之前,气体颜色变浅 | 增大压强,平衡向气体分子数减小的方向移动 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
7日内更新
|
411次组卷
|
3卷引用:2024届内蒙古自治区赤峰市高三下学期三模理科综合试题-高中化学
2024届内蒙古自治区赤峰市高三下学期三模理科综合试题-高中化学(已下线)押题卷02(15+4题型) -2024高考化学考点必杀300题(新高考通用)内蒙古赤峰市2024届高三4月模拟考试(二模)理综-化学试题
2024高三·全国·专题练习
2 . 以Fe(NO3)3作为铁源制备高铁酸钾(K2FeO4),可用于去除水体中的As( )。已知:K2FeO4微溶于水,在酸性或中性溶液中迅速氧化H2O产生O2,在碱性溶液中较稳定,在Fe3+和Fe(OH)3催化作用下发生分解。
)。已知:K2FeO4微溶于水,在酸性或中性溶液中迅速氧化H2O产生O2,在碱性溶液中较稳定,在Fe3+和Fe(OH)3催化作用下发生分解。
(1)制备高铁酸钾。
向KOH和KClO混合溶液中加入Fe(NO3)3,过滤得到K2FeO4固体。
① 制备K2FeO4的化学方程式为___________ 。
② 过滤所得的滤液中加入稀硫酸产生Cl2,原因可能是酸性条件下K2FeO4氧化了Cl-,还可能是___________ 。
(2)测定 K2FeO4的纯度。
准确称取0.528 0 g K2FeO4样品置于锥形瓶中,用KOH溶液溶解,加入过量KCr(OH)4溶液,再加入硫酸酸化配成待测液,用0.3000 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准液20.00 mL,计算样品中K2FeO4的纯度___________ (写出计算过程)。
测定过程中涉及的离子反应有(未配平):Cr(OH) +FeO
+FeO →Fe(OH)3+CrO
→Fe(OH)3+CrO +OH-;CrO
+OH-;CrO +H+→Cr2O
+H+→Cr2O +H2O;Cr2O
+H2O;Cr2O +Fe2++H+→Cr3++Fe3++H2O。
+Fe2++H+→Cr3++Fe3++H2O。
(3)K2FeO4的应用。
某水样中As元素主要以As( )存在,As(
)存在,As( )可被K2FeO4氧化为As(
)可被K2FeO4氧化为As(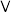 ),再通过Fe(
),再通过Fe( )吸附去除。
)吸附去除。
①K2FeO4对水中As元素的去除率随pH变化如图1所示,当pH大于7时,As去除率迅速下降的原因是___________ 。___________ 。 ,纳米铁还原废水中NO
,纳米铁还原废水中NO 的可能反应机理如图3所示。
的可能反应机理如图3所示。 的过程可描述为
的过程可描述为___________ 。
②经检验,污水经处理后,水体中NO 、NO
、NO 浓度很小,但水中总氮浓度下降不明显,原因是
浓度很小,但水中总氮浓度下降不明显,原因是___________ 。
 )。已知:K2FeO4微溶于水,在酸性或中性溶液中迅速氧化H2O产生O2,在碱性溶液中较稳定,在Fe3+和Fe(OH)3催化作用下发生分解。
)。已知:K2FeO4微溶于水,在酸性或中性溶液中迅速氧化H2O产生O2,在碱性溶液中较稳定,在Fe3+和Fe(OH)3催化作用下发生分解。(1)制备高铁酸钾。
向KOH和KClO混合溶液中加入Fe(NO3)3,过滤得到K2FeO4固体。
① 制备K2FeO4的化学方程式为
② 过滤所得的滤液中加入稀硫酸产生Cl2,原因可能是酸性条件下K2FeO4氧化了Cl-,还可能是
(2)测定 K2FeO4的纯度。
准确称取0.528 0 g K2FeO4样品置于锥形瓶中,用KOH溶液溶解,加入过量KCr(OH)4溶液,再加入硫酸酸化配成待测液,用0.3000 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准液20.00 mL,计算样品中K2FeO4的纯度
测定过程中涉及的离子反应有(未配平):Cr(OH)
 +FeO
+FeO →Fe(OH)3+CrO
→Fe(OH)3+CrO +OH-;CrO
+OH-;CrO +H+→Cr2O
+H+→Cr2O +H2O;Cr2O
+H2O;Cr2O +Fe2++H+→Cr3++Fe3++H2O。
+Fe2++H+→Cr3++Fe3++H2O。(3)K2FeO4的应用。
某水样中As元素主要以As(
 )存在,As(
)存在,As( )可被K2FeO4氧化为As(
)可被K2FeO4氧化为As(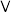 ),再通过Fe(
),再通过Fe( )吸附去除。
)吸附去除。①K2FeO4对水中As元素的去除率随pH变化如图1所示,当pH大于7时,As去除率迅速下降的原因是
 ,纳米铁还原废水中NO
,纳米铁还原废水中NO 的可能反应机理如图3所示。
的可能反应机理如图3所示。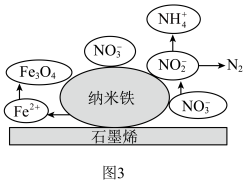
 的过程可描述为
的过程可描述为②经检验,污水经处理后,水体中NO
 、NO
、NO 浓度很小,但水中总氮浓度下降不明显,原因是
浓度很小,但水中总氮浓度下降不明显,原因是
您最近半年使用:0次
2024高三·全国·专题练习
解题方法
3 . 碳酸锰(MnCO3)是制造高性能磁性材料的主要原料。实验室以KMnO4为原料制备少量MnCO3并研究其性质,制备MnCO3的装置如图1所示。已知: MnCO3难溶于水、乙醇,100 ℃开始分解,在潮湿环境下易被氧化。
(1)选用仪器B、C的目的是___________ 。
(2)在烧瓶中加入一定量的KMnO4固体,滴加硫酸酸化的H2C2O4溶液,其反应的离子方程式为___________ 。 反应过程中c(Mn2+)随时间的变化曲线如图2所示,则t min时,c(Mn2+)迅速增大的原因是___________ 。___________ 。
(4)实验结束后,将装置A中的混合物过滤,用乙醇洗涤滤渣,再___________ ,即得到干燥的MnCO3固体。用乙醇洗涤的优点是___________ 。
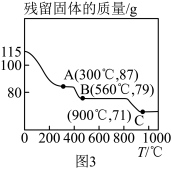
(5)在空气中加热MnCO3固体,随着温度的升高,残留固体的质量变化如图3所示。则A点的成分为___________ (填化学式);B→C反应的化学方程式为___________ 。
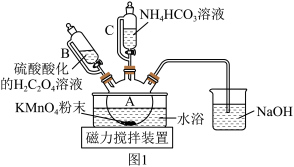
(1)选用仪器B、C的目的是
(2)在烧瓶中加入一定量的KMnO4固体,滴加硫酸酸化的H2C2O4溶液,其反应的离子方程式为
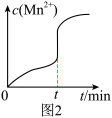
(4)实验结束后,将装置A中的混合物过滤,用乙醇洗涤滤渣,再
(5)在空气中加热MnCO3固体,随着温度的升高,残留固体的质量变化如图3所示。则A点的成分为
您最近半年使用:0次
名校
4 .  可用于制铁盐、兽药,与砂糖混用为补血剂,其工艺生产流程如下:
可用于制铁盐、兽药,与砂糖混用为补血剂,其工艺生产流程如下:
 可用于制铁盐、兽药,与砂糖混用为补血剂,其工艺生产流程如下:
可用于制铁盐、兽药,与砂糖混用为补血剂,其工艺生产流程如下: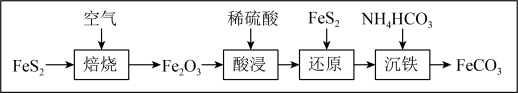
A.“焙烧”时,将 粉碎可提高焙烧效率 粉碎可提高焙烧效率 |
| B.“焙烧”过程中氧化剂和还原剂的物质的量之比为11∶4 |
C.“还原”工序中,反应的离子方程式为: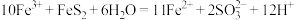 |
D.“沉铁”时,有 生成 生成 |
您最近半年使用:0次
2024高三·全国·专题练习
5 . 工业合成氨常选择反应:N2+3H2 2NH3,设NA为阿伏加德罗常数的值,下列说法正确的是
2NH3,设NA为阿伏加德罗常数的值,下列说法正确的是
 2NH3,设NA为阿伏加德罗常数的值,下列说法正确的是
2NH3,设NA为阿伏加德罗常数的值,下列说法正确的是| A.28 g N2完全反应,转移的电子数为3NA |
| B.混合气中物质的沸点:NH3>N2>H2 |
| C.在一定温度的固定容器中进行反应,通入氦气,能提高氢气的转化率 |
| D.反应物断裂NA个σ键的同时生成物断裂NA个σ键,反应达到平衡状态 |
您最近半年使用:0次
2024高三·全国·专题练习
解题方法
6 . 烟气中的SO2可以在催化剂作用下被CH4还原为S:CH4(g)+2SO2(g)=2S(g)+CO2(g)+2H2O(g),下列说法正确的是
| A.该反应的ΔS<0 |
B.该反应的平衡常数K=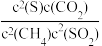 |
| C.反应每生成1molS,消耗22.4LSO2 |
| D.适当升高温度能提高催化剂的活性 |
您最近半年使用:0次
2024高三·全国·专题练习
7 . 下列由实验操作及现象所得结论正确的是
| A.将同浓度同体积的KHSO3溶液与FeCl3溶液混合,充分反应后滴入KSCN溶液,溶液变红色,证明该反应存在一定限度 |
B.室温下测得0.1mol·L-1Na2SO3溶液的pH约为10,0.1mol·L-1NaHSO3溶液的pH约为5,说明HSO 结合H+的能力比SO 结合H+的能力比SO 强 强 |
| C.将饱和NaBr溶液滴入AgCl浊液中,沉淀颜色由白色变为淡黄色,证明Ksp(AgCl)>Ksp(AgBr) |
| D.常温下,用pH试纸分别测定浓度均为0.1mol·L-1的CH3COONa溶液和Na2S溶液,后者pH大,证明酸性:H2S<CH3COOH |
您最近半年使用:0次
2024·宁夏石嘴山·一模
名校
8 . 空间站处理 的一种重要方法是对
的一种重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
Ⅰ.固态胺吸收与浓缩
在水蒸气存在下固态胺吸收 反应生成酸式碳酸盐(该反应是放热反应),再解吸出
反应生成酸式碳酸盐(该反应是放热反应),再解吸出 的简单方法是加热。
的简单方法是加热。
Ⅱ. 的加氢甲烷化
的加氢甲烷化
 还原
还原 制
制 的部分反应如下:
的部分反应如下:
i.CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g) 
ii.CO(g)+3H2 CH4(g)+H2O(g)
CH4(g)+H2O(g) 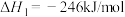
(1)反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的
CH4(g)+2H2O(g)的
___________  。
。
(2)向恒容绝热的密闭容器中充入amolCO与2amolH2,进行反应ii,下列能判断反应已达化学平衡状态的是___________ ;
a.容器中混合气体密度不变 b.混合气体中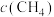 与
与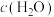 之比不变
之比不变
c.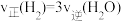 d.容器内温度不变
d.容器内温度不变
Ⅲ.和 合成甲烷也是资源化利用的重要方法。对于上述(1)的反应
合成甲烷也是资源化利用的重要方法。对于上述(1)的反应 ,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成
,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成 选择性随温度变化的影响如下图所示:
选择性随温度变化的影响如下图所示: 转化率仍在上升,其原因是
转化率仍在上升,其原因是___________ 。
(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是___________ ,使用的合适温度为___________ 。
(5)控制起始时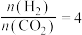 ,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:___________ (填增大,减小或者不变)。
②图中代表 的曲线是
的曲线是___________ (填“a”、“b”或“c”);温度低于500℃时,CO的物质的量分数约为0,说明此条件下,反应___________ (填“i”或“ii”)化学平衡常数大,反应完全。
③反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的平衡常数
CH4(g)+2H2O(g)的平衡常数
___________  (用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
(用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
 的一种重要方法是对
的一种重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:Ⅰ.固态胺吸收与浓缩

在水蒸气存在下固态胺吸收
 反应生成酸式碳酸盐(该反应是放热反应),再解吸出
反应生成酸式碳酸盐(该反应是放热反应),再解吸出 的简单方法是加热。
的简单方法是加热。Ⅱ.
 的加氢甲烷化
的加氢甲烷化 还原
还原 制
制 的部分反应如下:
的部分反应如下:i.CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g) 
ii.CO(g)+3H2
 CH4(g)+H2O(g)
CH4(g)+H2O(g) 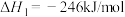
(1)反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的
CH4(g)+2H2O(g)的
 。
。(2)向恒容绝热的密闭容器中充入amolCO与2amolH2,进行反应ii,下列能判断反应已达化学平衡状态的是
a.容器中混合气体密度不变 b.混合气体中
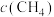 与
与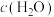 之比不变
之比不变c.
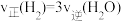 d.容器内温度不变
d.容器内温度不变Ⅲ.和
 合成甲烷也是资源化利用的重要方法。对于上述(1)的反应
合成甲烷也是资源化利用的重要方法。对于上述(1)的反应 ,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成
,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成 选择性随温度变化的影响如下图所示:
选择性随温度变化的影响如下图所示: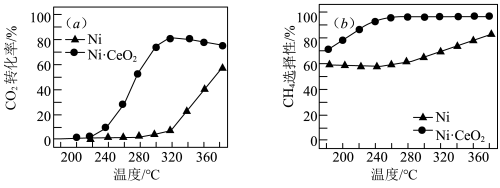
 转化率仍在上升,其原因是
转化率仍在上升,其原因是(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是
(5)控制起始时
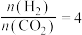 ,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示: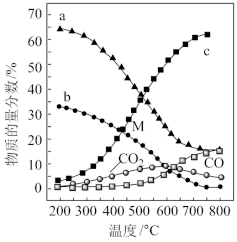
②图中代表
 的曲线是
的曲线是③反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的平衡常数
CH4(g)+2H2O(g)的平衡常数
 (用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
(用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
您最近半年使用:0次
2024-05-05更新
|
439次组卷
|
4卷引用:题型11 反应原理综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)
(已下线)题型11 反应原理综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)提升练09 化学反应原理综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)宁夏石嘴山市光明中学2024届高三第一次模拟考试理综化学试题湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题
2024·湖南益阳·三模
名校
解题方法
9 . 溴代叔丁烷与乙醇的反应进程中的能量变化如图所示。下列说法正确的是
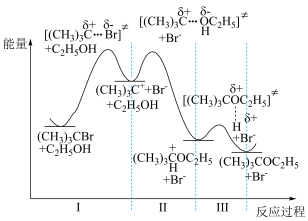
| A.溴代叔丁烷与乙醇的反应为吸热 |
| B.溴代叔丁烷和乙醇的总反应速率由反应Ⅲ决定 |
| C.氯代叔丁烷和乙醇中发生相似的反应,则反应I的活化能将增大 |
D.由该反应原理可推知,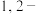 二溴乙烷和乙二醇反应可制得环丁烷 二溴乙烷和乙二醇反应可制得环丁烷 |
您最近半年使用:0次
2024-05-05更新
|
469次组卷
|
4卷引用:题型8 反应热 电化学的综合考查(25题)-2024年高考化学常考点必杀300题(新高考通用)
(已下线)题型8 反应热 电化学的综合考查(25题)-2024年高考化学常考点必杀300题(新高考通用)湖南省益阳市2024届高三4月联考暨三模考试化学统考试题(已下线)化学(山东卷01)-2024年高考押题预测卷湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题
2024高三下·全国·专题练习
解题方法
10 . 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运。通过氨热分解法制取氢气,其反应的化学方程式如下: 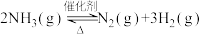
(1)根据下表数据,写出氨热分解法的热化学方程式___________ 。相关化学键的键能数据
(2)已知该反应的∆S=198.9×10-3kJ·mol-1·K-1,判断在300℃时反应是否能自发进行___________ (填“是”或“否”),理由是___________ 。
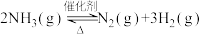
(1)根据下表数据,写出氨热分解法的热化学方程式
| 化学键 | N≡N | H-H | N-H |
| 键能E/(kJ·mol-1) | 946 | 436.0 | 390.8 |
您最近半年使用:0次



