9-10高一下·黑龙江鹤岗·期末
名校
解题方法
1 . 如图所示,表示 (正反应放热)这个可逆反应的正确图像为
(正反应放热)这个可逆反应的正确图像为
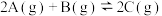 (正反应放热)这个可逆反应的正确图像为
(正反应放热)这个可逆反应的正确图像为A. | B. |
C.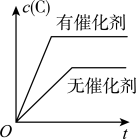 | D.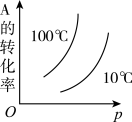 |
您最近一年使用:0次
2022-12-03更新
|
235次组卷
|
46卷引用:2014年高中化学苏教版选修四模块综合检测练习卷
(已下线)2014年高中化学苏教版选修四模块综合检测练习卷(已下线)2012-2013学年内蒙古巴彦淖尔市一中高二9月月考化学试卷(已下线)2012年苏教版高中化学选修4 2.1化学反应速率练习卷(已下线)2012-2013学年北京市房山区房山中学高二下学期期中考试化学试卷(已下线)2013-2014学年吉林省长春外国语学校高二上学期期末理科化学试卷湖北省监利县实验高中2017-2018学年高二上学期期中考试化学试题湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题苏教版化学高中必修4模块综合检测题陕西省白水中学2018-2019学年高二上学期第二次月考化学试题【全国百强校】吉林省长春市外国语学校2018-2019学年高二上学期期末考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二上学期期末考试化学试题宁夏长庆高级中学2019-2020学年高二上学期第一次月考化学试题四川省广安市岳池县第一中学2019-2020学年高二上学期第一次月考化学试题安徽省亳州市涡阳县第九中学2019-2020学年高一7月月考化学试题山西省忻州市第一中学2019-2020学年高一4月月考化学试题(已下线)第02章 化学反应的方向、限度与速率(B卷能力提升卷)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)河北省鸡泽县第一中学2020-2021学年高二上学期第一次月考化学试题辽宁省开原市第二高级中学2020-2021学年高二上学期期中考试化学试题河南省汤阴县五一中学2019-2020学年高二上学期期中考试化学试题宁夏大学附属中学2020-2021学年高二下学期第一次月考化学试题(已下线)作业04 化学平衡-2021年高二化学暑假作业(人教版2019)山西省怀仁市第一中学2021-2022学年高二上学期第二次月考理科综合化学试题(已下线)2.3.3 温度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)山西省太原市山西英才学校2021-2022学年高二上学期月考化学试题(已下线)必考点03 化学平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)安徽省宣城中学2021-2022学年高二下学期开学考试化学试题广东省广州市玉岩中学2022-2023学年高二上学期10月月考化学试题新疆乌鲁木齐市第八十中学2022-2023学年高二上学期期中考试化学试题浙江省玉环市玉城中学2022-2023学年高二上学期第一次月考化学试题 广东省广州奥林匹克中学2022-2023学年高二上学期12月考化学试题微专题(四)——化学平衡状态的判定 天津市武清区杨村第一中学2023-2024学年高二上学期第一次月考化学试题福建省福州延安中学2023-2024学年高二上学期12月月考化学试卷(已下线)09~10年鹤岗一中高一下学期期末考试化学卷(已下线)2013-2014学年湖北省部分重点中学高二上学期期中考试化学试卷(已下线)2014-2015学年湖南省衡阳市第八中学高二上学期期中考试化学试卷新疆呼图壁县第一中学2017-2018学年高二上学期期中考试化学试题江西省吉安县第三中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】江西省九江第一中学2018-2019学年高二上学期期末考试化学试题宁夏回族自治区宁夏大学附属中学2019届高三上学期第六次月考理科综合化学试题湖北省利川市第五中学2019-2020学年高二12月月考化学试题(已下线)【南昌新东方】江西省九江市第一中学2018-2019学年高二上学期期末考试化学试题江西省南康中学2020-2021学年高二上学期第四次大考化学试题广东省汕头市金山中学2020-2021学年高二上学期期末考试化学试题浙江省宁波市奉化区2021-2022学年高二上学期期末联考化学试题广东省珠海市实验中学2022-2023学年高二上学期第一次段考化学试题
2 . 相同温度下,容积均为 的两个恒容密闭容器中发生反应:
的两个恒容密闭容器中发生反应: 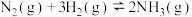
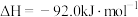
实验测得起始时的有关数据如下表:
下列叙述错误的是
 的两个恒容密闭容器中发生反应:
的两个恒容密闭容器中发生反应: 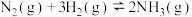
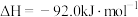
实验测得起始时的有关数据如下表:
| 容器 编号 | 起始时各物质的物质的量/ | 达到平衡时体 系能量的变化 | ||
 |  |  | ||
| ① | 1 | 3 | 0 | 放出热量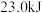 |
| ② | 0.9 | 2.7 | 0.2 | 放出热量Q |
| A.容器①②中反应的平衡常数相等 |
B.平衡时,两个容器中 的体积分数均为 的体积分数均为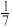 |
C.容器②中达到平衡时放出的热量 |
D.若容器①容积为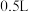 ,则平衡时放出的热量小于 ,则平衡时放出的热量小于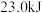 |
您最近一年使用:0次
2022-11-29更新
|
462次组卷
|
34卷引用:2018届高三一轮复习化学:微考点57-全面破解平衡常数
2018届高三一轮复习化学:微考点57-全面破解平衡常数(已下线)2011-2012学年山东省临清三中高二12月月考化学试卷(已下线)2012-2013学年河北省石家庄市高一下学期期末考试化学试卷(已下线)2013-2014学年江西省南昌市四校联考高二上学期期中考试化学试卷(已下线)2013-2014学年河北省遵化市高二上学期期中质量检测化学试卷(已下线)2013-2014学年山东省临沂市重点中学高二上学期期中考试化学试卷(已下线)2014届高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(已下线)2015届浙江省余杭区普通高中高三上学期期中联考化学试卷(已下线)2018年10月28日 《每日一题》人教选修4--每周一测江西省南城县第二中学2018-2019学年高二上学期第二次月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 等效平衡夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 等效平衡(基础过关)鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节综合训练高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 第二节综合训练河北省石家庄市藁城区第一中学2020-2021学年高二上学期第一次月考化学试题内蒙古包头市2020-2021学年高二上学期期末考试化学试题选择性必修1 专题2 第三单元综合训练河南省安阳市第三十九中学2022-2023学年高二上学期第二次考试化学试题北京市顺义牛栏山第一中学2022-2023学年高二上学期10月月考化学试题新疆乌鲁木齐市第十二中学 2022-2023学年高三下学期2月月考化学试题安徽省亳州市第一中学2022-2023学年高二下学期第一次月考化学试题湖南省长沙市明德中学2023-2024学年高二上学期第一次月考化学试题【精品卷】2.4 化学反应的调控课堂例题-人教版2023-2024学年选择性必修1(已下线)2010-2011学年浙江省兰溪一中高二下学期期中考试化学试卷(已下线)2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(已下线)2012-2013学年浙江省宁波万里国际学校高二下学期期末考试化学试卷2014-2015学年浙江省衢州第二中学高二上学期期中化学试卷2014-2015福建省龙岩市一级达标校高二上学期期末化学试卷2015-2016学年黑龙江省实验中学高二上期末考试化学试卷2017届湖南省石门一中高三上学期9月月考化学试卷广东省红岭中学2017-2018学年高二下学期第二学段考试化学试题山东省兖州市2019-2020学年高二上学期期中考试化学试题江西省万载中学2019-2020学年高二12月月考(创新班)化学试题(已下线)浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(选择题11-16)
名校
3 . 臭氧层中氧分解历程如图所示,下列说法正确的是
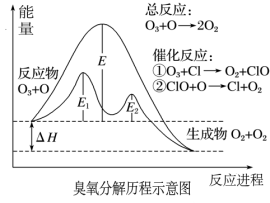

| A.催化反应①②均为放热反应 |
| B.催化剂不能改变该反应的反应热 |
| C.ClO是该反应的催化剂 |
| D.在该反应过程中没有化学键的断裂与生成 |
您最近一年使用:0次
2021-11-12更新
|
1259次组卷
|
16卷引用:2018届高三一轮复习化学:微考点43-能量图像
2018届高三一轮复习化学:微考点43-能量图像黑龙江省牡丹江市第一高级中学2018届高三10月月考化学试题黑龙江省哈尔滨市第六中学校2021届高三上学期9月月考化学试题人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过模拟 2年模拟精编精练四川省成都部分重点中学2021-2022年高二上学期期中测试化学试题陕西省榆林市第十二中学2021-2022学年高二上学期教学质量摸底评估化学试题(已下线)第07讲 化学反应与热能(讲义)-【寒假自学课】2023年高一化学寒假精品课(人教版2019必修第二册)四川省内江市第六中学2021-2022学年高二下学期入学考试(创新班)化学试题安徽省合肥市肥西县2022-2023学年高二上学期10月月考化学试题四川省宜宾市叙州区第二中学校2022-2023学年高二上学期期中考试化学试题山东省济宁市第一中学2017—2018学年高二上学期期中模块检测化学试题江西省景德镇一中2020-2021学年高一下学期期末考试化学试题云南省澄江市第一中学2021-2022年高二下学期3月月考化学试题安徽省名校联盟2022-2023学年高二上学期阶段测试(一)化学试题贵州省六盘水市外国语学校2021-2022学年高二上学期期中考试化学试题福建省泉州市等4校2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
4 . 使反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)在2 L的密闭容器中进行,半分钟后N2的物质的量增加了0.60 mol。则下列选项中反应的平均速率正确的为
| A.v(NH3)=0.040 mol·L-1·s-1 | B.v(O2)=0.015 mol·L-1·s-1 |
| C.v(N2)=0.020 mol·L-1·s-1 | D.v(H2O)=0.020 mol·L-1·s-1 |
您最近一年使用:0次
2020-11-18更新
|
290次组卷
|
7卷引用:2018届高三一轮复习化学:微考点53-化学反应速率的计算
2018届高三一轮复习化学:微考点53-化学反应速率的计算河北省唐山遵化市2019-2020学年高二上学期期中考试化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率 教材帮福建省福州第一中学2020-2021学年高二上学期期中考试化学试题(已下线)专题03 化学反应速率及影响因素、活化能【考题猜想】(9大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)(已下线)2013-2014学年江苏省无锡江阴市高二下学期期中考试化学试卷福建省泉州市第七中学 2020-2021学年高二上学期期中考试化学试题
5 . 在恒温、恒容的密闭容器中进行反应2H2O2 2H2O+ O2 ↑。若H2O2溶液的浓度由2.0 mol • L-1 降到 1.0 mol • L-1 需 10 s,那么 H2O2浓度由 1.0 mol • L-1 降到 0.5 mol • L-1 所需的反应时间为
2H2O+ O2 ↑。若H2O2溶液的浓度由2.0 mol • L-1 降到 1.0 mol • L-1 需 10 s,那么 H2O2浓度由 1.0 mol • L-1 降到 0.5 mol • L-1 所需的反应时间为
 2H2O+ O2 ↑。若H2O2溶液的浓度由2.0 mol • L-1 降到 1.0 mol • L-1 需 10 s,那么 H2O2浓度由 1.0 mol • L-1 降到 0.5 mol • L-1 所需的反应时间为
2H2O+ O2 ↑。若H2O2溶液的浓度由2.0 mol • L-1 降到 1.0 mol • L-1 需 10 s,那么 H2O2浓度由 1.0 mol • L-1 降到 0.5 mol • L-1 所需的反应时间为| A.5 s | B.大于5 s | C.小于5 s | D.无法判断‘ |
您最近一年使用:0次
2020-10-19更新
|
149次组卷
|
5卷引用:2018届高三一轮复习化学:微考点53-化学反应速率的计算
10-11高二·河南洛阳·阶段练习
名校
6 . 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理。常用的处理方法有以下两种:
方法1:还原沉淀法
该法的工艺流程为:
CrO42-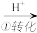 Cr2O72-
Cr2O72-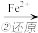 Cr3+
Cr3+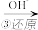 Cr(OH)3
Cr(OH)3
其中第①步存在平衡2CrO42-(黄色)+2H+ Cr2O32-(橙色)+H2O
Cr2O32-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______ 色。
(2)能说明第①步反应达平衡状态的是_____ (填序号)
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要______ mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至
Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至______ 。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为______ (用电极反应式解释)。
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______ 。
方法1:还原沉淀法
该法的工艺流程为:
CrO42-
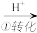 Cr2O72-
Cr2O72-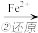 Cr3+
Cr3+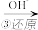 Cr(OH)3
Cr(OH)3 其中第①步存在平衡2CrO42-(黄色)+2H+
 Cr2O32-(橙色)+H2O
Cr2O32-(橙色)+H2O(1)若平衡体系的pH=2,该溶液显
(2)能说明第①步反应达平衡状态的是
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至
Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有
您最近一年使用:0次
2020-03-20更新
|
323次组卷
|
12卷引用:2014年高中化学苏教版选修四模块综合检测练习卷
(已下线)2014年高中化学苏教版选修四模块综合检测练习卷(已下线)2011-2012学年河南省偃师市高级中学高二第二次月考化学试卷(已下线)2011-2012学年度江西省临川十中上学期高三期末考试化学试卷四川省雅安中学2016-2017学年高二下学期半期考试化学试题陕西省西安市交通大学附属中学2017-2018学年高二第二次月考期末选修四测试化学试题福建省福州市第三中学2017-2018学年高二下学期期末考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(理)上学期期中考试化学试题陕西省西安市周至县第五中学2020届高三第二次模拟考试化学试题湖南省怀化市中方一中2020届高三下学期第一次模拟测试理综化学试题(已下线)2012-2013学年云南省玉溪一中高二第二次月考(6月)化学试卷(已下线)广西柳州铁路第一中学2017届高三第二次理科综合测试化学试题广东省化州市第一中学2019-2020学年高二4月线上统一测试化学试题
名校
解题方法
7 . 下列图像能正确地表达可逆反应3A(g)+B(g)⇌2C(g)(ΔH<0)的是
A.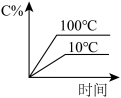 | B.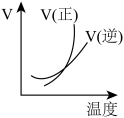 |
C. | D.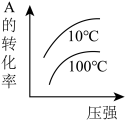 |
您最近一年使用:0次
2019-12-16更新
|
503次组卷
|
21卷引用:2018届高三一轮复习化学:微考点55-平衡移动与结果判断
2018届高三一轮复习化学:微考点55-平衡移动与结果判断(已下线)2010年河南省郑州外国语学校全真模拟(二)(理科综合)化学部分(已下线)2010-2011学年广东省白云中学高二下学期期中考试化学试卷(已下线)2011-2012学年辽宁省沈阳同泽女中高二上学期期中考试化学试卷(已下线)2013-2014学年河北省遵化市高二上学期期中质量检测化学试卷2015-2016学年河北邯郸魏县一中、曲周县一中高二上期中化学试卷2016-2017学年江西省南昌市第二中学高二上学期期末考试化学试卷(已下线)2018年9月18日 《每日一题》人教选修4-化学平衡移动的分析山东省德州市夏津一中2018-2019学年高二上学期第一次月考化学试题陕西省蓝田县焦岱中学2018-2019学年高二上学期第一次月考化学试题陕西省咸阳市西藏民族大学附属中学2019-2020学年高二上学期期中考试化学试题山西省怀仁市重点中学2019-2020学年高二上学期期末考试化学试题湖北省黄冈市麻城市实验高中2020-2021学年高二上学期10月月考化学试题(已下线)2011-2012学年山东省济宁市重点中学高二上学期期中考试化学试卷2014-2015浙江省严州中学高二下学期4月阶段性测试化学试卷湖南省湘潭、岳阳两校2015-2016学年高二上第三次联考化学卷2017届山东省枣庄三中高三上学期9月质检化学试卷湖南省岳阳市岳阳县一中、汨罗市一中2019-2020学年高二10月联考化学试题福建省长泰县第一中学2020届高三上学期期中考试化学试题云南省楚雄市楚雄实验中学2018—2019学年高二上学期9月月考化学试题福建省永安市第九中学2022-2023学年高二上学期期中考试化学(选考)试题
名校
解题方法
8 . 一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)⇌PCl3(g)+Cl2(g)。
下列说法正确的是
| 编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
| Ⅱ | 320 | 0.80 | t1 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
| A.平衡常数K:容器Ⅱ>容器Ⅲ |
| B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ |
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=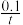 mol·L-1·s-1 mol·L-1·s-1 |
| D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行 |
您最近一年使用:0次
2019-12-05更新
|
438次组卷
|
20卷引用:2018届高三一轮复习化学:微考点57-全面破解平衡常数
2018届高三一轮复习化学:微考点57-全面破解平衡常数2017届陕西省黄陵中学高三上学期第三次质检化学试卷黑龙江省哈尔滨师范大学附属中学2020届高三上学期期中考试化学试题黑龙江省安达市第七中学2020届高三上学期第二次模拟考试化学试题河北省承德第一中学2020届高三上学期第三次月考化学试题2019年秋高三化学复习强化练习—— 等效平衡(已下线)考点10 化学平衡常数及其图象分析-2020年高考化学命题预测与模拟试题分类精编黑龙江省哈尔滨市师大附中2020-2021学年高二上学期期末考试化学试题河南省新蔡县第一高级中学2021-2022学年高二上学期9月月考化学试题2015届江苏省南通市高三第一次模拟化学试卷2016届江苏省无锡市青山高级中学高三上学期10月月考化学试卷2016届江苏省清江中学高三第四次(12月)月考化学试卷2016届福建省上杭县第一中学高三上12月月考化学试卷2016届福建省龙岩市上杭一中高三上学期12月月考化学试卷2017届江苏省苏州市高三上学期期初调研化学试卷安徽师范大学附属中学2017-2018学年高二上学期10月月考化学试题安徽省江淮名校2017-2018学年高二期中考试化学试题湖南省师范大学附属中学2016-2017学年高二(理科)上学期期末考试化学试题安徽省师范大学附中2019-2020学年高二上学期期中考试化学试题黑龙江省顶级名校2020届高三上学期期中考试化学试题
名校
9 . 如图所示,下列说法不正确的是
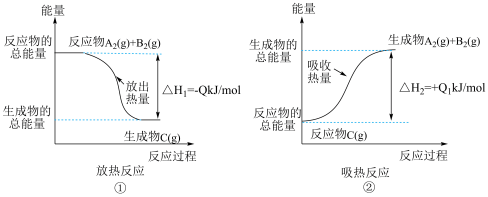

| A.反应过程①的热化学方程式为A2(g)+B2(g)=C(g) ΔH1=-Q kJ/mol |
| B.反应过程②的热化学方程式为C(g)=A2(g)+B2(g) ΔH2=+Q1 kJ/mol |
| C.Q与Q1的关系:Q>Q1 |
| D.ΔH2>ΔH1 |
您最近一年使用:0次
2019-10-17更新
|
283次组卷
|
12卷引用:2018届高三一轮复习化学:微考点43-能量图像
2018届高三一轮复习化学:微考点43-能量图像(已下线)2014高考化学名师选择题专练 化学反应中的能量变化练习卷【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第一次调研考试化学试题河北省隆化县存瑞中学2019届高三上学期第一次质检化学试题(已下线)2019年8月25日 《每日一题》选修4——每周一测2019年10月14日《每日一题》2019-2020学年高二化学人教选修4——热化学方程式的书写与正误判断(已下线)专题1.1.2 热化学方程式的书写(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)广东省广州市玉岩中学2022-2023学年高二上学期10月月考化学试题山东省济宁市微山县第二中学2017-2018学年高二上学期第一次月考化学试题云南民族大学附属中学2017-2018学年高二上学期期末考试化学试题山东省济宁市微山县第二中学2019-2020学年高二10月月考化学试题山东省济宁市泗水县2019-2020学年高二上学期期中考试化学试题
名校
10 . 一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体②H2O③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
①NaOH固体②H2O③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
| A.②④⑥ |
| B.①② |
| C.②③⑤ |
| D.②④⑤⑥ |
您最近一年使用:0次
2019-04-23更新
|
592次组卷
|
42卷引用:2018届高三一轮复习化学:微考点54-控制变量研究影响反应速率的因数
2018届高三一轮复习化学:微考点54-控制变量研究影响反应速率的因数(已下线)2010年四川省泸州天立学校高二上学期期中考试化学试卷(已下线)2010—2011学年浙江省杭州师范大学附属中学高二下学期期中考试化学试卷(已下线)2011-2012学年辽宁省沈阳同泽女中高二上学期期中考试化学试卷(已下线)2011-2012学年黑龙江省牡丹江一中高二上学期期中考试化学(理)试卷(已下线)2011-2012学年福建省罗源一中高二上学期期末考试化学试卷(已下线)2012-2013学年河北枣强中学高二上学期期末考试化学试卷2015-2016学年河北省冀州中学高二上第二次月考化学试卷江西省抚州市临川第二中学2015-2016学年高二上12月月考化学试卷2015-2016学年河北省成安一中高二上学期1月月考化学试卷2015-2016学年河南省信阳高级中学高二下开学测化学试卷2017届河北省唐山一中高三上10月月考化学试卷【全国百强校】陕西省西安市长安区第一中学2018-2019学年高二(实验班)上学期期中考试化学试题河北省张家口一中2019-2020学年高二(衔接班)上学期入学考试化学试题辽宁省锦州市义县高级中学2020-2021学年高二10月月考化学试题(已下线)第10单元 化学反应速率与化学平衡(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷陕西省子洲中学2018-2019学年高二下学期第二次月考化学试题青海省湟川中学2019-2020学年高二上学期期中考试化学试题陕西省西安市西航一中2021-2022学年高二上学期期末考试化学试题重庆市大足中学2022-2023学年高二上学期学期第一次月考化学试题陕西省咸阳市实验中学 2022-2023学年高二上学期第三次月考化学试题(已下线)2011-2012学年吉林省扶余一中高二上学期期中考试化学试卷(已下线)2011-2012学年甘肃省白银市平川中恒学校高二上学期期末考试化学(理)试卷(已下线)2011-2012学年山东省济宁市曲阜一中高二上学期期末模拟化学试卷(已下线)2013届黑龙江省大庆铁人中学高三第三次阶段化学试卷(已下线)2013-2014福建省南安一中高二下学期期末考试化学试卷(已下线)2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷2015-2016学年广西柳州铁路第一中学高二上段考理化学卷2015-2016学年福建晨曦、冷曦、正曦、岐滨四校高二上联考化学卷2015-2016学年山东省平度市高二上学期直升班抽考化学试卷2015-2016学年山东省青岛市平度市高二上学期教学质检化学试卷2015-2016学年青海师大附属二中高二下4月月考化学试卷新疆生产建设兵团第二中学2017-2018学年高二上学期期中考试化学试题【全国百强校】福建省厦门第一中学2017-2018学年高二下学期期中考试化学试题【全国百强校】重庆市第一中学2017-2018学年高二下学期期中考试化学试题福建省厦门市湖滨中学2018-2019学年高二下学期3月月考化学试题福建省厦门市湖滨中学2019-2020学年高二上学期期中考试化学(合格考)试题(已下线)【新东方】2020-4(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP415(2)】【化学】(已下线)【浙江新东方】绍兴qw105重庆市石柱中学2020-2021学年高二上学期第一次月考化学试题福建省南安市柳城中学2020-2021学年高二上学期第二次月考化学试题



