名校
1 . 某化学小组选用酸性高锰酸钾溶液和草酸( )溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:
)溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:
(1)实验原理的离子方程式:____________ 。
(2)实验2中的
______ ,目的是____________ 。
(3)根据上表中的实验数据,可以得到的结论是____________ 。
(4)利用实验1中数据计算,用 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为
______ mol/(L⋅min)。
 )溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:
)溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
a mol/L |
| 0.05 mol/L | 3 mol/L稀硫酸 | ||
1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
2 | 2.0 | v | 4.0 | 2.0 | 5.2 |
3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
(2)实验2中的

(3)根据上表中的实验数据,可以得到的结论是
(4)利用实验1中数据计算,用
 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为
您最近一年使用:0次
2024-05-04更新
|
174次组卷
|
2卷引用:北京交大附中2023-2024学年高一下学期期中考试化学试题
名校
解题方法
2 . 工业制硫酸的一步重要反应是SO2的催化氧化。在2L密闭容器中,充入SO2和足量O2,在催化剂、500℃的条件下发生反应。SO2、SO3的物质的量随时间的变化如图。下列说法不正确 的是
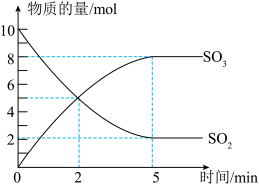
| A.在上述条件下,SO2不可能100%地转化为SO3 |
| B.反应到2min时,正逆反应速率相等 |
| C.反应开始至5min末,以SO2浓度的变化表示该反应的平均反应速率是0.8mol/(L·min) |
| D.使用催化剂是为了加快反应速率,提高生产效率 |
您最近一年使用:0次
2024-05-04更新
|
288次组卷
|
2卷引用:北京市陈经纶中学2023-2024学年高一下学期期中诊断化学试卷
名校
解题方法
3 . 根据化学反应速率和化学反应限度的知识回答下列问题:
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:___________ 。
(2)反应开始至4 min时,A的平均反应速率为___________ 。
(3)4 min时,反应是否达平衡状态?___________ (填“是”或“否”),8 min时,v正___________ v逆。(填“>”“<”或“=”)
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。___________ 。
(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为___________ 。
②反应达到平衡时,放出的热量___________ (填字母,下同)。
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为___________ 。
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)__________
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:
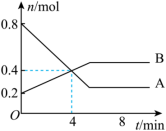
(2)反应开始至4 min时,A的平均反应速率为
(3)4 min时,反应是否达平衡状态?
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。

(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为
②反应达到平衡时,放出的热量
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)

您最近一年使用:0次
2024-04-30更新
|
281次组卷
|
2卷引用:名校期中好题汇编-化学反应与能量(非选择题)
名校
解题方法
4 . 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定反应过程中产生氢气体积V的数据,根据数据绘制得如图,则曲线a、b、c、d所对应的实验组别,有关说法错误的是
| 实验组别 |  | 温度/ ℃ | 形状(Fe) |
| Ⅰ | 2.0 | 30 | 块状 |
| Ⅱ | 2.5 | 30 | 块状 |
| Ⅲ | 2.5 | 50 | 粉末状 |
| Ⅳ | 2.5 | 50 | 块状 |
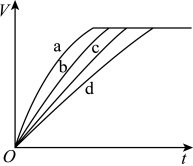
| A.曲线a对应的实验组别为Ⅲ |
| B.对比实验Ⅰ、Ⅱ说明浓度对化学反应速率的影响 |
| C.对比实验Ⅱ、Ⅳ说明温度对化学反应速率的影响 |
| D.曲线a、b、c、d对应的实验组别分别为Ⅳ、Ⅲ、Ⅱ、Ⅰ |
您最近一年使用:0次
2024-04-30更新
|
116次组卷
|
2卷引用:名校期中好题汇编-化学反应与能量(选择题)
名校
解题方法
5 . 利用硫铁矿(主要成分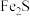 )生产硫酸和绿矾(
)生产硫酸和绿矾( )的工业流程示意图如下:
)的工业流程示意图如下:_______ 。
(2)吸收塔中,发生的主要反应的化学方程式是_______ 。
(3)反应釜中,烧渣经过反应转化为溶液I和固体。溶液I中所含溶质的化学式_______ 。
(4)操作a的主要步骤是:加热浓缩、_______ 、过滤、洗涤、_______ 。
(5)流程中,固体X可以选择硫铁矿(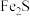 )或
)或_______ ;当固体X为硫铁矿(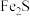 )时,将溶液I与固体发生反应的离子方程式补充完整:
)时,将溶液I与固体发生反应的离子方程式补充完整:_______ 。

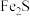 )生产硫酸和绿矾(
)生产硫酸和绿矾( )的工业流程示意图如下:
)的工业流程示意图如下: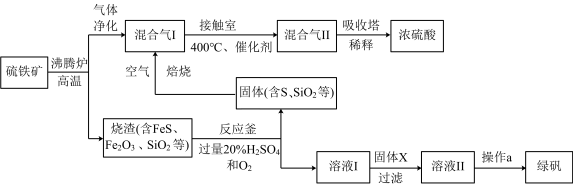
(2)吸收塔中,发生的主要反应的化学方程式是
(3)反应釜中,烧渣经过反应转化为溶液I和固体。溶液I中所含溶质的化学式
(4)操作a的主要步骤是:加热浓缩、
(5)流程中,固体X可以选择硫铁矿(
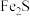 )或
)或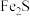 )时,将溶液I与固体发生反应的离子方程式补充完整:
)时,将溶液I与固体发生反应的离子方程式补充完整:
您最近一年使用:0次
2024-04-29更新
|
126次组卷
|
2卷引用:名校期中好题汇编-非金属元素(非选择题)
名校
解题方法
6 . 将1mol固体A置于体积不变的真空密闭容器中(固体试样体积忽略不计),在恒定温度下使其分解:A(s) 2B(g)+C(g),下列可以判断该反应已达到化学平衡状态的是
2B(g)+C(g),下列可以判断该反应已达到化学平衡状态的是
 2B(g)+C(g),下列可以判断该反应已达到化学平衡状态的是
2B(g)+C(g),下列可以判断该反应已达到化学平衡状态的是| A.物质的浓度:c(B)=2c(C) | B.混合气体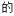 密度保持不变 密度保持不变 |
| C.B的体积分数不变 | D.混合气体的平均摩尔质量保持不变 |
您最近一年使用:0次
2024-04-29更新
|
375次组卷
|
2卷引用:福建省福州九县(区、市)一中(高中)2023-2024学年高一下学期4月期中联考化学试题
名校
解题方法
7 . I.在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图: 时刻,正逆反应速率大小
时刻,正逆反应速率大小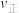
___________  。(填“>”“=”或“<”)
。(填“>”“=”或“<”)
(2)若 ,计算反应开始至
,计算反应开始至 时刻用M的浓度变化表示的平均反应速率
时刻用M的浓度变化表示的平均反应速率___________ 。
(3) 时刻化学反应达到平衡,反应物的转化率为
时刻化学反应达到平衡,反应物的转化率为___________ 。
(4)如果升高温度,则
___________ (填“增大”“减小”或“不变”)。
Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
(5)①本实验待测数据可以是___________ ,实验 和实验
和实验 可以探究
可以探究___________ 对锌与稀硫酸反应速率的影响﹔实验 和实验
和实验 可以探究
可以探究___________ 对锌与稀硫酸反应速率的影响。
②实验发现 比实验
比实验 反应速率快,原因是
反应速率快,原因是___________ 。

 时刻,正逆反应速率大小
时刻,正逆反应速率大小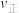
 。(填“>”“=”或“<”)
。(填“>”“=”或“<”)(2)若
 ,计算反应开始至
,计算反应开始至 时刻用M的浓度变化表示的平均反应速率
时刻用M的浓度变化表示的平均反应速率(3)
 时刻化学反应达到平衡,反应物的转化率为
时刻化学反应达到平衡,反应物的转化率为(4)如果升高温度,则

Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
| 序号 | 纯锌粉/g |  硫酸溶液/mL 硫酸溶液/mL | 温度/℃ | 硫酸铜固体/g | 加入蒸馏水/mL |
 | 2.0 | 50.0 | 25 | 0 | 0 |
 | 2.0 | 40.0 | 25 | 0 | 10.0 |
 | 2.0 | 50.0 | 25 | 0.2 | 0 |
 | 2.0 | 50.0 | 35 | 0 | 0 |
(5)①本实验待测数据可以是
 和实验
和实验 可以探究
可以探究 和实验
和实验 可以探究
可以探究②实验发现
 比实验
比实验 反应速率快,原因是
反应速率快,原因是
您最近一年使用:0次
2024-04-28更新
|
315次组卷
|
2卷引用:安徽省合肥市六校联盟2023-2024学年高一下学期4月期中考试化学试题
名校
8 . 在一定条件下,对于密闭容器中进行的反应:2SO2(g)+O2(g) 2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
 2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是A. 、 、 、 、 在容器中共存 在容器中共存 | B. 、 、 、 、 的浓度均不再改变 的浓度均不再改变 |
C. 、 、 、 、 浓度比为2:1:2 浓度比为2:1:2 | D.正、逆反应速率相等且均等于零 |
您最近一年使用:0次
2024-04-28更新
|
243次组卷
|
3卷引用:安徽省合肥市六校联盟2023-2024学年高一下学期4月期中考试化学试题
22-23高一下·江苏扬州·阶段练习
名校
解题方法
9 . 对于反应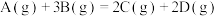 ,下列表示中反应速率最大的是
,下列表示中反应速率最大的是
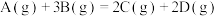 ,下列表示中反应速率最大的是
,下列表示中反应速率最大的是A.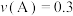 mol⋅L mol⋅L ⋅s ⋅s | B.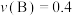 mol⋅L mol⋅L ⋅s ⋅s |
C. mol⋅L mol⋅L ⋅s ⋅s | D.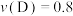 mol⋅L mol⋅L ⋅min ⋅min |
您最近一年使用:0次
2024-04-27更新
|
309次组卷
|
6卷引用:专题06 化学反应的速率与限度(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)
(已下线)专题06 化学反应的速率与限度(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)江苏省扬州中学2022-2023学年高一下学期3月月考化学试题(已下线)第05讲 化学反应的速率与限度-【寒假自学课】2024年高一化学寒假提升学与练(人教版2019)(已下线)6.2.1化学反应的速率课后作业提高篇江苏省盐城市大丰高级中学2023-2024学年高一下学期(普通班强化班)第一次阶段性考试化学试卷 江苏省盐城市五校联考2023-2024学年高一下学期3月月考化学试题
名校
解题方法
10 . 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下发生反应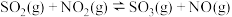 ,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
②SO2浓度:a点小于c点
③反应物的总能量低于生成物的总能量
④ ,ab段NO2的消耗量小于bc段NO2的消耗量
,ab段NO2的消耗量小于bc段NO2的消耗量
⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
⑦逆反应速率图象在此时间段内和上图趋势相同
⑧达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
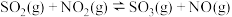 ,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为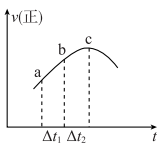
②SO2浓度:a点小于c点
③反应物的总能量低于生成物的总能量
④
 ,ab段NO2的消耗量小于bc段NO2的消耗量
,ab段NO2的消耗量小于bc段NO2的消耗量⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
⑦逆反应速率图象在此时间段内和上图趋势相同
⑧达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
| A.3个 | B.4个 | C.5个 | D.6个 |
您最近一年使用:0次
2024-04-27更新
|
439次组卷
|
2卷引用:名校期中好题汇编-化学反应与能量(选择题)




